小细胞肺癌神经内分泌起源标志物的研究进展
张 实 吴学玲
小细胞肺癌(small cell lung cancer,SCLC)约占肺癌的13%~20%,其恶性度都很高,如果不治疗,中位生存期约为3~4个月。SCLC极易转移,发现时多数已到了晚期。虽然大部分SCLC开始时对化疗敏感,但几乎总是会出现耐药,这使得其5年生存率仅为5%。研究表明早期诊断对SCLC的治疗结果有着积极的影响[1]。如果SCLC能够在局限期得到诊断,那么将有20%~25%的患者在接受联合化疗与放疗之后,可以获得一个较长生存期,因此寻找新的早期诊断方法十分重要。寻找特异性和敏感性高的血液肿瘤标志物,可为肺癌的早期诊断提供可靠、简便、安全、耐受性好的方法。现就近年来SCLC神经内分泌起源标志物的研究进展进行综述。
一、SCLC的神经内分泌特性
SCLC的典型特征是它的神经内分泌现象。可以通过对胞质内的神经内分泌颗粒及一些神经肽类、激素类的分泌物的监测,从而得到SCLC形态学和功能学上的重要信息。这些分泌物包括蛙皮素、胃泌素释放钛前体、神经降压素、缩胆囊素、神经特异性烯醇化酶、染色颗粒素、抗利尿激素、突触囊泡蛋白及乙酰胆碱。另外一些新发现的物质,比如肌酸激酶同工酶-BB(CK-BB)、神经细胞黏附分子(nerve cell adhesion molecule,NCAM)和左旋多巴脱羧酶(levodopa decarboxylase,L-DOPA decarboxylase)等也在SCLC中表达。因此,通过分析这些物质的血清/血浆检验结果,对SCLC的早期诊断、评估治疗效果、预测生存期及肿瘤的复发有帮助作用,甚至在疾病分型等方面亦有一定的指导价值。
二 神经内分泌起源标志物
1. 嗜铬粒蛋白A:嗜铬粒蛋白A(chromogranin A,CgA)是一类酸性分泌蛋白,存在于神经细胞和神经内分泌细胞之中。它以生物活性肽的前体形式分泌到血液中。由于这个家族的一些成员受沉默子RE-1等转录因素的控制,因此它们在伴有神经内分泌功能的肺癌中表达并不活跃,而且,它们在SCLC中表达方式经常改变。在几种已知的嗜铬粒蛋白中,CgA在一些神经内分泌肿瘤中均有增高,比如类癌肿瘤、胃泌素瘤和SCLC,然而在非内分泌肿瘤中,CgA鲜有增高。因此,CgA是一种广泛的内分泌类标志物,对SCLC并不特异。在SCLC中,其检出率也很低。关注CgA的特异性表位[2-3],可以提高试验的成功率。Portela-Gomes等[2]实验表明,CgA 176-195表位比其他表位更适合做SCLC的肿瘤标志物。Børglum等[3]实验表明CgA 340-348段的N端氨基酸表位在SCLC局限期敏感性为58%,广泛期为100%。而其它表位对SCLC局限期和广泛期的敏感性仅为17%~42%和55%~67%,因此证实了选择合适表位的重要性。此外,Børglum等[3]又通过独立处理实验(PIA)来检测CgA的特殊表位,其敏感性结果为:局限期67%;广泛期89%。Moss等[4]的研究表明,CgA的C端氨基酸极易受蛋白降解的影响,因此选择合适的表位还需要考虑表位稳定性等因素。Taneja等[5]发现CgA的敏感性比NSE高(61%vs. 57%),尤其在SCLC局限期中。CgA也与肿瘤负荷、生存期相关,因此它是一个评估化疗疗效的合适标志物,具有独立预测的价值,见表1。
2. 神经细胞黏附分子:神经细胞黏附分子(NCAM,CD56)可以在多种类型的细胞中找到,包括自然杀伤细胞、胸腺细胞、神经内分泌腺体细胞、中枢神经细胞、外周神经细胞以及心肌细胞。它是一种唾液糖蛋白,参与细胞间的相互作用。在SCLC中NCAM也有着很好的表达,并且是评估化疗效果的敏感标志物。一些研究证实了NCAM血清水平与SCLC具有正相关性[6],局限期的敏感性约为11%,广泛期约为37%。此外血清中NCAM增高也提示有骨髓转移。除NCAM的两种主要亚型(non-polysialylated-NCAM的相对分子量约为120×103与140×103的亚型)外,在SCLC或其他肿瘤中,也会出现NCAM的拼接变构体,例如polysialyl chain-NCAM(PSA-NCAM),这些变构体敏感性很高且容易被检测,即使在SCLC局限期中,这些变构体也有着较高的敏感性。因此它们可以为SCLC的诊断提供更多更精确的检测手段。一些研究表明PSA-NCAM比NCAM的其他表位具有更高的敏感性和特异性[7]。总的来说,PSA-NCAM血清水平与SCLC的临床分期、生存期以及骨髓转移密切相关。由于PSA-NCAM并不存在于健康人血清中,然而non-polysialylated-NCAM却存在于健康志愿者血清中,因此对PSA-NCAM的检测很有临床价值。此外,如果将PSA-NCAM与NSE的血清检测联合应用,在SCLC检测和监控等方面的确可以提供很好的指导价值,但这方面还有待于进一步探究。然而NCAM的检测并不能够区分该肿瘤是神经型还是神经内分泌型,并且它在SCLC局限期中的敏感性也较低,同时NCAM的在血液中降解等因素也会对结果产生重要影响,因此这方面的研究还需要进一步深化。
3. 脑型肌酸激酶同工酶(CK-BB):CK-BB是一种肌酸激酶同工酶,在脑中高水平表达,在胃肠道及泌尿生殖系统也有表达。在SCLC中CK-BB血清水平会升高,尤其是在疾病的进展阶段[8]。Carney等[9]发现SCLC局限期的敏感性为0~2%,广泛期大约为40%。CK-BB血清水平与化疗治疗效果存在反比关系,而与疾病转移存在正比关系。据Carney等[9]的研究表明,有四个以上转移病灶的患者,CK-BB的血清水平会很高。此外,对CK-BB的检测可以评估SCLC患者的生存期,如果治疗前患者CK-BB血清水平≤10 ng/m,那将暗示患者将有较长的生存期。这些信息表明,该种肿瘤标志物具有评估生存期和监控治疗效果等临床价值,遗憾的是,这种标志物的敏感性偏低。此外,对CK-BB设置合适的阈值十分重要。Bork等之所以在50%的局限期患者血清中检测到CK-BB,在82%的广泛期患者血清中检测到CK-BB,那是因为他们设定的阈值不同(10 ng/mlvs. 3.5 ng/ml)。设置阈值为10 ng/ml其敏感性为32%,而当设置阈值为1.5 ng/ml其敏感性为65%。因此应当慎重考虑阈值的设定,如果设置过低,会导致敏感性过低,如果设置过高,会影响特异性。因此,若想将CK-BB应用于临床,还需要设置合适的阈值。
4. 神经元特异性烯醇化酶:神经元特异性烯醇化酶(Neuron-specific enolase,NSE),也称作烯醇化酶-γ,是一种神经/神经内分泌特异性烯醇化酶的同工酶。NSE参与糖的有氧酵解,可以在神经起源或神经内分泌起源的肿瘤中检测到NSE,比如:在神经母细胞瘤和SCLC中。NSE除出现在神经组织和肿瘤衍生物之中外,它也可以在红细胞、血浆细胞和血小板中找到[10]。NSE在SCLC中常是升高的。在一项对SCLC患者CYFRA21.1、CEA、SCC-Ag、黏蛋白类和NSE的血清水平的检测中,NSE的敏感性要优于其他肿瘤标志物(敏感性为81.2%)[11]。NSE在SCLC中敏感性为43%~52%,其中20%~42%是局限期,而62%~81%是出现在广泛期。NSE血清水平可以作为评估第一周期化疗的治疗效果及预测患者生存期的一项指标。它的血清水平和肿瘤扩散有关,被认为是评估化疗效果的可靠指标。NSE也适用于SCLC与良性肺部疾病的鉴别,在COPD等良性肺部疾病中,NSE并没有增高,见表1。
然而,对SCLC及其他肺部肿瘤的分型,NSE的价值有限。在非小细胞肺癌(non-small cell lung cancer,NSCLC)患者,血清中NSE阳性率很低,可见单独检测NSE不适用于肺癌分型。虽然NSE有其缺陷,但总的来说,NSE的检测对SCLC是非常有价值的。由于试验标本受溶血污染等因素的影响,因此NSE的血液检测常会出现假阳性结果。此外对局限病变而言,它的敏感性相对较低,所以NSE在预测SCLC复发等方面并不准确[12-13]。
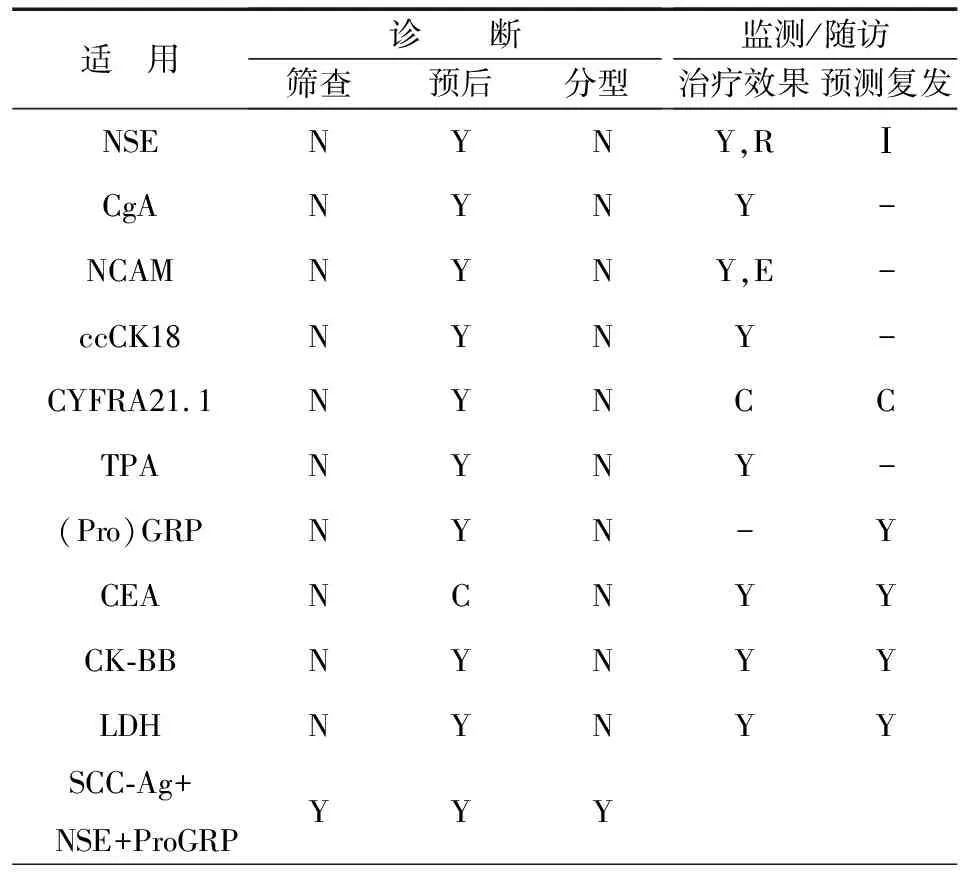
表1 肿瘤标志物分类分析
虽然单用NSE不能用于肺癌的分型,但NSE仍是评估SCLC进展的一个很有价值的标志物,在评估治疗效果和和随访检测方面占有优势,并且在非恶性肿瘤疾病中,NSE水平很低,见表1。
5. 促胃泌素释放肽:促胃泌素释放肽(pro-gastrin-releasing peptide,ProGRP)是胃泌素释放肽(gastrin-releasing peptide,GRP)的前体,它是一种肠激素,存在于神经纤维、大脑和胎肺的神经内分泌细胞中。在合并有肾功能衰竭的疾病中,ProGRP的血清水平可以升高到300 ng/ml以上。ProGRP是SCLC患者体内十分常见的产物,比GRP更具稳定性,但是必须要及时采取措施以防止它快速崩解。在长期储存方面,ProGRP在血清中比血浆中更稳定[14]。单独应用ProGRP,SCLC局限期的敏感性为60%~70% ,广泛期为75%~90%,可见其敏感性比NSE还要高[15]。Kim等[16]的试验结果表明,如果用血浆代替血清,其敏感性会增加更多,区分良性疾病的敏感性为84%,区别NSCLC的敏感性为87%。这表明采用血浆标本检测ProGRP较易区分SCLC和NSCLC。然而,ProGRP在少部分NSCLC和良性疾病中也可以被检测出来,其在NSCLC中的敏感性为16%,良性疾病为3%。Wójcik等[17]的研究表明,ProGRP的血清水平可以用来评估局限病变的治疗效果。
ProGRP的血清水平与吸烟具有正相关性[18],还可以预测SCLC的复发。但是,ProGRP血清水平不能用来评估化疗效果。此外多元分析也表明,该种标志物没有独立预测SCLC的意义,见表2。
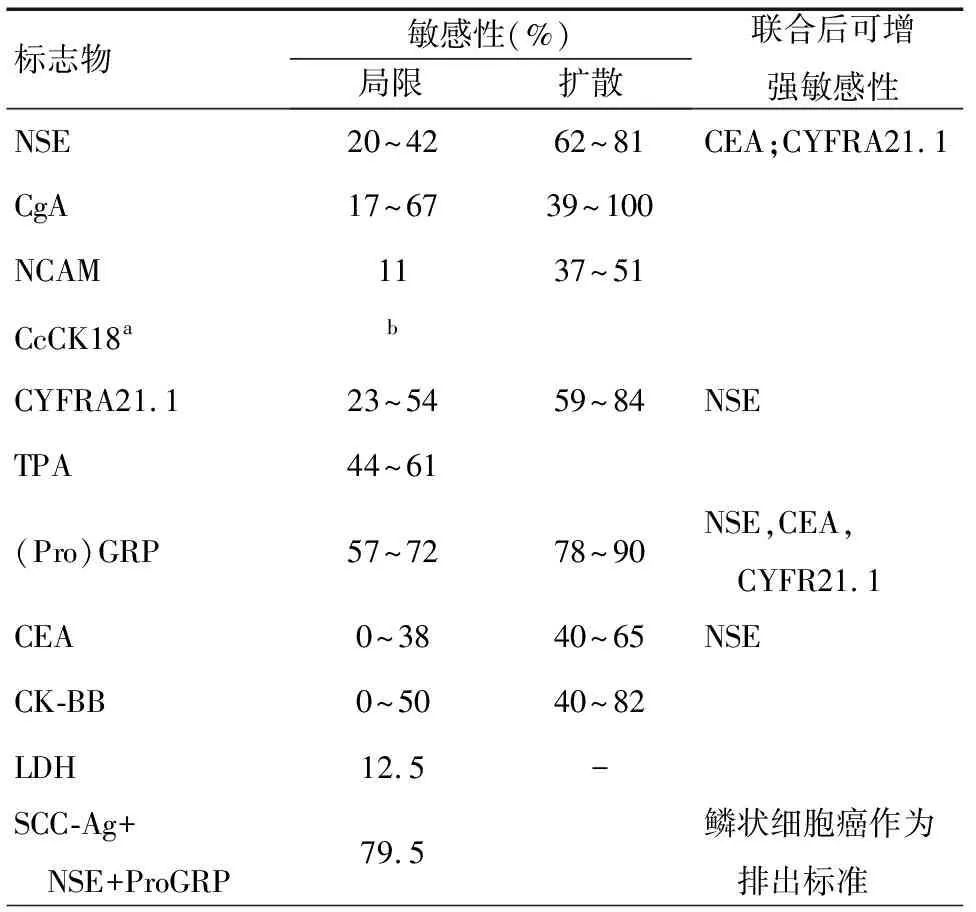
表2 SCLC相关标志物血液检查的敏感性
三、标志物的联合应用
上述神经内分泌起源标志物单独应用缺陷很多,但如果将上述标志物与其他常用肺癌标志物联合应用将会提高试验的敏感性或/和特异性。研究表明,联合CEA与NSE将会提高试验的敏感性[19]。联合检测CEA、CYFRA21.1、NSE与 ProGRP将会提高肺部良性疾病的鉴别能力[20-23],联合应用NSE与CYFRA21.1对SCLC的早期诊断意义很大,因为它可以将SCLC局限期的试验敏感性提高到78%。但如果单独应用,其在局限期中的敏感性仅为42%,CYFRA21.1仅为54%,联合用用NSE与CYFRA21.1会提高其评估生存期的临床价值。由于ProGRP在诊断方面很有价值,而NSE在预测生存期方面也很有价值,因此联合检测NSE与ProGRP可以获得诊断及预后两方面的信息。联合检测SCC-Ag (作为排除标准)、NSE以及ProGRP可以将SCLC的敏感性增加到79.5%,将其特异性增加到99.6%,将其预测的价值提升到98.6%。Molina等[24]研究表明,选择合适的肿瘤标志物进行联合检测,有可能为肺癌的病理学分型提供一定的帮助。
因此,选择一组合适的生物标志物将会提高试验的诊断率,比如SCC-Ag,NSE and ProGRP的组合就具有很高的临床价值,可以用于SCLC的筛查。
四、总结及展望
虽然神经内分泌起源标志物能提供很多重要信息,但并不表明它们可以应用于临床需求的各种情况。尚需要大量的临床试验来验证它们的可靠性。目前需要从以下几个方面来优化神经内分泌相关标志物的试验及研究。
1. 应该用统计学来对结果进行分析解释,以增加结果的说服力。并通过数据分析设计新的试验方案,扩大样本量,进行前瞻性研究,以提高结果的可靠性。
2.神经内分泌相关标志物试验应该在临床标本验证并确诊疾病后执行,以便分析它们的其他应用价值,比如与SCLC转移的相关性,评估新药新治疗方案治疗效果等。如果可能,一些有潜力的神经内分泌起源标志物可以在健康人群或者在有SCLC高危因素的人群中进行检测,并随访几年以观察标志物与肺癌的关系。
3.由于试验最终要用于临床,因此标志物存在与否的量化标准(如截止值),必须要妥善制定。
总的来说,目前还没有一种神经内分泌起源标志物是SCLC的诊断和监控的最优选择。绝大多标志物敏感性偏低,尤其在SCLC局限期中。此外,由于没有一个神经内分泌相关标志物仅表达于SCLC中,一些标志物甚至可表达在正常的组织、良性肺部疾病和/或其他类型的肿瘤中,较低的特异性也限制了此类标志物的临床价值。因此,采取联合检测肿瘤标志物的策略可能会提供解决方案。
参 考 文 献
1 Lee CB,Morris DE,Fried DB,et al. Current and evolving treatment options for limited stage small cell lung cancer[J]. Curr Opin Oncol,2006,18(2): 162-172.
2 Portela-Gomes GM,Grimelius L,Stridsberg M,et al. Expression of amino acid sequences of the chromogranin A molecule and synaptic vesicle protein 2 in neuroendocrine tumors of the lung[J]. Virchows Arch,2005,446(6): 604-612.
3 Børglum T,Rehfeld JF,Drivsholm LB,et al. Processing-independent quantitation of chromogranin a in plasma from patients with neuroendocrine tumors and small-cell lung carcinomas[J]. Clin Chem,2007,53(3): 438-446.
4 Moss AC,Jacobson GM,Walker LE,et al. SCG3 transcript in peripheral blood is a prognostic biomarker for REST-deficient small cell lung cancer[J]. Clin Cancer Res,2009,15(1): 274-283.
5 Taneja TK,Sharma SK. Markers of small cell lung cancer[J]. World J Surg Oncol,2004,2: 10.
6 Abidin AZ,Garassino MC,Califano R,et al. Targeted therapies in small cell lung cancer: a review[J]. Ther Adv Med Oncol,2010,2(1): 25-37.
7 Kochlamazashvili G,Senkov O,Grebenyuk S,et al. Neural cell adhesion moleculeassociated polysialic acid regulates synaptic plasticity and learning by restraining the signaling through GluN2B-containing NMDA receptors[J]. J neurosci,2010,30(11): 4171-4183.
8 Wallimann T,Tokarska-Schlattner M,Schlattner U. The creatine kinase system and pleiotropic effects of creatine[J]. Amino Acids,2011,40(5): 1271-1296.
9 Carney DN,Zweig MH,Ihde DC,et al. Elevated serum creatine kinase BB levels in patients with small cell lung cancer[J]. Cancer Res,2004,44(11): 5399-5403.
10 Massabki PS,Silva NP,Lourenço DM,et al. Neuron specific enolase concentration is increased in serum and decreased in platelets of patients with active systemic sclerosis[J]. J Rheumatol,2003,30(12): 2606-2612.
11 Molina R,Auge JM,Escudero JM,et al. Mucins CA 125,CA 11.1,CA 15.3 and TAG-72.3 as tumor markers in patients with lung cancer: comparison with CYFRA 21-1,CEA,SCC and NSE[J]. Tumour Biol,2008,29(6): 371-380.
12 Ebert W,Muley T,Trainer C,et al. Comparison of changes in the NSE levels with clinical assessment in the therapy monitoring of patients with SCLC[J]. Anticancer Res,2002,22(2B): 1083-1089.
13 孙红梅,陈文彰,燕丽香,等. 五种血清肿瘤标志物在肺癌患者中的临床分析[J/CD]. 中华临床医师杂志:电子版,2013,7(17): 7788-7793.
14 Nordlund MS,Bjerner J,Warren DJ,et al. Progastrin-releasing peptide: stability in plasma/serum and upper reference limit[J]. Tumour Biol,2008,29(3): 204-210.
15 Molina R,Augé JM,Bosch X,et al. Usefulness of serum tumor markers,including progastrin-releasing peptide,in patients with lung cancer: correlation with histology[J]. Tumour Biol,2009,30(3): 121-129.
16 Kim HR,Oh IJ,Shin MG,et al. Plasma proGRP concentration is sensitive and specific for discriminating small cell lung cancer from nonmalignant conditions or non-small cell lung cancer[J]. J Korean Med Sci,2011,26(5): 625-630.
17 Wójcik E,Kulpa JK,Sas-Korczyńska B,et al. ProGRP and NSE in therapy monitoring in patients with small cell lung cancer[J]. Anticancer Res,2008,28(5B): 3027-3033.
19 Molina R,Auge JM,Escudero JM,et al. Mucins CA 125,CA 19.9,CA 15.3 and TAG-72.3 as tumor markers in patients with lung cancer: comparison with CYFRA 21-1,CEA,SCC and NSE[J]. Tumour Biol,2008,29(6): 371-380.
20 Oremek GM,Sauer-Eppel H,Bruzdziak TH. Value of tumour and inflammatory markers in lung cancer[J]. Anticancer Res,2007,27(4A): 1911-1915.
21 陈菊芬. 肿瘤标志物CYFRA21-1,NSE及CEA联合检测在肺癌诊断中的价值[J]. 实用临床医药杂志,2013,17(15): 20-22.
22 李 慧,陈艳乐,常静侠,等. 肿瘤标志物在肺癌诊断、病理分型和临床分期中的价值[J/CD]. 中华肺部疾病杂志:电子版,2013,6(2):144-148.
23 叶 清,蒋捍东. 肺癌患者血清肿瘤标志物水平变化与化疗疗效及生存时间的相关性[J/CD]. 中华肺部疾病杂志:电子版,2013,6(6):500-503.
24 Molina R,Augé JM,Bosch X,et al. Usefulness of serum tumor markers,including progastrin-releasing peptide,in patients with lung cancer: correlation with histology[J]. Tumour Biol,2009,30(3): 121-129.

