小鼠微小RNA miR-21真核表达载体构建及其在293细胞的活性表达
,, ,,
(第三军医大学预防医学院全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室,重庆市纳米医药工程技术研究中心,重庆 400038)
微小RNAs(microRNAs,miRNAs)是一类由基因组编码的长度约20 nt的高度保守的内源性微小的非编码单链RNA分子,通过与对应的靶mRNA的3’非翻译区(3’ untranslated region,3’UTR)的非完全或完全配对结合,从而阻止其翻译或破坏其稳定性,实现对基因表达的调控[1]。越来越多的研究表明,miRNAs 参与了细胞增殖、凋亡、分化等众多基础生物学事件,是一类重要的调控分子,其在创伤修复中的作用也越来越受到重视[2-3]。我们和其他学者均发现,miR-21在皮肤创伤愈合过程中表达上调,创面局部抑制其表达能够显著削弱愈合的速度与质量,证实其是创伤促愈的重要分子,也提示其可能是促进创伤愈合的新的治疗靶点[4-5]。为进一步研究miR-21作为潜在治疗靶点的可行性,本研究构建了miR-21真核表达质粒,为后续使用其进行创面局部干预治疗奠定了基础。
1 材料与方法
1.1 材料
质粒pRc/CMV、pMIR-Reporter、β-半乳糖苷酶质粒、大肠杆菌DH5α和293细胞由本所保存。快速质粒提取试剂盒、胶回收试剂盒、β半乳糖苷酶检测试剂盒和荧光素酶活性检测试剂盒购于Promega公司,基因组DNA提取试剂盒和PCR产物纯化试剂盒为Omega公司产品。限制性内切酶、Taq DNA聚合酶、T4DNA连接酶、总RNA提取试剂RNAiso购自TaKaRa公司,引物和探针由上海英骏公司合成,Lipofectamine2000购自Invitrogen公司。尼龙膜为Roche公司产品,杂交液购自Clontech。
1.2 方法
1.2.1 PCR引物的设计与合成 根据Sanger miRBase数据库所提供的含有miR-21前体序列(pre-miR-21)的小鼠基因组序列,针对pre-miR-21上游154 bp和下游136 bp之间的382 bp的区域设计引物,并在引物上引入末端的保护性碱基、Hind Ⅲ和XbaⅠ的酶切位点(下划线序列)。引物由上海英骏生物技术有限公司合成。引物序列如下:F:5’-CCCAAGCTTCCCTGTTCATTTTGTTTTGC-3’;R:5’-TGCTCTAGA CTTGATACTGCTGCTGTTGT-3’。
1.2.2 PCR扩增 取C57小鼠1只,剪取尾部组织,依照试剂盒说明提取全基因组DNA。以小鼠基因组DNA为模板,行PCR扩增,得到约390 bp的目的片段,退火温度为50 ℃。
1.2.3 真核表达载体pRC/CMV-mmu-miR-21构建与鉴定 以Hind Ⅲ和XbaⅠ对质粒pRC/CMV行双酶切,酶切后对产物进行胶回收。同时对PCR扩增的mmu-miR-21基因的产物以PCR产物纯化试剂盒进行纯化后也以Hind Ⅲ和XbaⅠ双酶切,酶切后重复进行产物纯化。将酶切纯化后的pRC/CMV和mmu-miR-21PCR片段以T4DNA连接酶16 ℃连接过夜,电转法转入E.coliDH5α感受态细菌,LB平板筛选氨苄青霉素抗性克隆,菌落PCR初步鉴定阳性克隆,Hind Ⅲ/XbaⅠ双酶切鉴定后送测序进一步证实。
1.2.4 pmiR-21-Luc reporter荧光素酶报告质粒的构建 合成含有与miR-21分子完全互补的寡核苷酸序列,F:5’-CAATGCACTAGTTCAACATCAGTCTGATAAGCTAgctcagcAATGCA-3’;R:5’-AGCTTGCATTgctgagcTAGCTTATCAGACTGATGTTGAACTAGTGCATTGAGCT-3’。正向序列下划线为其与成熟的miR-206分子完全互补的DNA序列;小写字母序列为引入的Blp I酶切位点序列,以便于连接成功后的鉴定;反向序列与正向除完全互补外,在两端引入了Sac I和Hind Ⅲ突出的酶切位点序列,以斜体大写字母表示。以Sac I和Hind Ⅲ对pMIR-Reporter质粒进行双酶切而后纯化回收与寡核苷酸退火产物以T4DNA连接酶16 ℃连接过夜,电转法转入E.coliDH5α感受态细菌,LB平板筛选氨苄青霉素抗性克隆,Hind Ⅲ/XbaⅠ双酶切鉴定后送测序进一步证实。
1.2.5 细胞转染与稳定克隆的筛选 人胚肾293细胞,在含10%新生牛血清的DMEM高糖培养基中于37 ℃、5%CO2的孵箱中培养。转染前24 h以胰酶消化293细胞,计数后以每孔1×105的数目接种于24孔板内。转染按照Lipofectamine 2 000的说明书进行,分别转染pRC/CMV空载体和 pRC/CMV-mmu-miR-21等2个组别。转染后6 h,更换其完全培养基。转染后24 h,换以含G418(1 000 ug/mL)的筛选培养基进行筛选,3周后获得稳定细胞系,扩大培养。
1.2.6 稳定转染293细胞miR-21的Northern blot检测 转染后获得的稳定细胞系用RNAiso裂解,提取总RNA具体方法参照说明书进行。DNA探针序列miR-21:5’-TCAACATCAGTCTGATAAGCTA-3’,采用地高辛在3’末端标记探针。取20 μg总RNA上样,行20%尿素变性聚丙烯酰胺凝胶电泳进行分离,半干转印恒流0.4 A转尼龙膜1 h。紫外交联1 200 μJ/min,而后80 ℃烘烤1 h,加入探针后于42 ℃杂交过夜。洗膜后以含5%脱脂奶粉的PBST封闭1 h,碱性磷酸酶(AP)标记的地高辛抗体1︰1 000在37 ℃孵育2 h,NBT/BCIP系统进行显色。
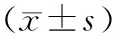
2 结果
2.1 PCR扩增含有pre-miR-21的基因组片段
以小鼠基因组DNA为模板进行miR-21前体对应的基因组片段扩增,PCR产物在1%琼脂糖凝胶上电泳,在390 bp处有一清晰特异扩增条带,片段大小与预测长度相符(图1)。
2.2 重组质粒pRC/CMV-mmu-miR-21构建
Hind Ⅲ/XbaⅠ双酶切pRC/CMV-mmu-miR-21重组载体,1%琼脂糖凝胶电泳,可见大小约为0.4 kb和5.5 kb片段。其中0.4 kb片段为含有miR-21的前体片段,5.5 kb片段为pRC/CMV载体,经测序证实插入片段与预测结果完全相符(图2)。
2.3 重组pmiR-21-Luc reporter荧光素酶报告质粒构建
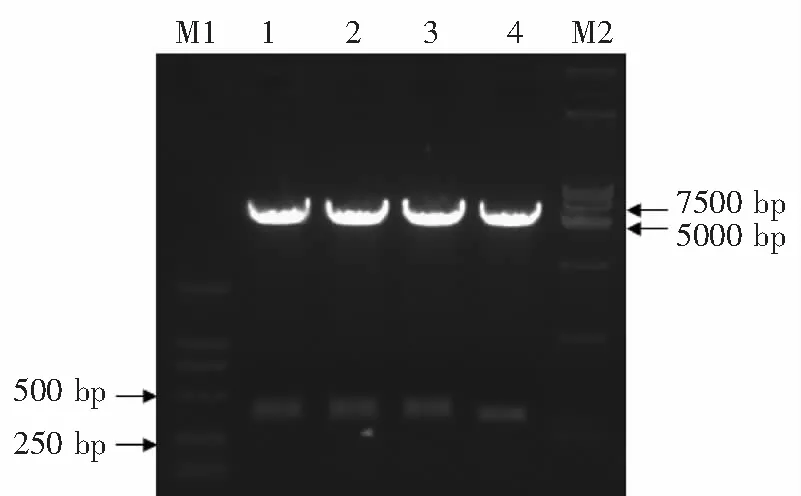
回收Sac I/Hind Ⅲ双酶pMIR-Reporter质粒的产物与前述寡核苷酸的退火产物进行连接后电转感受态菌,涂氨苄青霉素抗性LB平板后培养挑取克隆摇菌。对所得的克隆行Blp I单酶切可见阳性克隆能够被成功线性化,出现大小约6 500 bp的条带(图3)。进一步测序证实插入片段与预期设计完全相符。
2.4 稳定转染pRC/CMV-mmu-miR-21的293细胞miR-21表达的Northern blot鉴定
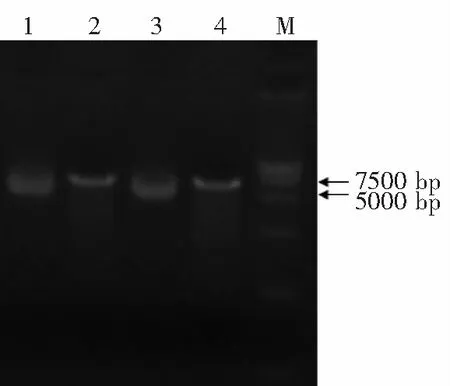
对稳定转染pRC/CMV空载体和pRC/CMV-mmu-miR-21重组质粒的293细胞提取总RNA,行Northern blot检测miR-21。结果显示:转染pRC/CMV空载体的293细胞没有杂交信号,而转染pRC/CMV-mmu-miR-21重组质粒的293细胞中可见明显而特异的杂交条带(图4)。
2.5 pRC/CMV-mmu-miR-21介导的miR-21过表达能够调控报告质粒的荧光素酶活性
在荧光素酶基因的3’UTR插入与miR-21完全互补的序列成功构建pmiR-21-Luc reporter报告基因质粒后,通过与miR-21真核表达质粒共转染293细胞,进而检测荧光素酶活性变化,发现过表达的miR-21可以通过识别这一位点进而对荧光素酶的活性起到抑制作用,降低为空质粒对照组的29.19%(P=0.000 12),差异显著,表明miR-21真核表达质粒在293细胞中的产物具有生物活性(图5)。

M:DL2000 marker;1、2:miR-21前体片段PCR产物
M1:DL2000;M2:DL15000;1-4:Hind Ⅲ/XbaⅠ双酶切阳性克隆
图2重组质粒pRC/CMV-mmu-miR-21的双酶切鉴定
M:DL15000;1-4:BlpI单酶切质粒; 1、3:未重组质粒;2、4:重组质粒
图3重组质粒pmiR-21-Lucreporter的酶切鉴定

1:空载体对照;2:pRC/CMV-mmu-miR-21转染组
图4稳定表达pRC/CMV-mmu-miR-21的293细胞中miR-21表达的Northernblot鉴定
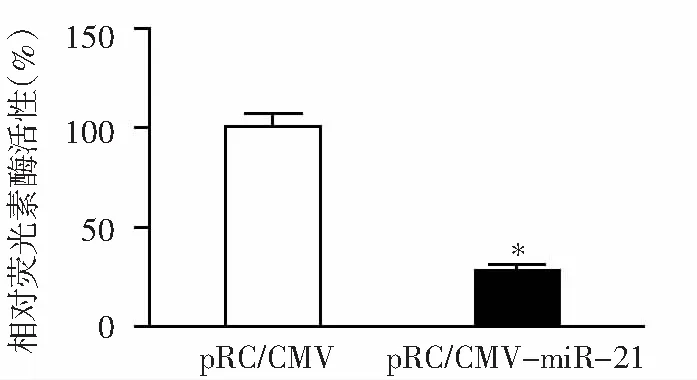
*:与空质粒对照组(pRC/CMV)比较,P<0.01
图5pRC/CMV-mmu-miR-21下调荧光素酶报告基因的活性
3 讨论
miR-21是进化非常保守的一个miRNA分子,在小鼠定位于11号染色体,位于穿膜蛋白基因TMEM49的3’UTR区域。众多研究表明,miR-21具有促进细胞增殖与迁移、抑制细胞凋亡等重要功能,由于其在胶质瘤、乳腺癌、结肠癌、肝癌等多种肿瘤组织高表达,因此认为其是一重要的癌基因[6-8]。目前已鉴定出的miR-21分子的靶基因包括PTEN、PDCD4、TPM1等,这些靶基因多属于抑癌基因,能够抑制细胞增殖、移行,促进凋亡[9-11]。
我们前期进行了小鼠正常皮肤和全层皮肤切割伤修复早期组织的miRNAs表达谱差异分析,发现并验证miR-21分子在损伤后上调非常明显,原位杂交显示其在损伤修复细胞呈广谱的上调表达,推测其作为癌基因在损伤后上调表达可能具有重要的促进愈合的生理功能。后续的研究发现,创面局部抑制miR-21分子的表达能够显著抑制创面的愈合,会明显延迟创面早期收缩、再上皮化和胶原的后期沉积,表明其是创面愈合的重要促愈分子[5]。其他的研究也相互印证地表明miR-21在创伤愈合中的重要作用[4,12]。然而,亦有学者认为, miR-21在静脉曲张难愈性创面表达上调,参与了创面难愈的发生[13]。这种截然相反的结论是实验动物种属的差别所致,还是实验材料的不同所致,很有理清的必要。我们认为其在损伤后的广谱表达上调,抑制后的修复延迟,都提示miR-21具有作为促愈靶点的潜力。而创面直接注射裸质粒是一种有效的实验性促愈效应观察手段,为此我们构建了miR-21的真核表达载体。
作为内源性分子的miRNAs通常是通过pol-Ⅱ启动子启动转录,进而经过复杂的剪切加工才形成成熟的单链功能分子[14-15]。但利用人工的shRNA的质粒骨架,引入类似于siRNA的较短设计序列也可以实现miRNA产物的高效加工表达[16]。然而,作为内源性调控分子的miRNAs的加工有其特殊性,这一点在miR-21分子的表现很明显,miR-21分子的表达除了受到转录调控外,还存在TGF-/Smad通路的转录后调控[17]。考虑到后续创面研究的实际情况,存在创面大量TGF-β分子的表达[18-20]。因此本研究选择了带有CMV启动子的pRc/CMV质粒。我们将含有pre-miR-21片段的大约400 bp的PCR产物克隆到该真核表达载体,经酶切鉴定和测序验证,成功构建了重组质粒。然而,其能否成功表达成熟的miR-21产物还需要验证,因为转录出的序列的正确加工有赖于其与周围序列相互作用的结构,克隆产物未必一定能加工出成熟miR-21的分子。为此我们进行了后续的鉴定工作,将重组真核表达质粒转染到293细胞,经培养基中G418的筛选压力获得持续稳定表达的细胞,进而通过Northern blot检测到其确实高效表达了成熟的miR-21分子。miRNA的作用方式主要是与靶mRNA分子的3’非翻译区(3’UTR)结合,从而导致靶mRNA的降解或抑制它的翻译。我们进一步通过荧光素酶报告基因活性分析,确认该质粒表达的miR-21可以抑制报告基因的活性,表明其具有功能。这些工作为后续在皮肤创面研究miR-21的功能和以其为靶点的促愈策略初步奠定了基础。
[参考文献]
[1] Ambros V.MicroRNA pathways in flies and worms:growth,death,fat,stress,and timing[J].Cell,2003,113(6):673-676.
[2] Roy S,Sen CK.miRNA in wound inflammation and angiogenesis[J].Microcirculation,2012,19 (3):224-232.
[3] Bostjancic E,Glavac D.Importance of microRNAs in skin morphogenesis and diseases[J].Acta Dermatovenerol Alp Panonica Adriat,2008,17(3):95-102.
[4] Yang X,Wang J,Guo SL,et al.miR-21 promotes keratinocyte migration and re-epithelialization during wound healing[J].Int J Biol Sci,2011,7(5):685-690.
[5] Wang T,Feng Y,Sun H,et al.miR-21 regulates skin wound healing by targeting multiple aspects of the healing process[J].Am J Pathol,2012,181(6):1911-1920.
[6] Nair VS,Maeda LS,Ioannidis JP.Clinical outcome prediction by microRNAs in human cancer:a systematic review[J].J Natl Cancer Inst,2012,104(7):528-540.
[7] Moore LM,Zhang W.Targeting miR-21 in glioma:a small RNA with big potential[J].Expert Opin Ther Targets,2010,14(11):1247-1257.
[8] Xiong B,Cheng Y,Ma L,et al.MiR-21 regulates biological behavior through the PTEN/PI-3 K/Akt signaling pathway in human colorectal cancer cells[J].Int J Oncol,2013,42(1):219-228.
[9] Qi L,Bart J,Tan LP,et al.Expression of miR-21 and its targets (PTEN,PDCD4,TM1) in flat epithelial atypia of the breast in relation to ductal carcinoma in situ and invasive carcinoma[J].BMC Cancer,2009,9:163.
[10] Wang T,Zhang L,Shi C,et al.TGF-beta-induced miR-21 negatively regulates the antiproliferative activity but has no effect on EMT of TGF-beta in HaCaT cells[J].Int J Biochem Cell Biol,2012,44(2):366-376.
[11] Das A,Ganesh K,Khanna S,et al.Engulfment of apoptotic cells by macrophages:a role of microRNA-21 in the resolution of wound inflammation[J].J Immunol,2014,192(3):1120-1129.
[12] Madhyastha R,Madhyastha H,Nakajima Y,et al.MicroRNA signature in diabetic wound healing:promotive role of miR-21 in fibroblast migration[J].Int Wound J,2012,9(4):355-361.
[13] Pastar I,Khan AA,Stojadinovic O,et al.Induction of specific microRNAs inhibits cutaneous wound healing[J].J Biol Chem,2012,287(35):29324-29335.
[14] Cullen BR.Transcription and processing of human microRNA precursors[J].Mol Cell,2004,16(6):861-865.
[15] Zeng Y,Cullen BR.Sequence requirements for micro RNA processing and function in human cells [J].RNA,2003,9(1):112-123.
[16] Wu J,Bonsra AN,Du G.pSM155 and pSM30 vectors for miRNA and shRNA expression[J].Methods Mol Biol,2009,487(2):205-219.
[17] Davis BN,Hilyard AC,Lagna G,et al.SMAD proteins control DROSHA-mediated microRNA maturation[J].Nature,2008,454(7200):56-61.
[18] Werner S,Grose R.Regulation of wound healing by growth factors and cytokines[J].Physiol Rev,2003,83(3):835-870.
[19] Cross KJ,Mustoe TA.Growth factors in wound healing[J].Surg Clin North Am,2003,83(3):531-545.
[20] Grazul-Bilska AT,Johnson ML,Bilski JJ,et al.Wound healing:the role of growth factors[J].Drugs Today (Barc),2003,39(10):787-800.

