自体骨髓干细胞移植治疗胫骨骨折骨不连
,,, ,,
(1.重庆市涪陵中心医院骨科,重庆 涪陵 408000;2.第三军医大学新桥医院骨科,重庆 400037)
在临床上,可能遇到合并有严重皮肤软组织损伤的开放性胫骨骨折。在这类损伤的患者中,通常选用外固定支架固定胫骨骨折,同时可能需要反复多次清创、游离植皮、皮瓣转移等治疗以修复局部软组织损伤及缺损。当骨折固定伤口艰难闭合之后,可能会遇到胫骨骨折骨不连。此时,若拆除外固定支架,行切开植骨钢板内固定治疗,可能会因局部软组织条件差,出现伤口闭合困难、钢板骨质外露、感染等诸多问题。而采用不予任何干预的保守治疗,又可能会出现骨不连的问题。面对两难的困境,目前的治疗方法包括局部超声刺激、电及电磁刺激,也采用局部注射红骨髓或者促进骨折愈合的药物等治疗[1]。有文献报道[2],这类损伤的患者当中,胫骨骨折骨不连的发生率仍高达23%。在处理这类损伤中,笔者采用自体骨髓干细胞移植治疗胫骨骨折骨不连患者11例,疗效满意,现报告如下。
1 资料与方法
1.1 临床资料
本组患者11例,男7例,女4例,年龄17~49岁。致伤原因:车祸伤9例,重物砸伤2例。骨折均为开放性,其中粉碎性骨折4例,复位后无明显骨缺损10例。其中合并皮肤脱套伤6例,合并皮肤软组织挫裂3例,单纯的开放性伤口2例。经过1次手术2例(2例单纯的开放性伤口),经过3次手术5例(合并皮肤脱套伤3例,合并皮肤软组织挫裂2例),经过4次手术4例(合并皮肤脱套伤3例,合并皮肤软组织挫裂1例)。局部行游离植皮9例瘢痕愈合。骨折均为外固定架固定,病程11~27周,平均19周。所有病例无严重骨折移位和畸形,X线检查明确骨不连存在,骨折间隙小于5 mm。
1.2 治疗方法
经医学伦理委员会、患者及家属同意,并签署知情同意书。完善术前相关检查以明确患者胫骨骨不连部位无活动性感染灶,全身无感染症状及迹象,无血液系统异常病变。患者在没有骨髓穿刺相关禁忌证的条件下,在手术室常规消毒铺巾,局麻下行骨髓穿刺抽取约150~200 mL骨髓液(多点同时采集),并送检、分离及培养骨髓间充质干细胞(MSCs),同时分别在穿刺即刻、术后1周、术后2周,取患者外周血分离血清以供MSCs的培养扩增。培养约3周之后,计数MSCs达到106/mL数量级(约5~10 mL)备用,流式细胞仪检测细胞表面标志物。在手术室X线透视定位下,用14号骨穿针准确刺入胫骨骨不连部位,完全注入骨髓间充质干细胞悬浮液。注射完毕后局部伤口无菌敷料加压包扎。术后每月复查患肢正侧位X线片。
2 结果
流式细胞仪检测提示均表达MSCs相关表面标志物CD13、CD90,CD13、CD90阳性率达92.31%,而不表达造血标志物CD14、CD45(图1)。本组11例均获随访,随访时间为4~27个月,平均13个月,所有病例均获得骨折愈合,愈合时间为4~11个月,平均7个月。患肢功能均恢复正常功能,能负重行走,未见跛行,随访期间未发生再次骨折。术后1个月复查X线片显示:7例可见骨折端周围有骨痂形成、局部毛糙,所有病例骨折处压痛及叩痛减轻。术后2个月复查X线片显示:所有病例骨折端周围可见有骨痂形成,骨折线仍存在,骨折处压痛及叩痛明显减轻。术后3个月复查X线片显示:骨折端大量骨痂形成,骨折线模糊,其中有3例骨折线消失,所有病例患处压痛及叩痛基本消失(典型病例见图2)。随访中未发现任何并发症,未发生骨折感染。
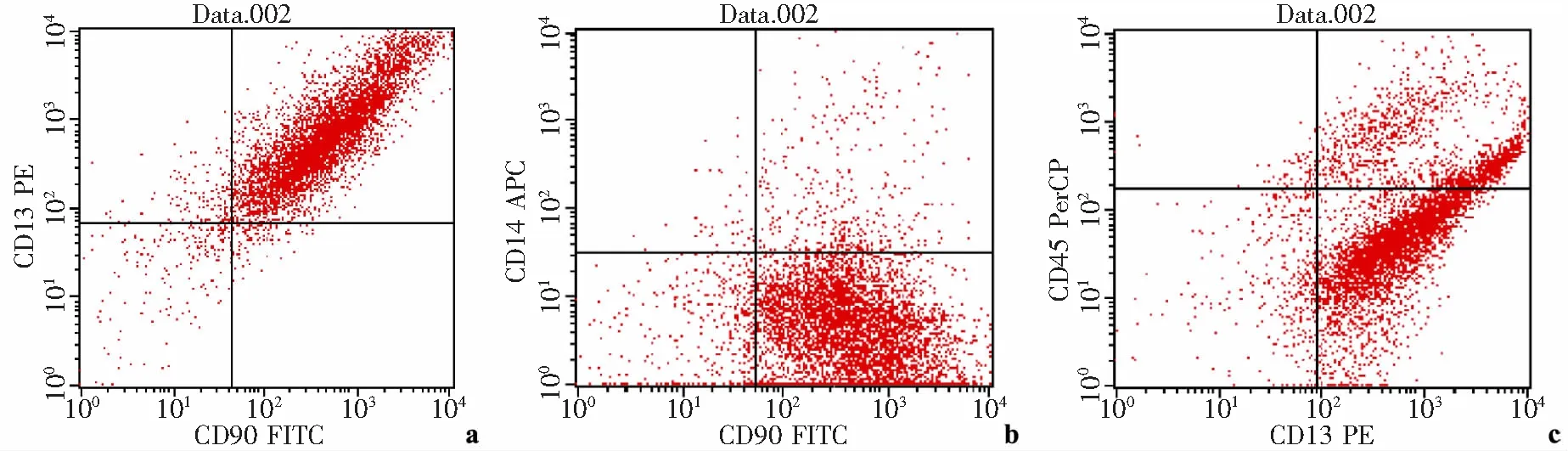
a:MSCs表面抗原标志物CD90+CD13+为92.31%;b:MSCs表面抗原标志物CD90+CD14-为85.63%;c:MSCs表面抗原标志物CD13+CD45-为68.01%
图1流式细胞仪检测MSCs表面抗原标志物的表达
3 讨论
自体骨髓干细胞移植治疗骨折骨不连是一种新的治疗骨不连的办法[3],已有很多相关报道。其主要是利用了骨髓中的骨髓间充质干细胞(MSCs),又可称为骨髓基质干细胞,存在于成年动物或人骨髓中的非造血组织的一种干细胞。其突出的特点是强大的增殖力、多向分化潜能、可塑性和迁移性,它是一种永生细胞,在体内具有很强的自我更新能力。MSCs是一群具有多向分化潜能的均质性细胞,可向多种非造血组织分化,在特定诱导条件下可分化为多种间充质细胞,如成骨细胞、软骨细胞、肌肉细胞、脂肪细胞、神经细胞和肝细胞等,并具有自我更新的能力[4]和分泌神经营养因子、生长因子、细胞因子和其他生物活性因子等[5],最近研究还发现他还有造血功能[6]。这是其应用于临床治疗骨折骨不连的理论基础。其来源丰富(患者自身的骨髓),取材方便(骨髓穿刺即可获得),易纯化扩增,培养方法简单,可自体移植而且移植方式比较简便,克服了免疫排斥问题[7],并且不涉及医学伦理学的相关问题。然而人体MSCs含量很稀少(尤其是老年人),直接分离后移植数量很难得到保证。也有研究认为[8],经皮自体骨髓移植是治疗胫骨干骨不连的一种有效、安全的方法,但是其疗效与移植骨髓中祖细胞的数量有关系,而且骨髓穿刺所采集到的祖细胞的数量似乎小于最理想的浓度,因此体外扩增就显得很重要。然而有相关研究结果提示[9]:目前体外培养的环境不利于MSCs的长期增殖,长期培养可能会减弱其合成胶原的能力,为了最大限度地保存MSCs的各种能力,培养时间应尽可能短。从本组体外培养扩增后移植治疗胫骨骨折骨不连的效果来看,体外培养扩增3周并未影响MSCs成骨能力。

a:术前X线片;b:骨折术后复查X线片;c:术后3个月复查X线片,骨折线清晰可见;d:自体MSCs移植术后2个月X线片,骨折线模糊,有骨痂形成;e:自体MSCs移植术后3个月X线片,骨折线模糊;f:自体MSCs移植术后拆除外固定支架X线片
图2典型病例影像资料(27岁男性,右侧胫腓骨开放性骨折)
由于自体骨髓干细胞移植治疗骨折骨不连存在一定的风险,整个过程较单纯的红骨髓移植治疗复杂[10]。主要是由于体外扩增这一步骤。其操作也相当严格,过程需要严格监控。与骨髓干细胞治疗脊髓损伤一样,必须解决的一个问题就是过程控制[11]:干细胞和其他所有相关准备材料必须有可以用于追踪及鉴定的技术支持和安全的材料来源;所用的实验试剂必须有质量控制及保证;干细胞必须保证避免逆转录病毒以及感染病原体的干扰;另外染色体核型分析技术要保证干细胞无其他的遗传变异。而解决这一问题需要高额费用很高要求的技术设备。通常情况下,体外扩增人类MSCs需要10%~20%的胎牛血清(FCS);尽管对FCS常规筛测以满足细胞培养的生物安全的需要,然而朊病毒的传播和未被鉴定的动物传染病等问题,近年来逐渐引起了重视及关注[12]。并且在细胞培养过程中蛋白质或多肽可能与MSCs结合,这可能引起宿主(患者)的免疫排斥反应,尤其是需要多次应用MSCs治疗的患者[13]。因此,在操作过程中,取用患者外周血并分离血清用于MSCs的培养扩增,这不仅安全,而且经济、有效。另外MSCs可能有恶变的可能,须向患者及家属讲明。从本组治疗的病例来看,未出现相关问题,是一种安全有效的治疗方法。
本组病例均采用外固定架固定,主要原因是:开放性损伤、局部皮肤软组织条件差。由于患肢局部瘢痕愈合,不利于二期切开行坚强的钢板内固定及充分植骨(患者及家属难以接受),此外该组病例均经过2次及2次以上的手术(清创植皮),有的骨膜剥离损伤较重,再次手术操作也势必加重骨膜的损伤。所有病例外固定架固定牢靠,且术前X线证实,骨折端均无明显假关节形成的骨折骨不连及不愈合。骨折断端的稳定固定是骨折愈合的重要因素,也是骨髓干细胞移植治疗的基础。因为骨折端不稳定必定带来应力干扰,从而妨碍了诱导成骨过程,导致成骨障碍,最终影响骨折的愈合。11例中有3例在外院行外固定治疗,有2例固定欠佳,应用此治疗方案前予以外固定调整使之稳定,其余病例固定相当牢靠。通常骨折经过6~8个月的治疗愈合失败即可称为骨折骨不连,骨折部位的不同,骨不连的发生率也不一样,大概在5%~23%之间[3]。对于开放性的胫骨骨折合并局部软组织损伤,其骨折骨不连的发生率也许会更高[2]。因此,对这类患者,经术后反复X线检查见骨折线清晰、未见明显骨痂生长,查体局部有压痛,应尽早予以治疗。本组患者中平均行该治疗时间为19周,最早的11周,最晚的27周,骨髓干细胞移植后局部很快就有骨痂形成。对于有条件的患者,可以重复、多次行该治疗。
经皮自体骨髓干细胞移植治疗骨不连有一定的优越性:自体骨髓来源广泛,采取方便,不受骨不连局部皮肤软组织条件限制,干细胞移植可采用局麻,创伤轻,患者痛苦小,操作简单安全。对于患者要求较高者,如拒绝自体髂骨植骨、担心取髂骨术后出现疼痛及影响美观,不失为一种办法。但是很多问题仍需要进行相关的研究,注射到骨折局部骨髓量的量化,骨髓干细胞的浓缩、分离、提纯与骨折愈合的量效关系及预防在移植部位的异位骨化等问题,具体的成骨机制问题,以及移植后与干细胞相关的如何在体内追踪、标记等问题。对骨缺损严重、存在血管病变的肢体、有慢性骨髓炎及局部感染迹象、有血液系统疾病及骨穿禁忌者一般不主张使用本治疗。此外,本组因病例数较少,未进行分组对照,其临床应用优势仍有待进一步研究。
[参考文献]
[1] 王瑞旻,王耀忠,赵 磊,等.局部肌瓣转移和自体红骨髓注射治疗胫骨骨折骨不连[J].中华创伤骨科杂志,2005,7(5):412-414.
[2] Kohlprath R,Assal M,Uckay I,et al.Open fractures of the tibia in the adult: surgical treatment and complications[J].Rev Med Suisse,2011,7(322):2482,2484-2488.
[3] Undale AH,Westendorf JJ,Yaszemski MJ,et al.Mesenchymal stem cells for bone repair and metabolic bone diseases[J].Mayo Clin Proc,2009,84(10):893-902.
[4] Bab I,Ashton BA,Gazit D,et al.Kinetics and differentiation of marrow stromal cells in diffusion chambers in vivo[J].J Cell Sci,1986,84:139-151.
[5] Kuan WL,Barker RA.New therapeutic approaches to Parkinson’s disease including neural transplants[J].Neurorehabil Neural Repair,2005,19(3):155-181.
[6] Sacchetti B,Funari A,Michienzi S,et al.Self-renewing osteoprogenitors in bone marrow sinusoids can organize a hematopoietic microenvironment[J].Cell,2007,131(2):324-336.
[7] Javazon EH,Beggs KJ,Flake AW.Mesenchymal stem cells:paradoxes of passaging[J].Exp Hematol,2004,32(5):414-425.
[8] Hernigou P,Mathieu G,Poignard A,et al.Percutaneous autologous bone-marrow grafting for nonunions.Surgical technique[J].J Bone Joint Surg Am,2006,88(Suppl 1 Pt 2):322-327.
[9] 陆 骅,汤亭亭,戴尅戎.体外培养对人骨髓间充质干细胞生物学行为的影响[J].临床骨科杂志,2005,8(3):264-267.
[10] 马江涛,俞 敏,张孟超,等.经皮自体骨髓移植治疗骨折不愈合的临床观察[J].中国骨伤,2009,22(11):862-864.
[11] 崔贵祥,李义召,岳寿伟.干细胞移植治疗脊髓损伤的进展[J].中国组织工程研究与临床康复,2008,12(47):9335-9338.
[12] Pelagiadis I,Dimitriou H,Kalmanti M.Biologic characteristics of mesenchymal stromal cells and their clinical applications in pediatric patients[J].J Pediatr Hematol Oncol,2008,30(4):301-309.
[13] Locatelli F,Maccario R,Frassoni F.Mesenchymal stromal cells,from indifferent spectators to principal actors.Are we going to witness a revolution in the scenario of allograft and immune-mediated disorders?[J].Haematologica,2007,92(7):872-877.

