基于大肠杆菌蛋白质质谱鉴定的阳离子交换色谱优化研究
朱平川,岑卫健,付强,胡炜,卢洁
(1.亚热带农业生物资源保护与利用国家重点实验室,广西大学,广西 南宁 530004;2.广西大学生命科学与技术学院,广西 南宁 530004)
基于大肠杆菌蛋白质质谱鉴定的阳离子交换色谱优化研究
朱平川1,岑卫健1,付强1,胡炜1,卢洁2
(1.亚热带农业生物资源保护与利用国家重点实验室,广西大学,广西 南宁 530004;2.广西大学生命科学与技术学院,广西 南宁 530004)
以大肠杆菌蛋白质的胰蛋白酶切产物为研究对象,对蛋白质的提取效率进行初步探讨,重点是对多维色谱分离中常用的强阳离子交换色谱的分离条件,包括缓冲液的种类、pH值,洗脱盐的种类、有机溶剂的比例以及上样量进行了考察和比较.结果表明:功率为400 W,超声时间为15 min,蛋白质的提取效率达到最高.在强阳离子交换色谱分离线性上样量范围内,10 mmol/L磷酸二氢钾(pH=3.0)作为缓冲体系,在氯化钾溶液作为洗脱盐、流动相中乙腈的体积分数为30%的条件下进行梯度洗脱时,可获得最佳的分离结果.
大肠杆菌蛋白质;蛋白提取;强阳离子交换色谱;多肽分离
高通量和高分辨率的蛋白质和肽段分离技术是蛋白质组学方法研究的重要内容.在“自下而上”的蛋白质组学中,细胞与组织溶解物通过蛋白质酶解产物的肽类是非常复杂的混合物,多维色谱分离技术已经在蛋白质组学研究中获得了广泛的应用[1-2],其中采用最广泛的技术路线是离线/在线强阳离子交换色谱(SCX)-反相色谱(RPLC)-电喷雾串联质谱(ESI-MS/MS)的方法[3-4].即采用强阳离子交换色谱和反相液相色谱两种分离原理正交的分离方法构成多维分离,在采用二维液相色谱结合生物质谱对复杂生物样品进行分离分析过程中,反相液相色谱的分离条件比较成熟和确定,但强阳离子交换色谱的分离条件依然有多种选择,目前有很多学者对此方面进行此方面的研究[5-8].
大肠杆菌做为一种模式菌,广泛用于生物学研究领域,本文以未改造过的大肠杆菌蛋白为研究对象,对该蛋白质的提取效率进行初步探讨,重点是对二维色谱分离中的第一维强阳离子交换色谱分离条件进行考察和优化,期望得到最合适的分离条件,为后续开展的大规模蛋白质鉴定提供前提条件.
1 实验部分
1.1仪器与试剂液相色谱仪(美国Waters公司),紫外分光光度计(美国PE公司),冷冻高速离心机(美国Beckman公司),台式高速冷冻离心机(德国Eppendorf公司),超纯水仪(美国Millipore公司),数控超声波清洗器(昆山市超声仪器有限公司),PolyLC SCX阳离子交换柱100 mm×2.1 mm,5 μm,摇床(上海苏坤有限公司),超声波细胞破粹机(美国Sonics公司).
CHAPS、PMSF、丙烯酰胺等购自Amresco公司,二硫苏糖醇(DTT)、碳酸氢铵、氯化钠、碘乙酰胺(IAA)、磷酸二氢钾、胰蛋白酶、酵母提取物、氢氧化钠均购自美国Sigma公司,乙腈、四乙基溴化铵(TEAB)、三(2-羧乙基)膦(TCEP),购自Thermo公司,所有使用水均使用Millipore过滤的超纯水.
1.2样品制备大肠杆菌全蛋白提取:吸取适量大肠杆菌(DH5α)于培养瓶在250 mL三角瓶中,装入100 mL LB培养基,37 ℃发酵培养24 h.加入蛋白质裂解液,间歇超声.在4 ℃,以12 000 r/min离心15 min,取上清液,加入3倍体积-20 ℃预冷的丙酮,涡旋振荡1 min,4 ℃沉淀过夜,以8 000 r/min离心15 min,取沉淀,使丙酮挥发完全,-80 ℃保存.
蛋白质酶解:将蛋白溶解于100 μL 100 mmol/L TEAB中,用超纯水调整总体积为200 μL,加入10 μL 200 mmol/LTCEP,55 ℃ 1 h孵育,另加入10 μL 375 mmol/L IAA,避光室温孵化30 min,加入6倍体积的预冷丙酮,过夜沉淀,离心去丙酮,挥发10 min.上述蛋白质加入200 μL 100 mmol/L TEAB复溶,按1∶20加入适当的胰酶储存液.37 ℃酶解过夜.
1.3色谱条件流动相A为10 mmol/L磷酸二氢钾中加入30%的乙腈(pH=3.0),流动相B为10 mmol/L磷酸二氢钾中加入100 mmol/L KCl(含30%的乙腈,且pH=3.0),洗脱梯度为:0~50 min,0~40%B;50~60 min,40%B~100%B;60~65 min,100%B~100%B;65~70 min,100%B~100%A;70~80 min,100%A.流速0.3 mL/min;检测波长214 nm.
2 结果与讨论
2.1超声波功率和次数对全蛋白提取的影响蛋白质因含有酪氨酸、色氨酸、苯丙氨酸等氨基酸在280 nm处有最大紫外吸收.在一定浓度范围内,蛋白质含量与对应的最大吸收波长下的吸光值成正比.随着菌体的破碎和体内蛋白质释放,引起溶液A280的变化.因此,通过测定A280的变化,可间接反映大肠杆菌细胞内蛋白释出情况[9].由图1得到,在开始的10 min,功率为500 W的超声效果最好,蛋白质释放率最高,但是随着时间的增加,蛋白质释放率在缓缓下降,可能是蛋白质发生了部分降解,而功率为400 W的超声效果在15 min之前在慢慢上升,在15 min时蛋白质释放率达到图1中的最高,综合图1分析,超声波对蛋白质提取最优化的条件是:功率为400 W,超声时间为15 min.
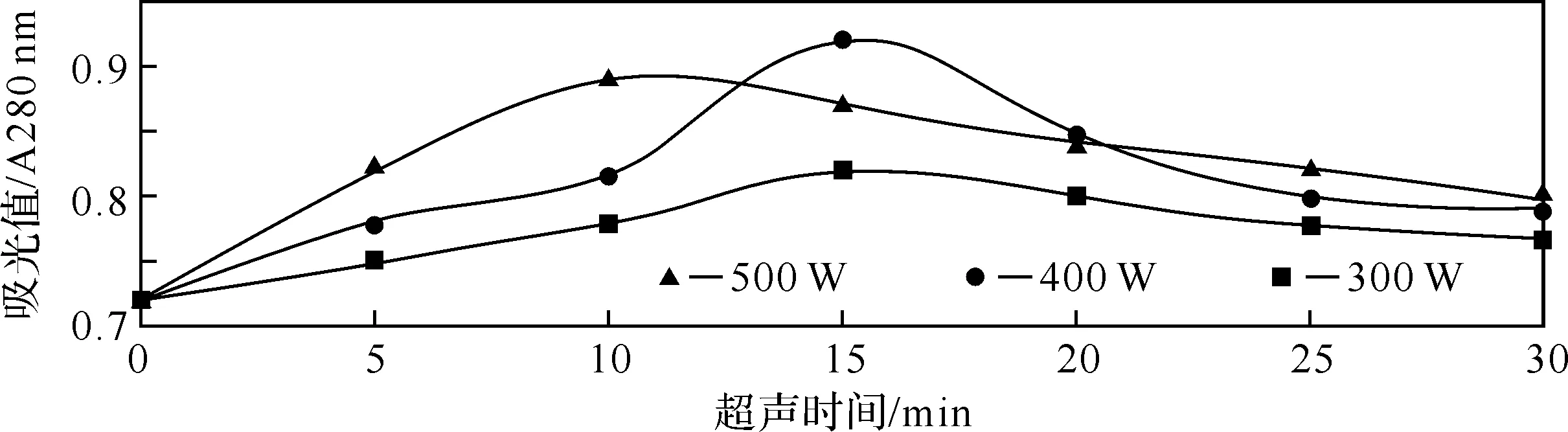
图1 不同功率破碎蛋白质释出情况
2.2缓冲液溶液的确定在对多肽的检测中,一般采用214 nm,多肽在更高波长的区域吸光度普遍较低,流动相范围在pH≤3.5,6.0≤pH≤8.5或者pH≥11.0,磷酸盐缓冲液都是不错的选择[10],所以本实验中选择10 mmol/L磷酸氢二钾作为缓冲溶液.
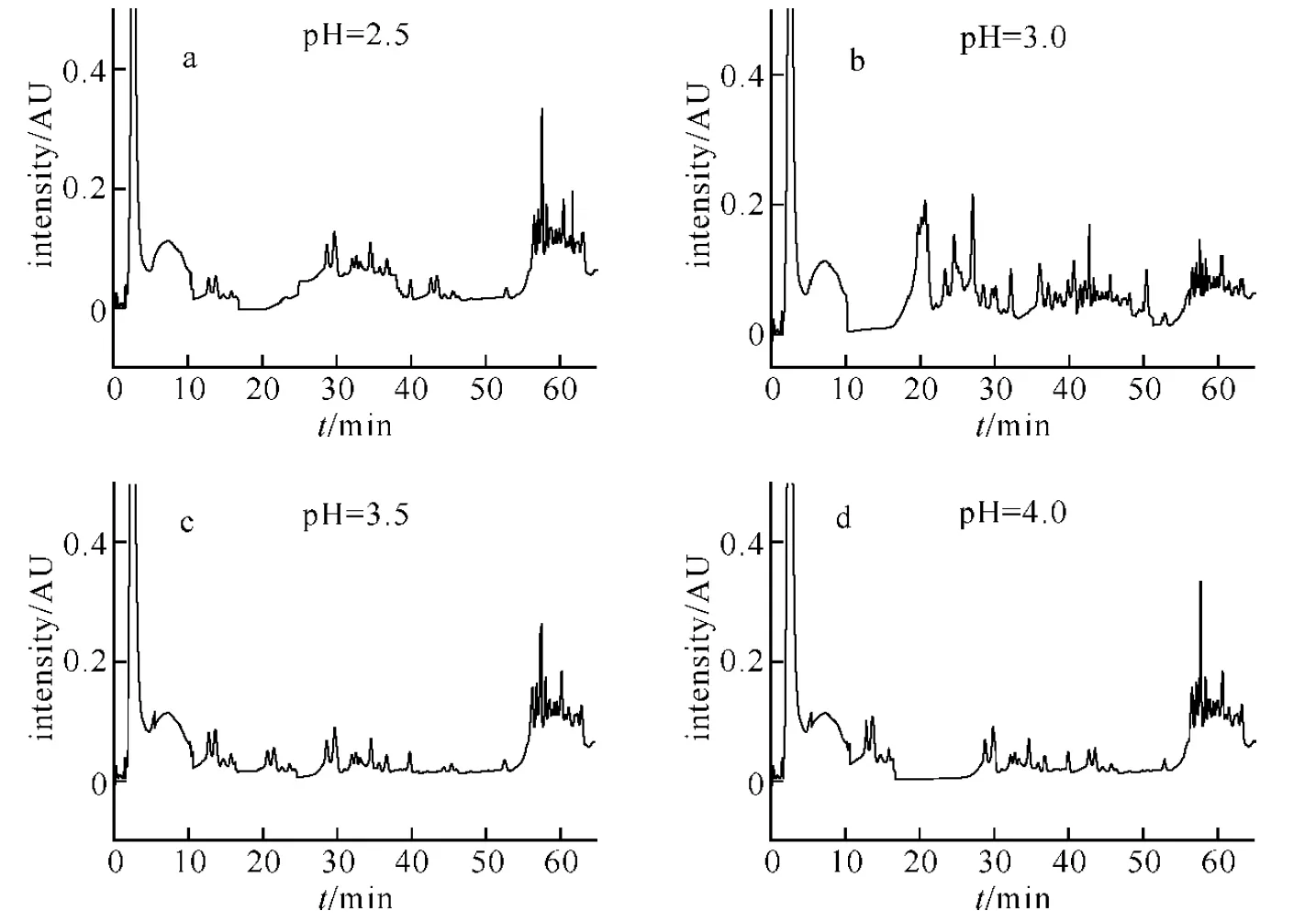
图2 流动相pH=2.5,3.0,3.5,4.0时样品的色谱分离图
2.3溶液pH值的影响在考察溶液pH值对分离度的影响时,配置缓冲液为流动相A为10 mmol/L KH2PO4,流动相B为10 mmol/L KH2PO4+0.1 mol/L KCl,两相均用磷酸调节pH值为2.5、3.0、3.5、4.0,相应在4种不同pH条件下对流动相A和B分别加入30%(V/V)的乙腈,考察这4种pH条件下对分离度的影响(见图2a~2d).
由于多肽具有不同的等电点,因此可以通过调节不同的pH值使多肽带有不同的电荷,从而与洗脱盐之间发生强弱离子交换而被洗脱下来.由结果可知,pH=3.5(图2c)和pH=4.0(图2d)时峰容量比较少,因为某些多肽的组成部分为天冬氨酸与谷氨酸等一些酸性氨基酸,它们的等电点值低于3.5,所以当pH3.5和pH4.0时,此类多肽带负电荷,无法结合在色谱柱,而pH2.5(图2a)时,过低的pH值使多肽带有很强的负电荷,牢固结合在色谱柱上,使得后面的盐洗脱困难加大,所以大部分分离的肽段并未分布在洗脱过程中的0~40% B这段,而是集中在40% B~100% B这段,并且分离度不好.综合以上分析,选择pH=3.0(图2b)作为溶液的pH值.
2.4洗脱盐种类的影响在考察盐的种类对分离度的影响时,配置缓冲液为流动相A、B均为10 mmol/L KH2PO4(pH 3.0)+30%(V/V)ACN,分别考察在流动相B中加入0.1 mol/L氯化钾、氯化铵、醋酸铵、氯化钠对分离度的影响.根据文献报导[11]盐的类型对蛋白及多肽保留行为的影响,可分为3种类型,强的顶替作用、弱的顶替作用和中间顶替作用.对于阳离子交换色谱,流动相中顶替离子的洗脱强度按以下顺序减小:Zn2+>Mg2+>Mn2+>Ag+>Cs+>K+>NH4+>Na+>H+>Li+.实验结果表明,在实验中4种洗脱盐中KCl的洗脱能力最强,峰容量最大(见图1),氯化铵与氯化钠次之,而醋酸铵中含有羰基,在210 nm处附近有紫外吸收,所以影响检测结果,而选择醋酸铵作为洗脱盐分离多肽混合物时常用于质谱分析中.
2.5有机溶剂含量的影响在考察流动相中乙腈的比例对分离度的影响时,配置缓冲液为流动相A为10 mmol/L KH2PO4(pH 3.0),流动相B为10 mmol/L KH2PO4+0.1 mol/L KCl(pH 3.0),考察不同比例(10%、20%、30%和40%(V/V))乙腈对分离度的影响.对于强阳离子交换色谱,肽段在色谱柱上的保留依赖于其与填料上离子基团的静电相互作用,但磺酰聚合物骨架又具有一定的疏水性,使得其与肽段会产生一定疏水相互作用而影响静电相互作用[12].在使用强阳离子交换色谱时,适当提高乙腈的比例以减少肽段与离子交换树脂骨架间的疏水相互作用.因此,我们在流动相的溶液中加入不同比例的乙腈,比较了乙腈比例不同的流动相的分离效果.结果显示:当流动相中乙腈比例为30%(V/V)时,分离效果最好(见图1).当乙腈比例为10%、20%和40%时的峰容量都偏低.原因可能是乙腈比例偏低时,一方面是大肠杆菌酶切样品在流动相A中不能完全溶解,因此未溶解部分的肽段便未能进入分析柱;另一方面乙腈比例较低时,肽段与骨架间的疏水相互作用不能得到有效抑制,从而会使部分肽段以疏水相互作用力保留在阳离子色谱柱上,导致分离效果变差.而当乙腈比例超过30%时,一方面高比例的乙腈可能会使色谱柱填料性质发生改变,从而影响分离效果;另一方面高比例的乙腈可能会使流动相中的盐析出,且不利于后续反相液相色谱的分离.所以在进行强阳离子交换色谱分离时,有机相的比例控制在30%左右为宜.
2.6上样量的影响任何一根色谱柱都有一个合适的进样线性范围.当样品进样量很大时,就会造成柱子超载的后果,峰宽增加、分离度降低,进样量太小会导致经色谱分离后收集的馏分含量太低,从而影响质谱的鉴定.对于多肽这类生物分子而言,成分复杂,出峰较多.在本文中,选择复杂程度较高的大肠杆菌蛋白的胰蛋白酶酶切物为研究对象来测定线性色谱的上样量范围.实验中选取肠杆菌蛋白的酶切物分离中的一个色谱峰进行观察,当上样量从40 μg增加到400 μg时,上样量X(μg)与峰高Y(mV)呈较好的线性关系Y=1.562 5X+65.500,R2=0.997 8.考虑到样品的消耗量,以及后续质谱等一系列实验,选择进样量为80 μg作为实验的最佳上样量.
3 结论
以大肠杆菌蛋白的胰蛋白酶酶切产物为研究对象,对蛋白质的提取效率进行初步探讨,重点是对多维色谱分离中常用的强阳离子交换色谱的分离条件(包括缓冲液的种类、pH值,洗脱盐的种类、有机溶剂的比例以及上样量)进行了考察和比较.实验结果表明,在功率为400 W,超声时间为15 min,蛋白质的提取效率达到最高.在强阳离子交换色谱分离线性上样量范围内,10 mmol/L磷酸二氢钾(pH=3.0)作为缓冲体系,在氯化钾溶液作为洗脱盐,且流动相中乙腈的体积分数为30%条件下进行梯度洗脱时,可获得最佳的分离结果.该结果并非在所有强阳离子交换色谱柱上都通用,但仍具有一定的借鉴作用,旨在为分离复杂多肽混合物时选择强阳离子交换色谱作为一维分离时提供参考.
[1] Washburn M P, Ulaszek R, Deciu C, et al. Analysis of quantitative rroteomic data generated via multidimensional protein identification technology[J]. Anal Chem,2002,74(7):1650.
[2] Wang Ying, Lu Jin, Tang Longhua, et al. Graphene oxide amplified electrogenerated chemiluminescence of quantum dots and its selective sensing for glutathione from thiol-containing compounds[J]. Anal Chem,2009,81(3):1049-1053.
[3] Washburn M P, Wolters D, Yates J R. Large-scale analysis of the yeast proteome by multidimensional protein identification technology[J]. Nat Biotechno,2001,19:242-245.
[4] Eng J K, McCormack A L, Yates J R. An approach to correlate tandem mass spectral data of peptides with amino acid sequences in a protein database[J]. Journal of the American Society for Mass Spectrometry,1994,5:976-978.
[5] Zanivan S, Gnad F, Wickstrm S A, et al. Solid tumor proteome and phosphoproteome analysis by high resolution mass spectrometry[J]. J Proteome Res,2008,7(12):5314-5316.
[6] Qian W J, Jacobs J M, Camp D G, et al. Comparative proteome analyses of human plasma followinginvivolipopolysaccharide administration using multidimensional separations coupled with tandem mass spectrometry[J]. Proteomics,2005,5(2):572-574.
[7] Nash R, Weng Sh, Hitz Ben, et al. Expanded protein information at SGD: new pages and proteome browser[J]. Nucleic Acids Research,2007,35(1):468-471.
[8] 王璐,周兰兰,钱小红,等.强阳离子交换色谱分离多肽混合物的条件优化[J].色谱,2010,28(4):368-373.
[9] 奥斯伯J F,布伦特R.精编分子生物学实验指南[M].4版.颜子颖,王海林,译.北京:科学出版社,1998:152.
[10] Snyder L R, Kirkland J J, Dolan J W.现代液相色谱技术导论[M].3版.陈小明,唐雅研,译.北京:人民卫生出版社,2011:154.
[11] 常璇,朱金霞,杨春霞,等.无孔单分散亲水性中强阳离子交换树脂的制备及其在蛋白质快速分离中的应用研究[J].分析试验室,2010,29(1):39-43.
[12] Motoyama A, Shiseido C, Yates J R. Multidimensional LC separations in shotgun proteomics[J]. Anal Chem,2008,80(19):7187-7193.
(责任编辑 胡小洋)
OptimizationofconditionsfortheseparationwithstrongcationexchangechromatographybasedonEscherichiacoliproteinformassspectrometryidentification
ZHU Pingchuan1,CEN Weijian1,FU Qiang1,HU Wei1,LU Jie2
(1. State Key Laboratory of Conservation and Utilization of Subtropical Agro-bioresources(Guangxi University), Nanning 530004, China; 2. School of Life Science and Technology, Guangxi University, Nanning 530004, China)
As a research of tryptic digestion products fromEscherichiacoliprotein, on the extraction efficiency of protein were studied in this paper, The focus is on the separation conditions of strong cation used multidimensional chromatography exchange chromatography. The conditions included the buffer species, pH, the type of the salt in mobile phase, the proportion of organic solvent added in the elution solution, and the loading amount of the sample. The results showed that, in the power of 400 W, ultrasonic time was 15 minutes, achieved the highest extraction efficiency of protein. In the strong cation exchange chromatography separation of linear sample volume range, 10 mmol/L potassium dihydrogen phosphate(pH=3.0) of mobile phases and 30% (V/V) organic solvent in mobile phases as buffer system, as washing desalination in potassium chloride solution, can obtain the best separation results.
Escherichiacoliprotein; protein extraction; strong cation exchange chromatography; peptide separation
2014-02-06
国家自然科学基金项目(31360459)和广西大学科研基金项目(XJZ120280)资助
朱平川(1982-)女,,实验师;卢洁,通信作者,副教授,E-mail:13978884051@163.com
1000-2375(2014)05-0435-04
Q814
A
10.3969/j.issn.1000-2375.2014.05.009

