光谱法研究卟啉-蒽醌化合物及其金属锌配合物与DNA的相互作用
赵胜芳,陈年友,张梁,严定策
(1.黄冈师范学院化工学院,湖北 黄冈 438000;2.武汉大学化学与分子科学学院,湖北 武汉 430072)
光谱法研究卟啉-蒽醌化合物及其金属锌配合物与DNA的相互作用
赵胜芳1,陈年友1,张梁2,严定策2
(1.黄冈师范学院化工学院,湖北 黄冈 438000;2.武汉大学化学与分子科学学院,湖北 武汉 430072)
用光谱法研究以二肽链连接的卟啉-蒽醌化合物及其金属锌配合物与DNA的相互作用.结果表明:卟啉-蒽醌化合物及其金属锌配合物与DNA发生外部结合.由紫外-可见光谱滴定数据进行拟合计算出卟啉-蒽醌化合物及其金属锌配合物与DNA相互作用的结合常数分别为2.2×105(mol/L)-1和6.7×105(mol/L)-1.
卟啉-蒽醌;金属卟啉;DNA;相互作用;光谱法
卟啉化合物具有大的平面共轭结构,其在400~500 nm处有强的吸收带,摩尔吸收系数一般在(2~5)×105L·(cm·mol)-1,当卟啉与其他化合物发生相互作用时,其电子吸收光谱会发生规律性变化,故可以通过紫外-可见光谱的变化检测卟啉与客体的结合情况.
脱氧核糖核酸是生命体内重要的生物大分子,是基因表达的物质基础,与生命的延续、生物的生长发育、细胞分化等正常的生命活动密切相关,核酸异常可能导致肿瘤、遗传病、代谢病等,因此,核酸也作为作为抗癌、抗病毒等药物作用的靶点.
卟啉化合物由于其独特的生物特性和光学性能,被作为光敏剂,用于癌症、心血管等疾病的光动力疗法[1-4].蒽醌类化合物能够插入DNA螺旋分子中相邻单元,阻碍DNA在DNA及RNA复制中的模板作用,对DNA产生有效的光切割[5].因此,将蒽醌引入卟啉中形成卟啉-蒽醌体系,通过卟啉产生单线态氧及蒽醌对DNA分子的光切割作用,对病变细胞产生双重杀伤,可能作为一种新型靶向光敏药物.
本文中用光谱法研究以二肽链连接的卟啉-蒽醌化合物及其金属锌配合物与DNA的相互作用,结果表明:卟啉-蒽醌化合物及其金属锌配合物与DNA发生自堆积的外部键合.
1 实验部分
1.1实验仪器紫外可见光分光光度计(Lambda 10UV/vis spectrometer,美国Perkin-Elmer公司),RF-5301型荧光光谱仪(日本,津岛公司),CHI660C电化学工作站(上海晨华).
1.2实验试剂DMF、DMSO和CHCl3为分析纯,精制后使用;鲑鱼精DNA(生化试剂,);其余试剂均为化学纯或分析纯.石英亚沸二次蒸馏水.卟啉-蒽醌化合物(A)及其金属锌配合物(B)按文献[6]方法制备,高氯酸四丁基铵(TBAP)按文献[7]制备.
1.3A、B与DNA作用的光谱法研究
1.3.1 溶液的配制 缓冲溶液的配制:配制含有5 mmol/L Tris和50 mmol/L NaCl的溶液,用盐酸调节溶液酸度使pH=7.2.化合物与DNA相互作用的紫外-可见吸收光谱、荧光光谱均在此缓冲溶液中进行.
DNA溶液的配制:称取适量的鲑鱼精DNA溶解于Tris缓冲溶液中,抽滤,滤液按需要稀释到一定浓度.测定DNA溶液在260 nm和280 nm处的吸光度,A260/A280=1.8~1.9,说明溶液中基本不含蛋白质,不需要进一步处理.鲑鱼精DNA的浓度以碱基对的浓度计,测定DNA在260 nm处的吸光度,根据DNA在260 nm处的摩尔吸光系数值6 600(mol/L)-1cm-1来确定DNA的浓度.配制的DNA溶液浓度4.29×10-5mol·L-1,放置在冰箱中,4 ℃下保存备用.
主体卟啉-蒽醌化合物A及其金属锌配合物B溶液的配制:卟啉化合物用少量DMSO溶解,Tris缓冲溶液稀释(DMSO的浓度应小于5%),配成浓度为3×10-5mol·L-1溶液备用.
1.3.2 紫外-可见吸收光谱滴定 在参比池中加入2.5 mL Tris-HCl缓冲溶液,样品池中加入同样体积的3×10-5mol·L-1的A或B溶液.用微量注射器每次向参比池和样品池中加入1 μL的DNA储备液,使DNA与A或B的浓度比值不断增加,直至饱和.每次混合均匀约5 min后,在200~800 nm范围内检测A和B的紫外-可见吸收光谱的变化.
1.3.3 稳态荧光光谱滴定 荧光光谱滴定参照紫外-可见吸收光谱滴定操作方法,以420 nm为激发波长,狭缝宽度5/5 nm,观察荧光发射光谱的变化.
2 结果与讨论
2.1A、B与DNA作用的紫外-可见吸收光谱紫外-可见吸收光谱是研究小分子化合物与DNA相互作用的最常用方法之一.通常,化合物与DNA结合后会导致化合物所处的环境发生改变,结合强弱可通过光谱扰动的变化反映出来.DNA加入到卟啉溶液后Soret带都会出现一定程度的减色和红移,减色大于30%,红移超过10 nm是插入模式的明显标志.当卟啉对DNA表现为沟外结合模式时,其紫外-可见光谱基本不变或者变化较小[8].
DNA加入后卟啉-蒽醌化合物A和卟啉-蒽醌金属锌配合物B的紫外-可见吸收光谱变化见图1.从图谱可见,随着DNA浓度的增加,A和B的Soret带都发生一定减色和较小红移,同时卟啉-蒽醌的Q1带发生轻微增色效应,并且A和B分别在478 nm处和482 nm处有等吸收点产生.图谱变化说明DNA与卟啉-蒽醌发生了相互作用,其光谱变化程度显示A、B与DNA发生的是表面吸附作用.
A、B与DNA相互作用的强弱可以通过结合常数Kb的大小加以说明,根据下面的公式[9]求出化合物与DNA的Kb:
[DNA]/(εa-εf)=[DNA]/(εb-εf)+1/[Kb(εb-εf)].
式中[DNA]表示DNA的浓度,εa,εf,εb分别代表,Aobsd/[Hybrid]、主体卟啉-蒽醌化合物未结合DNA的摩尔吸光系数和与DNA完全结合后的摩尔吸光系数.以[DNA]/(εa-εf)对[DNA]作图,可要求出结合常数Kb.由此计算得到A和B与DNA的结合常数分别是2.2×105(mol/L)-1,6.7×105(mol/L)-1,拟合结果见表1.可以看到B与DNA的结合常数大于A与DNA的,这可能是由于化合物B中金属离子Zn带一定量的正电荷,与DNA分子中带负电荷的磷酸酯基存在着较大的静电吸引所致.
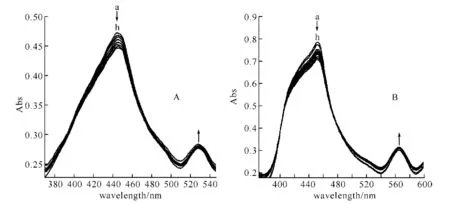
图1 A、B与DNA作用的紫外-可见光谱图
A、B溶液(a)的原始浓度均为3×10-5mol/L,b→h:每次向a中加入1 μL 4.29×10-5mol/L DNA溶液
2.2A、B与DNA作用的荧光光谱卟啉及其大部分金属配合物都有较好的荧光发射光谱,卟啉-蒽醌化合物与DNA结合后,荧光光谱将发生变化,光谱变化幅度的大小反映了化合物与DNA作用的强弱及与DNA作用的方式.当卟啉-蒽醌化合物与DNA作用后,其荧光光谱也会出现增色或减色效应,当卟啉-蒽醌化合物与DNA以插入模式结合时,荧光光谱会出现明显的变化;当它以沟外连接或外部堆积模式与DNA结合时,其荧光光谱变化很小甚至不发生变化[8].
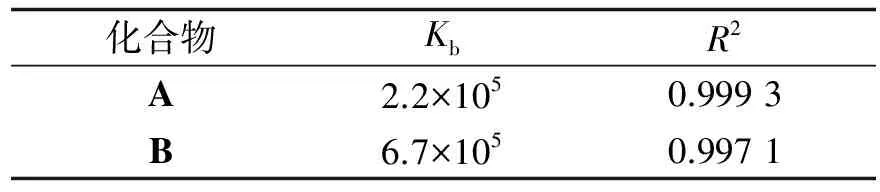
表1 卟啉化合物A、B与DNA作用的线性拟合数据
卟啉-蒽醌化合物A及其金属锌配合物B与DNA相互作用的荧光光谱滴定曲线见图2.从图中可以看出,在Tris缓冲溶液中,A和B的最大荧光发射峰约在500 nm左右,随着DNA的加入,卟啉化合物A和B的荧光强度逐渐减小.根据文献,如果化合物插入到DNA碱基对中,由于化合物分子受到DNA分子的屏蔽,减少了与溶剂分子的碰撞,从而使荧光增强;相反,如果化合物不能插入DNA,分子之间的作用就会降低化合物的荧光强度.后一种情况,表明分子与DNA可能是以外部结合模式作用[10].由于荧光发射光谱是卟啉环产生的,由此可推知,A和B的卟啉环与DNA均是以表面吸附发生作用的.
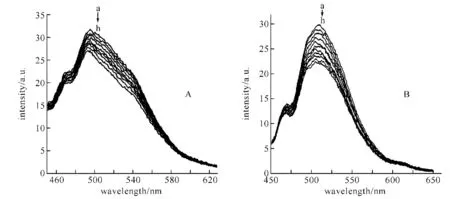
图2 A、B与DNA作用的荧光光谱图
A、B溶液(a)的原始浓度均为3×10-5mol/L,b→h:每次向a中加入1 μL 4.29×10-5mol/L DNA溶液
3 结论
以二肽链连接的卟啉-蒽醌化合物及其金属锌配合物与DNA的紫外-可见光谱滴定以及稳态荧光光谱滴定证明:卟啉-蒽醌化合物及其金属锌配合物与DNA有较强的相互作用.其作用模式为外部结合.根据光谱方法计算出化合物A、B与DNA的结合常数分别是2.2×105,6.7×105(mol/L)-1.其作用的详细机理还需要进一步确证.
[1] 陈年友,陈水明,赵胜芳,等.二肽链键联的卟啉-蒽醌化合物及其金属配合物的合成及其对DNA断裂的性质研究[J].有机化学,2010,30(11):1677-1681.
[2] 王荣民,裴菲,何玉凤,等.低聚壳聚糖负载金属卟啉配合物的制备及生物活性研究[J].化学研究与应用,2012,24(2):278-281.
[3] Bin Su, Imren Hatay, Anton n Troj nek, et al. Molecular electrocatalysis foroxygen reduction by cobalt porphyrins adsorbed at liquid/liquid interfaces[J]. J Am Chem Soc,2010,132(8):2655-2662.
[4] 李东红,刘建仓,刁俊林.卟啉介导抗癌药物的合成及其活性研究[J].中国药物化学杂志,2008,18(3):180-185.
[5] 王志群,陈石,吕燕妮,等.米托蒽醌与B-DNA相互作用的分子模拟[J].化学学报,2010,68(6):551-556.
[6] 陈年友,赵胜芳,董甲庆,等.系列二肽键键连的卟啉-蒽醌及金属配合物的微波合成及电子转移性质[J].高等学校化学学报,2011,32(7):1466-1471.
[7] AIHARA M, MISUMI S. Polarographic studies of some lanthanoids in N,N-dimethylacetamide[J]. Bulletin of the Chemical Society of Japan,1973,46:175-178.
[8] 王凯,林笑,万幸,等.钌-菲罗啉卟啉的合成及与DNA的相互作用[J].高等学校化学学报,2012,33(12):2663-2669.
[9] Kelly J M, Murphy M J, McConnell D J. A comparative study of the intercton of 5,10,15,20-tetrakis (N-methylpyridlnium-4-yl) porphyrin and its zinc complex with DNA using fluorescence spectescopy and topoisomerisation[J]. Nucleic Acids Res,1985,13(1):167-184.
[10] Masaaki T, Ashish K S, Elvis N. Enhanced conformational changes in DNA in the presence of mercury(Ⅱ), cadmium(Ⅱ) and lead(Ⅱ) porphyrins[J]. J Inorg Biochem,2003,94(1/2):50-58.
(责任编辑 胡小洋)
Interactionofporphyrin-anthraquinoneanditszinccomplexwithDNAinvestigatedbyspectroscopymethod
ZHAO Shengfang1,CHEN Nianyou1,ZHANG Liang2,YAN Dingce2
(1.School of Chemical Engineering, Huanggang Normal University, Huanggang 438000, China;2. School of Chemistry and Molecular Sciences, Wuhan University, Wuhan 430072, China)
The interaction of porphyrin-anthraquinone hybrid with dipeptide link and its metal complex with DNA was investigated by means of UV-Vis absorption and fluorescence spectroscopy. The result suggest that the mode of the interaction of porphyrin-anthraquinone and its zinc complex may be outside groove-face binding with DNA. The binding constants of porphyrin-anthraquinone and its zinc complex with DNA determined by UV-Vis spectra titration were 2.2×105(mol/L)-1and 6.7×105(mol/L)-1, respectively.
porphyrin-anthraquinone; metal porphyrin; DNA; interaction; spectra titration
2013-11-25
湖北省自然科学基金(2007ABA064)资助
赵胜芳(1956-),女,教授,E-mail:zhshfang@hgnu.edu.cn;陈年友,通信作者,教授,E-mail:chennyou@hgpu.edu.cn
1000-2375(2014)05-0443-04
Q523
A
10.3969/j.issn.1000-2375.2014.05.011

