18F-FDG PET-CT在多浆膜腔积液探查肿瘤原发灶中的价值
周 颖,徐文贵,宋秀宇,戴 东,刘建井
(天津医科大学肿瘤医院,国家肿瘤临床医学研究中心;天津市“肿瘤防治”重点实验室,天津300060)
多浆膜腔积液是一种常见的临床症状,多见于胸腔、腹腔及心包积液,是指患者在病程中同时或相继出现2种或2种以上部位的积液。导致多浆膜腔积液的病因十分复杂,及时明确病因对于疾病的治疗及预后有着重要意义,尤其是对于怀疑恶性肿瘤所致多浆膜腔积液的患者。18F-脱氧葡萄糖正电子发射体层摄影术(18F-FDG PET-CT)显像将代谢和结构影像同机融合,在多种疾病的诊断和鉴别诊断方面具有明显优势。本文收集本科室84例以不明原因多浆膜腔积液为首发症状的可疑恶性肿瘤患者的PET-CT影像及临床资料,探讨PET-CT在其明确病因并查找原发肿瘤灶中的临床应用价值。
1 资料与方法
1.1 一般资料
回顾性分析2006年6月至2013年6月期间天津市肿瘤医院分子影像与核素诊疗科接诊的以可疑恶性肿瘤所致多浆膜腔积液的患者84例,其中男31例,女53例;年龄3-92岁,平均63±15岁。所有患者既往均无恶性肿瘤病史。对所有患者行病理检查(抽取积液或原发灶穿刺、活检或手术)或临床诊断性治疗后随访观察,可疑疾病得到控制或好转,积液经治疗后吸收且短期内无反复则符合相关诊断,随访时间1-12个月。
1.2 方法
1.2.1 仪器和显像剂 GE公司Discovery ST 4 PET-CT仪,显像剂18F-FDG(2-18F-2-脱氧-D-葡萄糖)由GE mini trace回旋加速器生产,由TRACERlab FXFDG合成器合成,pH值5-7,放化纯度>95%。
1.2.2 显像方法 禁食6 h以上,空腹血糖浓度4-7 mmol/L。显像前1.5-2 h口服1.2%泛影葡胺800-1000 ml。按0.12 mCi/kg注射18F-FDG。注射后静卧40-60 min,再次口服1.2%泛影葡胺500-800 ml,排空小便后立即行PET-CT显像。患者取仰卧位,双手抱头,平静呼吸。扫描从头顶至股骨上端。先行CT扫描:电压120 kV,电流100 mA,螺距0.75∶1,层厚5 mm。PET行3D采集,每床位采集时间2 min,共6-8个床位。采用迭代法重建,采集结束后数据传至Xeleris工作站,行PET-CT图像融合及轴位、冠状位、矢状位图像处理。对病灶显示欠佳的部位,均行诊断剂量CT扫描,电压140kV,电流250-300 mA。
1.2.3 图像分析 PET-CT图像采用定性分析及半定量分析方法测量进行分析,选取病灶摄取18F-FDG最显著的层面勾画感兴趣区(Region of Interest,ROI),测量最大标准摄取值(maximum of standard up take value,SUVmax)。以SUVmax≥2.5作为判断代谢增高的标准。由两名有经验的核医学科医生共同阅片进行定性及定位诊断。

2 结果
2.1 一般情况
患者总数84例,其中男性31例,女性53例;年龄3-92岁,平均63±15岁,男性平均年龄65±17岁,女性平均年龄62±14岁,二者差异无统计学意义(P>0.05)。最终临床诊断与性别的关系如表 1,二者差异具有统计学意义(P=0.023),即在多浆膜腔积液的病因构成方面男女是不同的,女性恶性比例高于男性。

表1 临床诊断与性别的关系
2.2 病因分析情况
根据临床诊断结果84例患者中81例病因明确,另有3例病因未明,其中确诊恶性肿瘤62例,分别为肺癌16例、消化系统肿瘤12例(结肠癌6例,胃癌3例,肝癌1例,胰腺癌2例)、卵巢癌9例、腹膜癌8例、淋巴瘤5例、恶性间皮瘤2例、甲状腺癌1例、后纵隔间质肉瘤1例、腹腔横纹肌肉瘤1例、子宫内膜癌1例、腹腔脂肪肉瘤1例,胸腺癌1例,恶性肿瘤已广泛转移4例,肿瘤原发灶不明。经临床诊断排除恶性肿瘤者19例,分别为肺炎7例,肝硬化3例,结核3例,心源性2例,胸膜炎1例,心包炎症1例,骨纤维异常增殖症1例,巨幼细胞性贫血1例。PET-CT诊断与临床诊断的定性诊断对应关系如表 2,81例病因明确的患者中有70例经PET-CT检查定性诊断正确,其中62例恶性肿瘤患者中PET-CT明确原发灶49例,检出率为79.0%。19例排除恶性肿瘤诊断中PET-CT误诊为恶性3例:胸膜结核1例,腹膜结核1例及胸膜炎1例,均表现为胸、腹膜增厚,局部代谢增高。PET-CT漏诊肺癌1例,PET-CT诊断为肺部炎症,后经支气管镜取病理证实为肺鳞状细胞癌。

表2 临床诊断与PET-CT诊断的关系
2.3 积液分布情况
本组84例多浆膜腔积液患者中胸水+腹水共42例,占50%;胸水+心包积液共30例,占36%;腹水+心包积液共6例,占7%;胸水+腹水+心包积液共6例,占7%。其中恶性肿瘤患者可见胸膜转移9例,腹膜转移19例,心包转移3例,表现为胸膜、腹膜、心包增厚或呈结节状,PET提示局部代谢增高。积液分布与病因关系见表3。胸水合并腹水以卵巢癌、腹膜癌及肺癌多见,胸水合并心包积液以肺癌多见,肺部炎症也会引起此类积液。

表3 多浆膜腔积液分布与病因关系(例数)
P=0.149。腹水=A,胸水=B,心包积液=C。
2.4 SUVmax值与良恶性病因的关系
所有患者均行18F-FDG PET-CT检查,采用定性分析及半定量分析方法在明确疾病性质的基础上确定肿瘤原发部位,并测量其SUVmax值:0-29.8,平均6.7±5.9;男性:6.2±6.1。女性:7.0±5.7,二者差异无统计学意义(t=-0.642,P>0.05)。良性19例,平均2.6±4.4,恶性62例,平均8.3±5.5,二者差异有显著统计学意义(P<0.001)。以临床诊断结果为标准,通过绘制ROC曲线(如图 1)可知,SUVmax取3.6为截断值,位于ROC曲线左上角拐点处,此时SUVmax用于诊断可疑恶性肿瘤所致多浆膜腔积液患者原发灶的良恶性的准确度最高,敏感性为90.3%,特异性为81.8%。SUVmax取3.6时约登指数最大(0.72),阳性预测值93.1%,阴性预测值65.2%,AUC为0.849,表明该方法具有一定的诊断价值,用于区分多浆膜腔积液患者性质可以得出最佳判断结果。
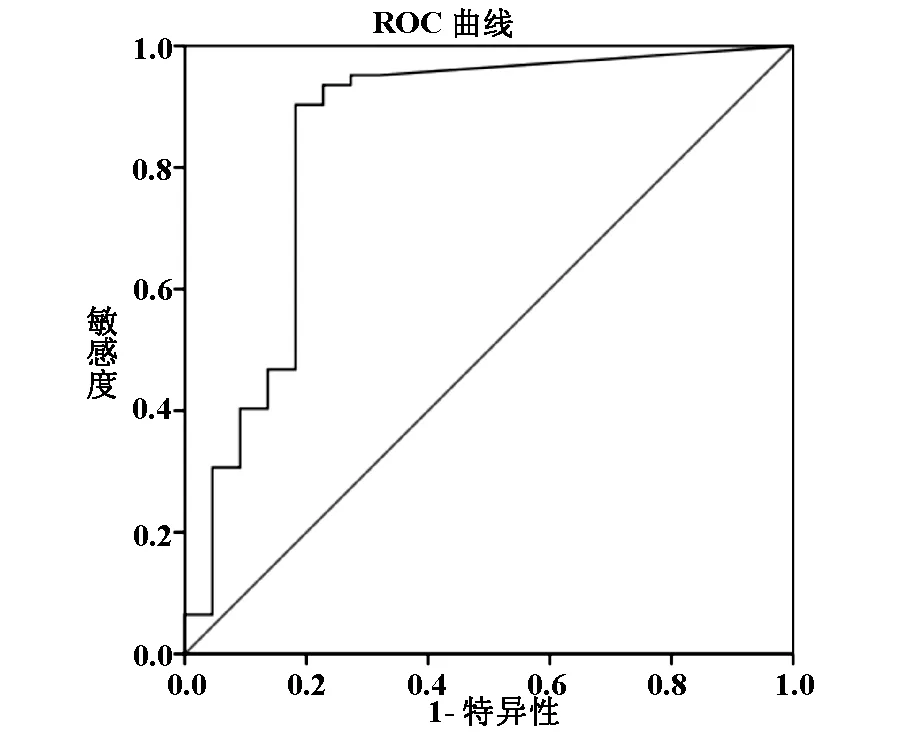
图1 PET-CT诊断中SUVmax值的ROC曲线
3 讨论
在正常情况下,浆膜腔内有少量液体起润滑作用,若液体贮留量增多,形成积液,即为病理性浆膜腔积液。浆膜腔积液的病理生理机制通常为:(1)毛细血管静脉压增高;(2)微血管管壁通透性增高;(3)血浆胶体渗透压降低;(4)淋巴管回流受阻。积液病理学检查是明确病因的重要手段,但穿刺抽液有时也难以明确病因,据文献报道多次抽液行脱落细胞学检查敏感性仅为40%-60%[1],反复穿刺还会给患者带来痛苦,部分患者难以耐受。常规影像学检查对于部分病情复杂的患者常常难以明确病因。针对性质不明的多浆膜腔积液,18F-FDG PET-CT全身显像具有重要价值[2-5]。引起多浆膜腔积液的病因复杂,有文献报道,恶性肿瘤是引起多浆膜腔积液的主要病因,约占31.3%[6],其次为结缔组织疾病、结核、肝硬化、心功能不全、甲状腺功能减退、肾病综合征等。本组84例多浆膜腔积液患者均为临床怀疑恶性肿瘤所致,后经病理及临床诊断性治疗随访证实为恶性肿瘤者62例,通过18F-FDG PET-CT全身显像检查明确原发病灶49例,检出率为79.0%。本研究恶性患者比例较上述报道明显增高,可能原因为所在医院为肿瘤专科医院,多数患者来诊前均已经初步排查诊断,相对良性患者就诊率低。PET-CT检出恶性肿瘤原发灶的同时发现淋巴结转移31例,胸膜转移9例,腹膜转移19例,心包转移3例,骨及远处脏器转移25例,为恶性肿瘤的准确分期提供了依据,为临床治疗方案的制定提供了帮助。
性别与病因关系:84例患者中女性53例,男性31例,其中女性中恶性42例(79.2%),男性中恶性20例(64.5%),二者之间比例为1.2∶1,差异有统计学意义(P<0.05),提示我们以多浆膜腔积液为临床首发症状的女性患者恶性几率更高,其原因可能为女性恶性肿瘤中卵巢癌所占比例较大[7],本组为(9/53)例,且卵巢癌易引起多浆膜腔积液,尤其是胸水合并腹水[8],提示我们在临床工作中遇到胸水伴腹水的女性患者应注意排查盆腔肿瘤。男性肿瘤患者中以肺癌多见,占(8/20)40%,这与男性中吸烟率高有一定关系。
积液部位与病因关系:PET-CT在肿瘤的诊断方面具有很大优势,它能通过全身显像在结构及功能代谢双层面上对大部分肿瘤进行诊断,在查找原发肿瘤灶方面有十分重要的意义[9],对于多数胸腔积液或腹腔积液患者的性质判定也较为明确[10,11]。PET-CT在可疑恶性肿瘤所致的多浆膜腔积液中的价值在于在判定疾病性质的基础上进一步明确肿瘤原发灶。该组病例中以恶性肿瘤为主,恶性肿瘤中又以肺癌、腹膜癌、卵巢癌为主,肺癌积液类型多见于胸腔积液合并心包积液,腹膜癌及卵巢癌则以腹腔积液合并胸腔积液为主,提示此类积液恶性比例高,且原发部位常见于上述部位,在行PET-CT检查时要尤其注意。本组病例中,有19例最终排除恶性肿瘤,多浆膜腔积液常见非恶性病因主要为炎症、结核、肝硬化、心源性疾病等,胸水伴心包积液及胸水伴腹水中相对比较常见,炎症及结核等往往也会造成局部代谢增高,从而造成PET-CT的误诊。所以,PET-CT对多浆膜腔积液的病因诊断同样存在复杂性,在诊断不明的情况下仍需借助其他方法。本组病例中有1例女性患者,59岁,因憋喘1周就诊,行胸部X线片提示左侧胸腔大量积液,穿刺引流胸水2 500 ml,黄色掺杂血性,未见肿瘤细胞,复查胸部CT:左肺上叶占位。为明确诊断来我科行PET-CT检查,左侧胸膜不规则增厚并可见异常放射性浓聚,可疑左胸膜恶性间皮瘤,后经胸腔镜下胸膜活检确诊为结核,该患者无明显结核中毒症状,起病较急,肺部显像未见结核浸润影,2次查痰细菌报告未见抗酸杆菌,易造成误诊。
SUVmax值作为PET-CT诊断中十分重要的半定量分析指标,会受到很多因素的影响,例如受检者体重、血糖水平、显像时间、注射剂量等。目前国内外多普遍采用2.5作为区分良、恶性病变的SUVmax界值[12],但部分炎症、结核也会造成局部SUVmax值增高,从而造成假阳性[13,14],给患者带来不必要的经济及心理负担。本研究通过绘制ROC曲线得出SUV截断值为3.6,此时其灵敏性及特异性均较高,曲线下面积最大,提高了PET-CT诊断的准确性,选择一个合适的截断值对于提高PET-CT的诊断准确性来说是十分重要的。
综上所述,18F-FDG PET-CT全身显像在诊断多浆膜腔积液的病因中有重要价值,尤其是由于恶性肿瘤所致的患者,其检出率高,不但能明确肿瘤原发部位,而且能准确分期,指导临床治疗,尤其对胸腹腔积液的患者。很多良性疾病也可导致多浆膜腔积液,PET-CT对于肿瘤性疾病的诊断较为准确,应根据患者年龄、性别、积液部位等逐个系统排查可能的恶性肿瘤,行PET-CT检查时假阴性发生率较低,但还应结合其他检查排除葡萄糖代谢不高的特殊类型肿瘤,避免造成漏诊,延误患者的治疗。
参考文献:
[1]Mohanty SK,Dey P.Serous effusions: diagnosis of malignancy beyond cytomorphology[J].Postgrad Med J,2003,79(936):569.
[2]郭 佳等,陈跃,黄占文,等.(18)F-FDG PET-CT在不明原因多浆膜腔积液中的应用价值[J].重庆医学,2011,(08):767.
[3]Singnurkar A,Solomon SB,Gonen M,et al.18F-FDG PET-CT for the prediction and detection of local recurrence after radiofrequency ablation of malignant lung lesions[J].Nucl Med,2010,51(12):1833.
[4]Li XJ.,Li FQ,Han JK,et al.Ascites metabolism measurement enhanced the diagnostic value and accuracy of prognostic evaluation in18F-FDG PET-CT studies in malignant ascites patients[J].Nucl Med Commun,2013,34(6):544.
[5]Liao R,Yang X,Wang S,et al.Clinical role of18F-FDG PET-CT in differentiating malignant and benign pleural effusion in patients with lung cancer[J].Zhongguo Fei Ai Za Zhi,2012,15(11):652.
[6]张 弘,蔡柏蔷.多浆膜腔积液241例临床分析[J].临床内科杂志,2003,(12):644.
[7]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69.
[8]赖燕芬,魏长春,彭黎明,等.1例以多浆膜腔积液为首发的卵巢癌并文献复习[J].临床肺科杂志,2013,(08):1547.
[9]葛 冉,赵丽霞,田 蓉,等.(18)F-FDG PET-CT在寻找转移瘤原发灶中的临床价值[J].中国临床医学影像杂志,2012,(10):722.
[10]Zhang M,Jiang X,Zhang M,et al.The Role of18F-FDG PET/CT in the evaluation of ascites of undetermined origin[J].Nucl Med,2009,(50):506.
[11]王 颖,李亚明,尹雅芙,等.(18)F-FDG PET-CT对检出恶性腹腔积液患者原发癌灶的临床价值[J].中国医学影像技术,2012,(12):2193.
[12]任东栋,孙 达.(18)F-FDG PET显像中标准化摄取值的临床应用价值[J].实用肿瘤杂志,2008,(03):276.
[13]陈文新,林美福,田嘉禾,等.(18)F-FDG与~(18)F-FLT PET-CT在肺结核瘤与恶性肿瘤鉴别诊断中的应用[J].中国临床医学影像杂志,2012(12):837.
[14]李 军,郑 智,潘铁成,等.肺部肉芽肿性炎症的PET-CT特点[J].中国现代医学杂志,2007,(13):1649.

