光谱和分子模拟法研究洛伐他汀与牛血清蛋白相互作用
,, ,,2
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江工业大学 绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310014)
众所周知,血清蛋白是一种最丰富的载体蛋白,对许多药物和代谢物具有较强的亲和力.通常,血清蛋白与药物间相互作用越强,血液中游离药物浓度越低;而弱相互作用导致药物在体内分布较差.因而,血清蛋白在药物的传输、分布和代谢过程中起着重要作用[1].研究药物与血清蛋白相互作用对理解药物作用机制和代谢过程、改造药物结构和开发新药是十分有用的[2-3],已成为生命科学、化学和医学领域研究热点之一.牛血清蛋白(BSA)是由583个氨基酸残基构成三个结构域,每个结构域都由两个亚结构域(A和B)构成.它与人血清蛋白(HSA)有着极为相似的结构序,因此BSA已广泛用于小分子化合物与血清蛋白相互作用的研究[4-9].
洛伐他汀(Lovastain)是一种3-羟基-3-甲戊二酰辅酶A还原酶抑制剂[10-11],主要用于血脂异常的治疗和心血管疾病的预防,也具有诱导卵巢癌细胞凋亡[12]和降低乳腺癌细胞的生长[13]的潜力.至今,有关洛伐他汀与血清蛋白相互作用的研究国内外尚未见公开报道,开展血清蛋白与洛伐他汀相互作用研究,对进一步阐述其药代和药理作用具有重要意义.
1 实验部分
1.1 试剂与仪器
F96S荧光仪(上海棱光技术有限公司);J-815圆二色谱仪(日本JASCO公司);UV-1601紫外-可见分光光度计(日本Shimadzu公司);DK-S24电热恒温水浴锅(上海精宏实验设备有限公司);雷磁pHS-25型数显pH计(上海精密科学仪器有限公司).Chem3D (Version 8.0)软件(美国CambridgeSoft公司);Gaussian 03软件(美国Gaussian公司);AutoDock 4.0软件来自于SWISS-MODEL Repository (http://swissmodel.expasy.org/repository/?pid=smr01&zid=async).
洛伐他汀(≥99.9%)由杭州默沙东公司(杭州,中国)提供;BSA购于上海申航生物科技有限公司(上海,中国);保泰松(≥99.9%)购于湖北恒硕化工有限公司(湖北,中国);布洛芬(≥99.9%)由浙江工业大学药学院提供.三(羟基甲基)氨基甲烷(≥99%)购于衢化试剂有限公司(浙江,中国).
其他所用试剂均为分析纯,整个实验所用水为二次重蒸水.
1.2 溶液配制
洛伐他汀溶液:准确称量0.101 1 g洛伐他汀用甲醇定容于25 mL的容量瓶中,然后准确移取0.5 mL甲醇溶液到100 mL容量瓶,用0.05 mol/L Tris-HCl缓冲液(pH=7.4)定容,配制成5×10-5mol/L溶液作为储备液.此溶液保存温度4 ℃以下.
BSA溶液:称取0.730 5 g氯化钠和0.166 1 g牛血清蛋白,置于250 mL容量瓶中,用0.05 mol/L Tris-HCl缓冲溶液(pH=7.4)定容,配制成10-5mol/L BSA-NaCl储备液.此溶液保存于4 ℃以下.
保泰松溶液:准确称量0.077 1 g保泰松用甲醇定容于25 mL的容量瓶中,然后准确移取0.5 mL甲醇溶液到100 mL容量瓶,用0.05 mol/L Tris-HCl缓冲溶液(pH=7.4)定容,配制成5×10-5mol/L溶液作为储备液.
布洛芬溶液:准确称量0.051 6 g布洛芬用甲醇定容于25 mL的容量瓶中,然后精密移取0.5 mL甲醇溶液到100 mL容量瓶,用0.05 mol/L Tris-HCl缓冲溶液(pH=7.4)定容,配制成5×10-5mol/L溶液作为储备液.
1.3 荧光光谱测定
配制一系列含有不同洛伐他汀浓度的BSA溶液,含BSA浓度为1.0×10-6mol/L,设定激发波长为289 nm,在不同温度下测定其荧光光谱,扫描范围300~450 nm.测定时,以0.05 mol/L Tris-HCl缓冲溶液进行荧光空白校正.
1.4 紫外光谱测定
在室温下,以0.05 mol/L Tris-HCl缓冲溶液为参比溶液,测定BSA和洛伐他汀溶液的紫外光谱,扫描范围200~400 nm.
1.5 圆二色谱测定
在室温下,以0.05 mol/L Tris-HCl缓冲溶液为参比溶液,测定BSA和洛伐他汀溶液的圆二色谱,扫描范围200~240 nm.
1.6 分子对接模拟
BSA晶体结构数据(P02769)从Protein Data Bank (http://www.pdb.org/pdb/home/home.do)获取.洛伐他汀3D结构数据从PubChem数据库(http://pubchem.ncbi.nlm.nih.gov)获取,其结构运用DFT理论在B3lyp/6-311+G(d)水平上进行最低能量优化至Hessian矩阵分析无虚频,其理论计算在Gaussian 03软件上完成.
洛伐他汀与BSA之间的相互作用运用AutoDock 4.0软件模拟.模拟计算时,网格大小设置为60(60(60,网格中心分别设置为(6.113 4,-11.009 6,7.119 7),points(6.841 1,2.435 6,-14.718 4) and points (-1.216,-20.239,-6.738).采用拉马克遗传算法(Lamarckian GA),进行200次运算,其他参数均设置为程序的默认值.
2 结果与讨论
2.1 BSA荧光猝灭
蛋白质具有天然荧光,这种吸收主要是来自与蛋白分子中色氨酸、酪氨酸和苯丙氨酸残基.含有色氨酸、酪氨酸和苯丙氨酸的蛋白质,最大荧光发射约在320~350 nm范围内.三种氨基酸中,色氨酸的荧光强度最强,对微环境的变化最为敏感,所以研究溶液中蛋白质的构象变化时,常将其作为蛋白质的内源荧光探针[14-15].从图1可知:随着洛伐他汀浓度的增加,BSA的荧光强度逐渐降低;而最大发射波长未发生变化.这表明了洛伐他汀与BSA发生了相互作用,从而导致BSA荧光猝灭.其猝灭常数可用Stern-Volmer方程计算[16],即
(1)
式中:F0为无猝灭剂洛伐他汀存在时BSA溶液的荧光发射强度;F为猝灭剂洛伐他汀存在时BSA溶液的荧光发射强度;[Q]为猝灭剂洛伐他汀总浓度;kq为生物分子猝灭速率常数;KSV为猝灭速率常数;τ0≈6ns[17]为无猝灭剂存在时BSA的平均荧光寿命.

从曲线0—5,CLovastatin=0,5×10-6,10×10-6, 15×10-6,20×10-6和25×10-6 mol/L
从图2可见:F0/F与洛伐他汀浓度之间具有良好的线性关系,由其斜率可求得不同温度下的猝灭常数(KSV).一般认为,对由于形成基态结合物的静态猝灭,其KSV随温度升高而减小;而由扩散碰撞引起的动态猝灭,KSV随温度升高而增大.另外,动态猝灭过程中,其猝灭速率常数(kq)小于2×1010L/(mol·s)[18].从表1可知:洛伐他汀诱导的BSA荧光猝灭常数随温度升高而减小,并且猝灭速率常数(kq)大于2×1010L/(mol·s).这表明了洛伐他汀诱导的BSA荧光猝灭是一个静态猝灭过程,则洛伐他汀与BSA相互作用形成了结合物.

图2 不同温度下洛伐他汀猝灭BSA的Sterm-Volmer图

表1 不同温度下洛伐他汀猝灭BSA的猝灭常数
2.2 结合常数和结合位点的测定
对于静态猝灭,假设蛋白分子对配体分子有n个等同且独立的结合部位,其可结合常数(Kb)和结合位点数(n)可根据方程计算[16],即
lg[(F0-F)/F]=lgKb+nlg[Q]
(2)
因此,从图3的线性回归方程可得洛伐他汀与BSA的结合常数(Kb)和结合位点数(n),其结果如表3所示.从表3可知:在实验温度范围内,BSA与洛伐他汀的结合位点数(n)接近1,表明了洛伐他汀与BSA相互作用形成1∶1结合物,且结合常数为7.11×103L/mol (298 K).

图3 不同温度下洛伐他汀对BSA荧光猝灭的双对数曲线

表2 洛伐他汀结合到BSA上的热力学参数和结合常数(Kb)
2.3 热力学参数和结合模式
配体与蛋白相互作用过程中的主要非共价作用力有:氢键、范德华力、疏水作用及静电作用四种.配体与蛋白相互作用过程中的热力学参数的大小和正负,常用于判断配体与蛋白的作用模式.一般认为,ΔH0>0和ΔS0>0时,为典型的疏水作用;ΔH0<0和ΔS0<0时,分子间作用力为氢键作用和范德华力;ΔH0<0和ΔS0>0时,同时存在疏水作用和氢键作用;ΔH0≈0或较小、ΔS0>0时,主要作用力为静电作用[19].当温度变化不大时,蛋白与药物结合过程中的焓变(ΔH0)、熵变(ΔS0)及吉布斯自由能(ΔG0)可由Van’t Hoff方程测定[8],即
ΔG0=-RTlnKb
(3)
(4)
式中R为气体常数.结果表明:lnKb与1/T之间具有良好线性关系,其热力学参数计算结果列于表2.BSA与洛伐他汀作用过程中的ΔH0和ΔS0分别为-18.126 kJ/mol和12.84 J/(mol·K)(表2),表明了BSA与洛伐他汀相互作用的主要作用力是疏水作用和氢键作用.
2.4 圆二色谱和紫外光谱的测定
圆二色谱(CD)是一种常用于鉴定蛋白与配体相互作用过程中蛋白的二级结构变化的方法.当洛伐他汀存在时BSA的CD谱如图4所示.从图4可知:游离BSA溶液存在两个负吸收带,分别位于209 nm和222 nm.这是BSA二级结构的特征峰,它归属于α-螺旋肽键的π→π*和n→π* 电子跃迁.当洛伐他汀加入到BSA溶液后,BSA的CD谱的负峰强度略有增强.这表明了洛伐他汀与BSA结合后,导致BSA的二级结构变化,且其α-螺旋量略有增加.

1-游离BSA溶液(1.0×106 mol/L);2-游离洛伐他汀溶液(25×106 mol/L);3-洛伐他汀(25×106 mol/L)和BSA(1.0×106 mol/L)混合溶液;4-曲线3与曲线2的差谱
从图5可知:洛伐他汀和BSA混合溶液与游离洛伐他汀的差谱与游离BSA光谱存在着一定变化,其吸光度略有增加,并且其吸收波长红移.这意味着BSA二级结构发生了微小变化.
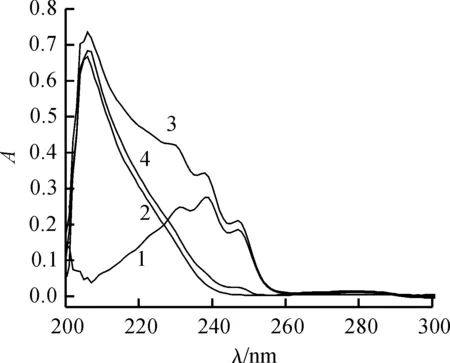
1-游离洛伐他汀(25×106 mol/L);2-游离BSA溶液(0.5×106 mol/L);3-洛伐他汀(25×106 mol/L)和BSA(0.5×106 mol/L)混合溶液;4-曲线3与曲线1的差谱
2.5 结合位点的确定
许多研究结果表明配体在BSA上的结合位点主要有亚结构域IIA(site I)和亚结构域IIIA(site II)位,而且保泰松、华法林结合在site I位上,布洛芬、氯灭酸结合在site II位[20].为了测定洛伐他汀在BSA上结合位点,保泰松和布洛芬分别用作site I和site II位的探针分子.在结合位点探针分子存在下,BSA(CBSA=1×10-6mol/L)溶液的荧光光谱如图6所示.从图6可知:随着洛伐他汀加入到保泰松-BSA混合液中,BSA的荧光强度随之下降,出现荧光猝灭;而洛伐他汀加入布洛芬-BSA混合液中,其BSA的荧光强度基本不变.依据式(2)可计算出位点探针分子存在下,BSA与洛伐他汀的结合常数,如表3所示.从表3可见:当保泰松位点探针分子存在时,BSA与洛伐他汀的结合常数变化较小;而布洛芬位点探针分子存在时,BSA与洛伐他汀的结合常数接近0.这表明了布洛芬与洛伐他汀与BSA之间发生了明显竞争结合,意味着洛伐他汀主要结合在BSA的site II上.

曲线0—5洛伐他汀浓度:0,5×10-6,10×10-6,15×10-6,20×10-6,25×10-6 mol/L

表3 在位点探针分子存在下BSA与洛伐他汀的结合常数
2.6 分子对接
为了进一步阐明洛伐他汀与BSA的结合位点和相互作用力,依据保泰松和布洛芬在HSA上的结合位点,用AutoDock 4.0进行模拟洛伐他汀与BSA的相互作用,其结果列于表4.结合能越小,表明形成的结合物越稳定.因此,洛伐他汀优先结合在BSA的site II位上,如图7(a)所示.这与探针分子竞争实验结果是一致的.从图7(b)可知:洛伐他汀-BSA结合物中,距洛伐他汀5.000范围内氨基酸残基有疏水性残基(Ala-314,Leu-221,Leu-261,Leu-478,Pro-470)、极性残基(Cys-471,Trp-237,Tyr-475,)和带电荷残基(Arg-218,Arg-222,Arg-241,Asp-474,Lys-245).另外,洛伐他汀与Arg-218和Arg-241残基间形成稳定氢键(图7c),并且ΔE3绝对值明显小于ΔE2.这表明了洛伐他汀与BSA间的主要作用力是疏水作用力和氢键作用力,这与热力学参数分析结果是一致的.

表4 分子对接获到的洛伐他汀-BSA结合物的能量1)

图7 洛伐他汀与BSA分子对接结果图
3 结 论
实验结果表明:洛伐他汀通过疏水作用和氢键作用插入BSA的亚结构域IIIA(site II)疏水腔,导致BSA荧光稳态猝灭.洛伐他汀与BSA的结合位点数均约为1,形成1∶1结合物,其结合常数(Kb)数量级为103.当洛伐他汀结合到BSA亚结构域IIIA(site II)后,导致BSA二级结构产生微小变化.两者结合过程中,吉布斯自由能(ΔG0)、焓变(ΔH0)和熵变(ΔS0)分别为-21.94 kJ/mol,-18.13 kJ/mol和12.84 J/(mol·K),表明洛伐他汀与BSA结合是一个自发的过程,其主要作用力是疏水作用和氢键作用.
参考文献:
[1] GUO Ming, ZOU Jian-wei, YI Ping-gui, et al. Binding interaction of gatifloxacin with bovine serum albumin[J]. Analtical Sciences,2004,20(3):465-470.
[2] JAYABHARATHI J, THANIKACHALAM V, PERUMAL M V. A study on the binding interaction between the imidazole derivative and bovine serum albumin by fluorescence spectroscopy[J]. Journal of Luminescence,2012,132(3):707-712.
[3] GENG Fei, ZHANG Li-qiang, YU Li, et al. Interaction of bovine serum albumin and long-chain imidazolium ionic liquid measured by fluorescence spectra and surface tension[J]. Process Biochemistry,2010,45(3):306-311.
[4] GELAMO E L, SILVA C H T P, IMASATO H, et al. Interaction of bovine (BSA) and human (HSA) serum albumins with ionic surfactants: spectroscopy and modeling[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology,2002,1594(1):84-99.
[5] ZHANG Li-na, WU Fang-ying, LIU Ai-hong. Study of the interaction between 2,5-di-[2-(4-hydroxy-phenyl) ethylene]-terephthalonitril and bovine serum albumin by fluorescence spectroscopy[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2011,79(1):97-103.
[6] SHAHABADI N, FILI S M. Molecular modeling and multispectroscopic studies of the interaction of mesalamine with bovine serum albumin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2014,118:422-429.
[7] YU Xian-yong, LIAO Zhi-xi, YAO Qing, et al. The investigation of the interaction between Tropicamide and bovine serum albumin by spectroscopic methods[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2014,118:331-336.
[8] SHI Jie-hua, ZHU Ying-Yao, WANG Jing, et al. Intermolecular interaction of prednisolone with bovine serum albumin: Spectroscopic and molecular docking methods[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2013,103:287-294.
[9] SHI Jie-hua, WANG Jing, ZHU Ying-yao, et al. Characterization of interaction between isoliquiritigenin and bovine serum albumin: Spectroscopic and molecular docking methods[J]. Journal of Luminescence,2014,145:643-650.
[10] ALBERTS A W. Discovery, biochemistry and biology of lovastatin[J]. American Journal of Cardiology,1998,62:J10-J15.
[11] 施介华,薛竹.微乳液相色谱法测定他汀类药物[J].浙江工业大学学报,2012,40(2):119-123.
[12] MARTIROSYAN A, CLENDENING J W, GOARD C A, et al. Lovastatin induces apoptosis of ovarian cancer cells and synergizes with doxorubicin: Potential therapeutic relevance[J]. BMC Cancer,2010,10:103.
[13] KLAWITTER J, SHOKATI T, MOLL V, et al. Effects of lovastatin on breast cancer cells: a proteo-metabonomic study[J]. Breast Cancer Research,2010,12:R16.
[14] SKRT M, BENEDIK E, PODLIPNIK, et al. Interactions of different polyphenols with bovine serum albumin using fluorescence quenching and molecular docking[J]. Food Chemistry,2012,135(4):2418-2424.
[15] JOSHI P, CHAKRABORTY S, DEY S, et al. Binding of chloroquine-conjugated gold nanoparticles with bovine serum albumin[J]. Journal of Colloid and Interface Science,2011,355(2):402-409.
[16] LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. 3rd. New York: Springer,2006:278.
[17] WARE W R. Oxygen quenching of fluorescence in solution: an experimental study of the diffusion process [J].Journal of Physical Chemistry,1962,66(4):455-458.
[18] ABOU-ZIED O K, AL-SHIHI O I K. Characterization of subdomain IIA binding site of human serum albumin in its native, unfolded, and refolded states using small molecular probes[J]. Journal of the American Chemical Society,2008,130(32):10793-10801.
[19] LAKOWICZ J R, WEBER G. Quenching of fluorescence by oxygen: A probe for structural fluctuations in macromolecules[J]. Biochemistry,1973,12(21):4161-4170.
[20] SREERAMA N, WOODY R W. A self-consistent method for the analysis of protein secondary structure from circular dichroism[J]. Analytical Biochemistry,1993,209(1):32-44.

