限制性内切酶KpnⅠ和EcoRⅠ双酶切条件的优化
朱杭飞,姜晓明,藏雨轩,张雲乔,向国艳,张中新,郝 峰* (吉林医药学院:.生物化学检验教研室,.免疫教研室,吉林 吉林 303)
限制性核酸内切酶是一种可以识别DNA的特异序列,并在识别位点或其周围切割双链DNA的一类内切酶[1]。约翰霍普金斯大学的丹尼尔·那森斯、汉弥尔顿·史密斯与伯克利加州大学的沃纳·亚伯因为限制性内切酶的发现与研究而获1978年度的诺贝尔生理学奖,开创了分子遗传学的新篇章[2]。目前,限制性内切酶的酶切技术因其操作简单和快速等优点广泛应用分子生物学等领域。双酶切更为广泛应用于载体构建等分子生物学实验,因为单酶切后连接目的基因理论上会出现50%可能的错误性,而双酶切后的不同黏性末端在一定程度上避免单酶切的不足[3]。KpnⅠ和EcoRⅠ是目前常用的限制性内切酶,属第Ⅱ型限制性内切酶,来源方便、价格便宜,广泛应用于分子生物学实验[4]。试剂公司会给出这两种酶的适合缓冲液,但这两种限制性内切酶的最适缓冲液离子浓度相差较大,给这两种酶的应用带来一定不便。本研究选取KpnⅠ和EcoRⅠ不同的酶切体系,探讨KpnⅠ和EcoRⅠ双酶切的适宜实验条件,为今后应用KpnⅠ和EcoRⅠ双酶切实验提供科学的参考依据。
1 材料与方法
1.1 材 料
KpnⅠ、EcoRⅠ、缓冲液H、缓冲液L、Bovine Serum Albumin (BSA)、Loading Buffer和Ethidiμm Bromide(Takara公司);pEGFP-Ano2质粒(本实验室前期构建);TAE、琼脂糖(Agar)和DL5000 DNA marker(Promega公司);Nanodrop 2000分光光度计(Thermo公司);质粒提取试剂盒(Axygen公司);DNA琼脂糖凝胶电泳仪(Biorad公司);凝胶成像系统(德国alpha FluorChem HD2)。
1.2 重组质粒的转化、提取和测序
将重组质粒转化入大肠杆菌感受态DH5α中,在含卡那抗性的固体培养基中培养过夜,次日挑取单个阳性克隆于5 mL卡那抗性的液体LB中,放于37 ℃ 180 r/min的摇床中过夜后,质粒提取试剂盒提取质粒,Nanodrop 2000分光光度计测其浓度和纯度,并于上海生工测序。
1.3 KpnⅠ和EcoRⅠ分别单酶切pEGFP-Ano2
取0.5 mL离心管,配制50 μLKpnⅠ单酶切体系,加入1 μLKpnⅠ、5 μL 10×Buffer L和1 μg质粒,其余体积用超纯水补齐,置于37 ℃恒温水浴锅中1 h,琼脂糖凝胶电泳检测酶切结果。
另取0.5 mL离心管,配制50 μLEcoRⅠ单酶切体系,加入1 μLEcoRⅠ、5 μL 10×Buffer H和1 μg质粒,其余体积用超纯水补齐,置于37 ℃恒温水浴锅中1 h,琼脂糖凝胶电泳检测酶切结果。
琼脂糖凝胶电泳具体步骤如下:称取0.3 g Agar放入一锥形瓶中,加入30 mL 1×TAE电泳缓冲液,置微波炉加热至完全溶化,呈透明状,倒入制胶板上,加5 μL EB,混匀,在一端插入梳子,冷却凝固后,拔起梳子。把上述的各个样品从37 ℃恒温水浴锅中移出,吸一半入另一离心管中,各加入3 μL Loading Buffer,混匀。取一离心管加入1 μL质粒、2 μL Loading Buffer作为对照。用移液枪把各个样品和已知分子量的DL 5000 DNA marker按一定顺序加至凝胶的加样孔中,在电泳槽中加入适量1×TAE。最后接通DNA琼脂糖凝胶电泳仪,调节电压和电流,开始电泳。观察溴酚蓝的位置,当其移动至琼脂糖凝胶一半时,结束电泳,在凝胶成像系统中观察酶切条带。
1.4 不同的单酶切体系KpnⅠ和EcoRⅠ单酶切pEGFP-Ano2
第一组取0.5 mL离心管,配制50 μLKpnⅠ单酶切体系,加入1 μLKpnⅠ、5 μL 10×Buffer L和1 μg质粒,其余体积用超纯水补齐,放入37 ℃恒温水浴锅中1 h后,加入5 μL 10×Buffer H水浴1 h,琼脂糖凝胶电泳检测酶切结果。
第二组取0.5 mL离心管,配制50 μLEcoRⅠ单酶切体系,加入1 μLEcoRⅠ、5 μL 10×Buffer H、5 μL 10×Buffer L和1 μg质粒,其余体积用超纯水补齐,放入37 ℃恒温水浴锅中0.5 h,琼脂糖凝胶电泳检测酶切结果。
第三组取0.5 mL离心管,配制50 μLEcoRⅠ单酶切体系,加入1 μLEcoRⅠ、5 μL 10×Buffer H、5 μL 10×Buffer L和1 μg质粒,其余体积用超纯水补齐,放入37 ℃恒温水浴锅中1 h,琼脂糖凝胶电泳检测酶切结果。
第四组取0.5 mL离心管,配制50 μLEcoRⅠ单酶切体系,加入1 μLEcoRⅠ、5 μL 10×Buffer H、5 μL 10×Buffer L、5 μL BSA和1 μg质粒,其余体积用超纯水补齐,置37 ℃恒温水浴锅中1 h,琼脂糖凝胶电泳检测酶切结果。
琼脂糖凝胶电泳具体见以上步骤,并每个实验均重复3次。
1.5 KpnⅠ和EcoRⅠ双酶切质粒pEGFP-Ano2
取0.5 mL离心管,配制50 μLKpnⅠ和EcoRⅠ双酶切体系,加入1 μLKpnⅠ、5 μL 10×Buffer L和1 μg质粒,其余体积用超纯水补齐,置37 ℃恒温水浴锅中1 h后,加入1 μLEcoRⅠ、5 μL BSA和5 μL 10×Buffer H水浴1 h,琼脂糖凝胶电泳检测酶切结果。琼脂糖凝胶电泳具体见以上步骤,并每个实验均重复3次。
2 结 果
2.1 重组质粒质量测定结果
应用Nanodrop 2000分光光度计检测重组质粒的浓度和纯度,结果显示在260 nm处有最大吸收峰,浓度为349.5 mg/L,260/280为1.78,260/230为2.13,结果表明获得质量良好的重组质粒。结果见图1。
2.2 重组质粒测序结果
测序结果显示在目的基因上游的限制性内切酶位点为EcoRⅠ,下游限制性内切酶切位点为KpnⅠ。结果见图2。
2.3 KpnⅠ和EcoRⅠ分别单酶切pEGFP-Ano2
KpnⅠ和EcoRⅠ分别单酶切质粒,结果显示将质粒pEGFP-Ano2酶切为一条7 400 bp的条带,结果表明,本实验所用KpnⅠ和EcoRⅠ质量良好,KpnⅠ在1×Buffer L条件下可发挥较好活力,EcoRⅠ在1×Buffer H条件下可发挥较好活力。结果见图3。
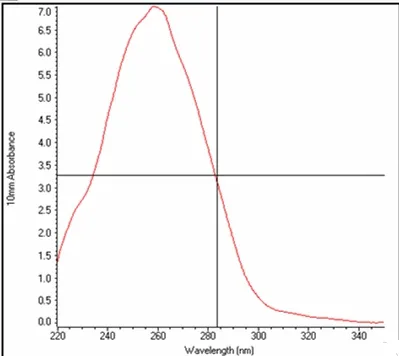
图 1 重组质粒pEGFP-Ano2浓度和纯度检测
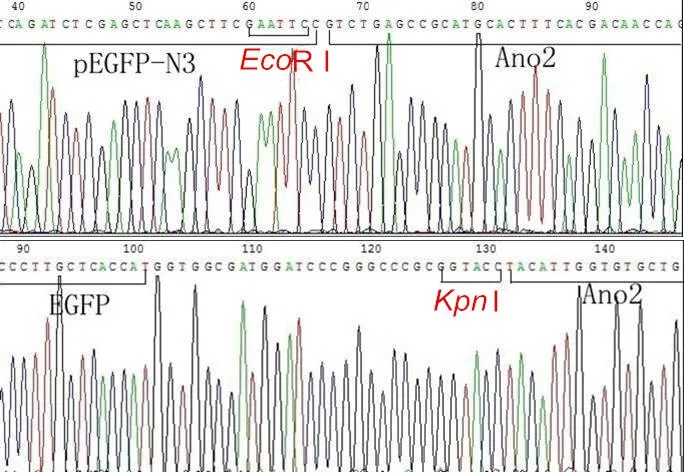
图 2 重组质粒pEGFP-Ano2测序结果

图 3 重组质粒pEGFP-Ano2单酶切电泳图
2.4 不同的单酶切体系KpnⅠ和EcoRⅠ单酶切pEGFP-Ano2
KpnⅠ在1×Buffer L酶切1 h,再加入1× Buffer H酶切1 h的条件下,结果显示KpnⅠ将质粒pEGFP-Ano2酶切为大小7 400 bp的条带,则证实在此条件下KpnⅠ可将质粒pEGFP-Ano2酶切彻底,见图4-A。EcoRⅠ在含1×Buffer H和1×Buffer L的共同条件下,单酶切0.5 h,结果显示出现两条清晰的条带,一条为7 400 bp,另一条与Ano2酶切结果中的最后一条条带对齐,则表明此条件下EcoRⅠ酶切不彻底,见图4-B。延长EcoRⅠ酶切时间,结果显示EcoRⅠ的条带出现弥散现象,则表明在此条件下EcoRⅠ酶切时间过长而发生星活性,见图4-C。EcoRⅠ单酶切体系中加入BSA后,结果显示EcoRⅠ将质粒pEGFP-Ano2酶切为大小7 400 bp的条带,则证实在此条件下EcoRⅠ可将1 μg含有EcoRⅠ酶切位点的载体pEGFP-Ano2彻底酶切,见图4-D。
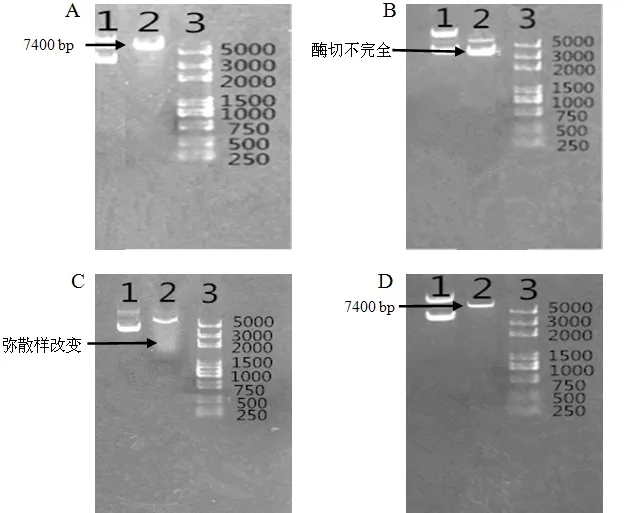
图 4 重组质粒pEGFP-Ano2单酶切电泳图
2.5 KpnⅠ和EcoRⅠ双酶切质粒结果
根据KpnⅠ和EcoRⅠ单酶切质粒pEGFP-Ano2的适宜条件,将其应用于KpnⅠ和EcoRⅠ双酶切实验中,结果显示KpnⅠ和EcoRⅠ将质粒pEGFP-Ano2双酶切为两条清晰条带,分别为4 700 bp和2 700 bp。结果见图5。
3 讨 论
KpnⅠ和EcoRⅠ是两种常用的限制性内切酶,广泛应用于载体构建、DNA探针制备以及DNA序列分析等多种分子生物学实验[5]。KpnⅠ的专一识别顺序是5′…GGTAC↓C…3′,推荐的缓冲液是1×Buffer L,组分为100 mol/L Tris-HCl、100 mmol/L MgCl2和10 mmol/L Dithiothreitol,pH 7.5;EcoRⅠ的专一识别顺序是5′…G↓AATTC3′,推荐缓冲液为1×Buffer H,内含500 mmol/L Tris-HCl、100 mmol/L MgCl2、10 mmol/L Dithiothreitol和1.000 mmol/L NaCl,pH 7.5。Buffer H和Buffer L的离子浓度不同,会影响限制性内切酶酶切效果,并且酶的种类、质粒的浓度、纯度和酶切时间等因素都可能对酶切效果产生重要影响。例如质粒中含有过多的酚、酒精、氯仿、EDTA、变性剂或过多盐离子的污染都会影响质粒质量,引起酶切不完全或者星活性的产生,而质粒浓度过高、酶浓度量过低或者不适当的限制性酶的保存和应用都可能造成酶切不彻底。BSA是一种牛血清白蛋白,可以通过提高溶液中蛋白质的浓度,防止酶的分解和非特异性吸附,减轻某些酶的变性,从而对酶起保护作用,广泛应用于限制性内切酶酶切反应实验中[6]。酶切时间过长,会出现星活性现象。星活性是反应条件不同而产生的切断与原来认识序列不同的位点的现象,多由于酶切时间延长等因素[7]。
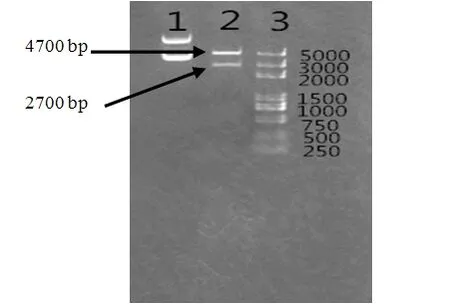
图 5 重组质粒pEGFP-Ano2双酶切电泳图
在本实验选取上下游含有KpnⅠ和EcoRⅠ的pEGFP-Ano2质粒,应用质粒提取试剂盒提取该质粒和Nanodrop 2000分光光度计检测其浓度和纯度,并应用琼脂糖凝胶电泳检测质粒完整性,实验结果表明浓度和纯度都符合要求。KpnⅠ和EcoRⅠ分别在1×Buffer L和1×Buffer H的条件下酶切1 h,结果显示均为只有一条明显的7 400 bp的条带,证实本研究所用的限制性内切酶KpnⅠ和EcoRⅠ质量良好,KpnⅠ在1×Buffer L条件下可发挥较好活力,EcoRⅠ在1Buffer H条件下可发挥较好活力。为获取KpnⅠ和EcoRⅠ双酶切质粒pEGFP-Ano2的适宜条件,进行KpnⅠ和EcoRⅠ单酶切体系的探索。KpnⅠ在1×Buffer L酶切1 h,再在含1×Buffer H酶切1 h时,实验结果显示只有一条明显的7 400 bp的条带,表明在上述条件下KpnⅠ可将质粒pEGFP-Ano2酶切彻底。EcoRⅠ在1×Buffer H和1×Buffer L酶切0.5 h的条件下,显示酶切不完全,可能是盐浓度降低的因素,从而延长EcoRⅠ的酶切时间,但产生星活性而发生弥散现象。加入具有保护酶特性的BSA,实验结果表明此为EcoRⅠ单酶切质粒的适宜条件。因此,KpnⅠ和EcoRⅠ单酶切质粒的适宜条件应用于双酶切中,实验结果显示为两条正确的条带,分别为4 700 bp和2 700 bp,则成功获取KpnⅠ和EcoRⅠ双酶切质粒的适宜条件:首先在1×L缓冲液的情况下,应用1 μLKpnⅠ酶切1 μg质粒1 h,再加入1×H缓冲液和0.01% BSA,应用1 μLEcoRⅠ继续酶切1 h。
总之,本实验获取KpnⅠ和EcoRⅠ双酶切质粒的适宜条件,为今后实验提供科学的参考依据。
[1] Manna S,Harman A,Accari J,et al.Altering the selection capabilities of common cloning vectors via restriction enzyme mediated gene disruption[J].BMC Res Notes,2013,6:85.
[2] Stevens M,Cheng J B,Li Daofeng,et al.Estimating absolute methylation levels at single-CpG resolution from methylation enrichment and restriction enzyme sequencing methods[J].Genome Res,2013,23(9):1541-1553.
[3] Zhang Lei,Hendrickx T L,Kampman C,et al.Co-digestion to support low temperature anaerobic pretreatment of municipal sewage in a UASB-digesterr[J].Bioresour Technol,2013,148:560-566.
[4] Shan Qiwei,Wang Yanpeng,Li Jun,et al.Targeted genome modification of crop plants using a CRISPR-Cas system[J].Nat Biotechnol,2013,31(8):686-688.
[5] Suhartono S.Detection and identification of human herpesvirus type 6 (HHV-6) infection by polymerase chain reactions and restriction endonuclease analysis[J].J Bio Ed,2013,1(1):35-39.
[6] Wu Aizhi,Lin Chaozhan,Zhai Yajing,et al.Investigation of the interaction between two phenylethanoid glycosides and bovine serum albumin by spectroscopic methods[J].J Pharmaceutical Analysis,2013,3(1):61-65.
[7] Raddatz G,Guzzardo P M,Olova N,et al.Dnmt2-dependent methylomes lack defined DNA methylation patterns[J].Proc Natl Acad Sci U S A,2013,110(21):8627-8631.

