五味子多糖对人脑胶质瘤细胞凋亡的影响
孟天娇,姜亚磊,闫晓英,狄 烊,金 宏,齐 玲 (吉林医药学院:.临床本科班,2.实验中心,.病理教研室,吉林 吉林 20)
五味子在《神农本草经》中被列为上品,具有收敛、固涩、名目、益气生津、补肾宁心的作用,是中医常用的滋补强壮药。五味子多糖(Fructus Schisandrae Polysaccharide,FSP)是木兰科植物五味子干燥成熟果实的提取物,一般没有精确的分子量。研究显示五味子多糖对肿瘤具有明显的抑制作用,但现今还不是十分清楚其具体抑制肿瘤增殖的机制。本实验通过对FSP作用后脑胶质瘤细胞的研究,初步探讨FSP对脑胶质瘤细胞抑制作用机制。
1 材料与方法
1.1 细胞和主要试剂
FSP(北华大学提供);小牛血清(Gibco公司);0.25%胰酶(Gibco公司);超氧化物歧化酶(SOD)和谷胱甘肽(GSH)检测试剂盒(南京建成生物工程研究所);bax、Bcl-2及Caspase-3抗体(北京中杉)。
1.2 人脑胶质瘤细胞培养
将脑胶质瘤SHG-44细胞接种于含10%小牛血清的RPMI-1640培养液中,37 ℃、5%CO2及饱和湿度下进行培养,隔日换液。观察胶质瘤细胞生长状况,当细胞生长密度大于90%,进行细胞的传代培养,3代以后的脑胶质瘤细胞用于实验。
1.3 人脑胶质瘤SHG-44细胞(和上清)SOD的测定
将浓度分别为0、200、400、800 μg/mL的药物作用于胶质瘤细胞,72 h后分别收集上清液和细胞,测定两者SOD活力;分为对照孔、对照空白孔、上清测定孔、细胞测定孔、细胞测定空白孔和上清测定空白孔,振荡器震荡混匀,37℃,30 min,450 nm测定。在测定细胞SOD活力时,需要测定细胞蛋白浓度,通过超声破碎的方法实现。
1.4 人脑胶质瘤SHG-44细胞GSH的测定
测定试剂盒来自南京建成生物工程研究所;将收集好的细胞,用PBS清洗1-2次后,低速离心收集沉淀细胞,再加入0.3~0.5 mL 0.1 mol/L pH7.4的等渗PBS缓冲液悬浮细胞,超声研磨破碎细胞,分别设置空白孔、标准孔和测定孔;混匀,静置5 min,405 nm处酶标仪测定各孔吸光度值。
1.5 ELISA法测定人脑胶质瘤SHG-44上清bax、Bcl-2、Caspase-3蛋白
将相同密度的SHG-44脑胶质瘤细胞接种于24孔培养板中,实验分为空白组(不含药物)和用药组(浓度分别为200、400、800 mg/L),作用72 h。取细胞培养上清,与包被液按1∶1比例包被后4 ℃过夜。封闭后分别加入bax、Bcl-2、及Caspase-3抗体(1∶500稀释)4 ℃过夜。加入二抗(1∶1 000稀释)室温下孵育2 h,室温避光显色,有颜色变化时终止显色。自动酶标仪492 nm处测定吸光度(A)值。
1.6 统计学处理
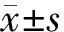
2 结 果
2.1 脑胶质瘤SHG-44细胞SOD和GSH变化
不同的浓度的FSP作用于胶质瘤细胞48 h之后,比较SOD活力,浓度差异具有统计学意义(P<0.01);与空白组相比,用药组SOD活力偏低。
GSH测定结果显示,实验中800 mmol/L浓度加药组降低显著,具体变化可以看出,在加入FSP后,出现一个明显的GSH耗竭现象,而GSH的损耗可以启动肿瘤细胞凋亡(表1)。
2.2 FSP作用下凋亡蛋白bax、Bcl-2、Bcl-2/bax及Caspase-3的作用
浓度为800的实验组细胞Caspase-3和bax含量显著上升,Bcl-2含量显著下降(P<0.01),同时Bcl-2/bax比例的下降,也提示凋亡的进行(表2)。
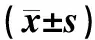
表 1 FSP对脑胶质瘤SHG-44 SOD和GSH影响
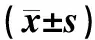
表 2 FSP作用下凋亡蛋白等的作用
3 讨 论
细胞凋亡是基因调控下的细胞主动死亡,又称程序化细胞死亡,其伴随着细胞质浓缩、细胞核崩裂、微粒消失、细胞膜皱缩、染色质浓缩继而解体、DNA裂解,最后形成凋亡小体。近年来的研究发现,许多肿瘤不仅存在细胞增殖,同时也存在细胞凋亡受阻,二者的不平衡状态是导致肿瘤恶性生长的基础[1-2]。研究发现p38γ可能作为致癌因子促进神经胶质瘤的生长和发展[3],miR-107的表达可以抑制细胞胶质瘤的增殖[4],可以看出当细胞失去凋亡的能力便可引起肿瘤。从中我们是否可以通过药物作用于肿瘤细胞的某个特定的靶点来抑制脑胶质瘤细胞增殖、诱导其凋亡,同时在不伤害正常组织的前提下达到抵抗肿瘤的目的,以提高患者的生存质量。本实验在倒置显微镜下观察,不同浓度的五味子多糖均能在一定程度上抑制脑胶质瘤细胞的增值,推测五味子多糖的抑瘤作用可能不是直接杀死瘤细胞,而与细胞凋亡及活化免疫细胞有关。
SOD是能够有效清除超氧化物阴离子自由基的一类极重要的抗过氧化酶,与肿瘤的发生、发展有一定的关系。在Ikeda通过自旋共振分光镜测定神经胶质瘤组织中SOD活性,发现肿瘤中央区SOD活力低于周边区[5],说明SOD活力降低程度与肿瘤呈现正相关的趋势[6]。然而实验结果中,用药组倒置显微镜下观察肿瘤细胞生长抑制明显,但肿瘤细胞内SOD活力并没有提升,反而有所下降,推测其中的原因:1)在Nakada测定的胃癌细胞和Oherley测定的肝癌细胞中SOD含量显著提高,推测其在不同性质的肿瘤细胞中,由于细胞的生理功能的差异和环境等因素的影响,使SOD作用途径发生改变,从而改变细胞SOD测定活力;2)在常规条件下,由于肿瘤细胞的异常增殖产生大量的自由基,从而消耗SOD的含量[7]。因此情况不同,实验结果也可能不同,对于FSP是否通过影响SOD含量来影响人脑胶质瘤细胞的凋亡还有待研究。
谷胱甘肽过氧化物酶(GSH-Px)是构成人体活性氧清除系统的主要抗氧化酶之一,可清除体内脂质过氧化物,减少活性氧对机体的损伤作用[8]。有研究提出完整的GSH不能通过肿瘤细胞膜,从而导致肿瘤细胞内GSH水平不升高[9],而实验中用药组GSH含量明显降低,其机制可能是FSP诱发了GSH耗竭现象[10]。GSH的耗竭是细胞凋亡信号传导的一个重要环节,可以通过间接以活性氧(ROS)为第二信使诱导肿瘤细胞凋亡,即通过激活核转录因子kappa B(NF-κB)等转录因子,破坏细胞膜生理功能,进而促使磷脂酰丝氨酸(PS)从膜内暴露出膜外,诱导肿瘤细胞的凋亡[11]。
Caspase为半胱氨酸天门冬氨酸蛋白酶(cysteinyl aspartate specific proteinase)的简称。参与细胞因子成熟、细胞生长和分化,并与细胞凋亡紧密相关,而Caspase-3是其中级联反应的中心环节[12-16],是引起细胞凋亡的关键性激酶,参与细胞凋亡的重要成分。Bcl-2是一种造血系统疾病中的原癌基因,其高表达可使胶质瘤细胞有更多机会逃避抗肿瘤药物或者化疗导致的细胞凋亡,当细胞成熟或凋亡时低表达甚至不表达[17];bax是Bcl-2家族的成员,其表达的蛋白与Bcl-2的作用相反,肿瘤细胞的凋亡情况取决于两种蛋白的表达比例[18]。这些蛋白含量的变化都能在一定程度上显示用药组脑胶质瘤细胞凋亡的情况。实验中,ELISA结果显示FSP对SHG-44脑胶质瘤细胞的增殖抑制作用具有时间和浓度的依赖性,即在48 h后400 mmol/L以上具有明显的抑制作用;浓度为800的FSP作用之后细胞Caspase-3和bax含量显著上升,Bcl-2含量显著下降(P<0.01)。其机制可能是FSP激发氧化应激反应(oxidative stress),上调procaspase-3与Caspase-8,在不影响Caspase转录水平的表达下诱导细胞凋亡;也可能直接激活Caspase3,通过GSH耗竭诱导细胞凋亡[19]。然而其具体通过什么方式影响脑胶质瘤细胞的凋亡,还有待学者进一步探讨和研究。
[1] Wamaru A,Iwado E,Kondo S,et al.Eupalmerin acetate a novel anticancer agent from Caribbean gorgonian octocorals induces apoptosis in malignant glioma cells via the c-jun NH2-teminal kinase pathway[J].Mol Cancer Ther,2007,6(1):184-192.
[2] Jiang Hao,Zhang Lijie,Kuo J,et al.Resveratrol induced apoptotic death in human U251 glioma cells[J].Mol Cancer Ther,2005,4(4):554-561.
[3] He Jie,Zhang Wanyu,Zhou Qiangqiang,et al.Low-expression of microRNA-107 inhibits cell apoptosis in glioma by upregulation of SALL4[J].Int J Biochem Cell Biol,2013,45(9):1962-1973.
[4] Yang Kui,Liu Yunsheng,Liu Zhixiong,et al.p38γ overexpression in gliomas and its role in proliferation and apoptosis[J].Sci Rep,2013,3:2089.
[5] Ikeda Y,Long D M.Oxygen free radicals in the genesis of peritumoural brain oedema in experimental malignant brain tumours[J].Acta Neurochir Suppl (Wien),1990,51:142-147.
[6] 郭世文,刘守勋,何百祥,等.检测脑胶质瘤患者血、脑脊液SOD活力及LPO含量的意义[J].肿瘤防治研究,2002,29(3):208-209.
[7] 赵心同,赵洪洋,姚东晓,等.脑胶质瘤治疗中自由基清除剂的价值[J].中华肿瘤防治杂志,2011,18(8):571-574.
[8] Ceruti P A.Prooxidant states and tumor promotion[J].Science,1985,27(4685):375-381.
[9] Paolicchi A,Pompella A,Tonarelli P,et al.Gamma glutamyltranspeptidase activity in human ovarian carcinoma[J].Anticancer Res,1996,16(5B):3053-3058.
[10] 王静丽,赵临襄,景永奎.谷胱甘肽的耗竭与肿瘤细胞凋亡[J].中国药物化学杂志,2003,13(6):361-366.
[11] Miller W H Jr.Molecular targets of arsenic trioxide in malignant cells[J].Oncologist,2002,7(Suppl 1):14-19.
[12] Ohba H,Moriwaki S,Bakalova R,et al.Plant-derived abrin induces apoptosis in cultured leukemic cell lines by different mechanismis[J].Toxicol Appl Phamacol,2004,195(2):182-193.
[13] Way T D,Kao M C,Lin J K.Degradation of HER2/neu by apigenin induces apoptosis through cytochrome release and caspase-3 activation in HER2/neu-overexpressing breast cancer cells[J].FEBS Lett,2005,579(1):145-152.
[14] Woo D H,Han I S,Jung G.Mefenamic acid-induced apoptosis in human liver cancer cell-lines through Caspase pathway[J].Life Sci,2004,75(20):2439-2449.
[15] Soto-Cerrato V,Liagostera E,Montaner B,et al.Mitochondria mediated apoptosis operating irrespective of multidrug resistance in breast canter cells by the anticancer agent prodigiosin[J].Biochem Phamacol,2004,68(7):1345-1352.
[16] Kaznelson D W,Bruun S,Monrad A,et al.Simultaneous human papilloma virus type 16 E7 and cdk inhibitor p21 expression induces apoptosis and cathepsin B activation[J].Virology,2004,320(2):301-312.
[17] Petit A,Mwale F,Zukor D J,et al.Effect of cobalt and chromium ions on bcl-2,bax,caspase-3 and caspase-8 expression in human U937 macraophages[J].Biomarials,2004,25(11):2013-2018.
[18] Jacobson M D.Reactiv Oxygen spcies and programmed cell death[J].Trend Biochem Sci,1996,21(3):83-86.
[19] Coffey R N,Watson R W,Hegarty P K,et al.Priming prostate carcinoma cells for increased apoptosis is associated with up-regulation of the caspases[J].Cancer,2001,92(9):2297-2308.

