MicroRNA-16对类风湿关节炎患者滑膜成纤维细胞增殖、侵袭及细胞因子分泌的影响
史栋梁, 史桂荣
(1河南省中医院风湿骨病科,河南 郑州 450002; 2商丘医学高等专科学校,河南 商丘 476100)
类风湿关节炎(rheumatoidarthritis,RA)是一种全身性的自身免疫疾病,以慢性、对称性多关节炎为主要临床表现。它的发病机制复杂,已有多种细胞、细胞因子和蛋白酶类参与[1]。滑膜成纤维细胞(synovialfibroblasts,SFs)的活化及致炎因子的分泌是导致RA炎症和组织破坏的直接机制[2]。MicroRNAs(miRNAs)是一类新型保守的非编码单链小分子RNA,广泛存在于各种生物体中。多项研究表明,miRNA与RA的发生、发展密切相关[3-4]。miR-16是miRNAs家族的重要成员,近期研究证实,RA患者中miR-16的表达水平明显增高,提示miR-16可能在RA的病理进程中发挥重要作用[5]。因此,本研究以RASFs为对象,构建miR-16过表达和低表达的RASFs模型,分析miR-16对RASFs增殖、侵袭及胞外基质、炎症因子水平的影响,为RA的防治提供新的靶点。
材 料 和 方 法
1 材料、试剂和仪器
人关节滑膜组织取自河南省中医学院二附院关节外科行关节置换术的RA患者,患者均签署知情同意书,RA患者临床诊断均符合美国风湿病学会标准。
RNAiso Plus kit、PrimeScript® RT reagent kit、SYBR®PremixExTaqTMII kit、LipofectamineTMRNAiMAX、抗β-肌动蛋白抗体、抗基质金属蛋白酶3/13(matrix metalloproteinase 3/13,MMP3/13)抗体、抗IL-1β抗体和辣根过氧化物酶标记羊抗兔IgG(Invitrogen);iQ5实时定量PCR仪和激光共聚焦显微镜(Bio-Rad);miR-16 mimic和miR-16 抑制剂(Thermo Scientific);ECL化学发光试剂盒、MTT、DMSO、DMEM培养基、annexin V-FITC和PI(Sigma);CO2细胞培养箱(Binder);流式细胞仪(Olympus)。
2 方法
2.1RASFs的培养 术中取出滑膜组织,立即于无菌条件下剪碎,2.5 g/L胰蛋白酶37 ℃消化2 h后,离心收集细胞,置于37 ℃、5% CO2培养箱内培养。当细胞长至接近融合状态后即可传代,第3~8代用于实验。
2.2细胞的分组及转染 实验分为4组:空白对照组(control)、脂质体对照组(mock)、miR-16抑制剂组及miR-16mimic组。采用LipofectamineTM2000将miR-16mimic或miR-16抑制剂转染细胞,混匀后于5%CO2、37 ℃恒温培养箱中孵育。
2.3RT-PCR 收集细胞,按试剂盒说明书提取总RNA。反转录合成第1链cDNA,PCR扩增。miR-16上游引物5’-TGC GGT AGC AGC ACG TAA AT-3’,下游引物5’-TGC AGG GTC CGA GGT AT-3’;MMP3上游引物5’-GGG TGA GGA CAC CAG CAT GA-3’,下游引物5’-CAG AGT GTC GGA GTC CAG CTT C-3’;MMP13上游引物5’-TTG AGG ATA CAG GCA AGA CT-3’,下游引物5’-TGG AAG TAT TAC CCC AAA TG-3’;IL-1β上游引物5’-ATC TCC TGC CAA CCC TAC A-3’,下游引物5’-CTT TCA GCT CAT ACG TGC C-3’;β-actin上游引物5’-GGT GTG ATG GTG GGT ATG GGT-3’,下游引物5’-CTG GGT CAT CTT TTC ACG GT-3’)。按照试剂盒的说明书进行RT-PCR。扩增条件为:预变性94 ℃ 5 min,进入循环,94 ℃ 1 min,60 ℃ 1 min,72 ℃ 3 min,30个循环后,72 ℃ 5 min。PCR 产物经1%琼脂糖凝胶电泳检测。利用Primer 5.0软件设计引物。引物由生工生物工程(上海)有限公司合成。依据2-ΔΔCt法计算各样本mRNA的相对表达量。
2.4MTT法测定RASFs增殖 取对数期生长的RASFs接种于96孔板,每孔200μL,含2×104个细胞,加入miR-16mimic或miR-16抑制剂混匀后培养48h,设置空白对照组;每孔加入20μLMTT溶液(5g/L),继续培养4h;弃上清,加入150μL二甲基亚砜,摇床上低速振荡10min,使结晶物充分溶解;酶标仪上测定570nm处A值。
2.5Transwell法检测细胞侵袭能力 取对数生长期的转染细胞和对照细胞,胰酶消化后,用无血清培养基洗3次,将细胞悬液密度调整成2×108/L。预先将Matrigel用无血清培养基DMEM稀释成1∶3浓度,均匀地铺满Transwell小室上室的聚碳酸酯膜,室温放置1 h。在下部小室中加入500 μL含10% FCS的DMEM培养基,小室内接种200 μL无血清细胞悬液,培养16 h 后取出Transwell膜,用PBS洗涤2次,4%多聚甲醛固定15 min,0.1%结晶紫染色10 min,显微镜下拍照,统计穿过Transwell膜的细胞数。
2.6AnnexinV/PI双染检测细胞凋亡 按操作说明书进行凋亡实验,具体操作为:收集各组细胞,用预冷的PBS洗涤3次,加入1mL1×annexinV结合缓冲液,离心去上清,在加入200μL结合缓冲液重悬细胞,分别加入10μLannexinV-FITC和5μLPI(5mg/L),轻轻混匀,避光孵育30min,流式细胞术检测。
2.7Western blotting 将培养的细胞用0.05%胰蛋白酶消化,PBS洗涤3次;加入450 μL细胞裂解液裂解细胞,SDS-PAGE蛋白电泳;电泳结束后将蛋白转移到硝酸纤维素膜上,用5%脱脂奶粉封闭2 h后加稀释好的Ⅰ抗4 ℃孵育过夜,次日PBS 1次、TBST 2次洗膜后加入辣根酶标记的Ⅱ抗室温孵育2 h。洗膜后ECL发光,X光片显影、定影、扫描仪扫描胶片。以β-actin作为内参照。
3 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 11.0统计软件处理,多组样本间两两比较用单因素方差分析(ANOVA)及LSD-t检验,以P<0.05为差异有统计学意义。
结 果
1 转染效率的测定
Mock组RASFs中miR-16表达水平较对照组无明显变化,而miR-16 mimic和miR-16抑制剂组RASFs中miR-16的表达水平分别为2.49±0.19和0.21±0.05,与对照组相比差异显著(P<0.05),见图1。
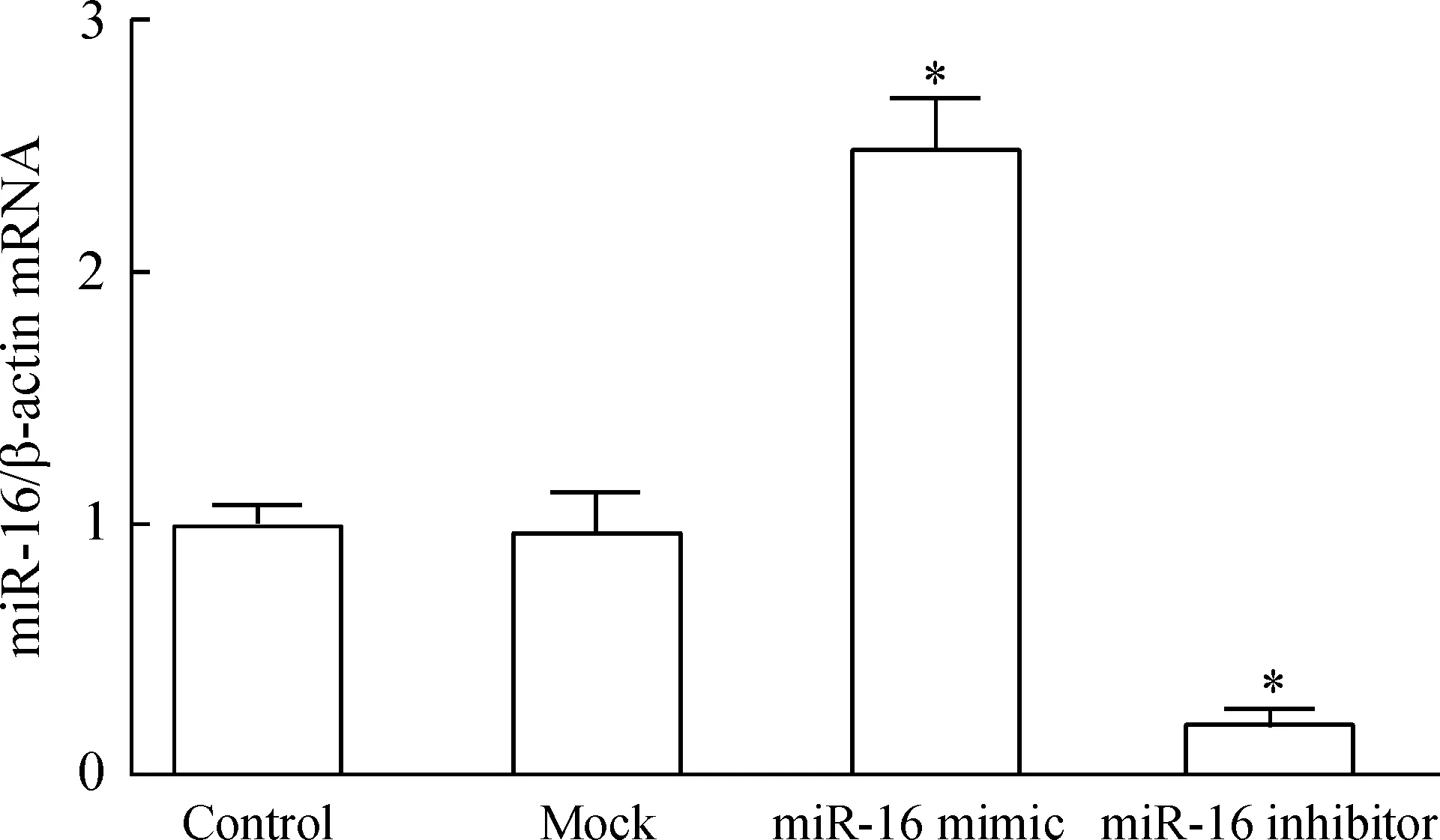
Figure 1. The expression of miR-16 in RASFs determined by RT-PCR.Mean±SD.n=3.*P<0.05 vs control.
2 miR-16对RASFs增殖和侵袭的影响
如图2A所示,与对照组相比,mock组无显著变化;而miR-16 mimic组可以抑制RASFs的增殖,其A值为0.31±0.07,miR-16抑制剂组则可促进RASFs的增殖,其A值为1.39±0.19,均有显著差异(P<0.05)。细胞侵袭结果如图2B所示,与对照组相比,mock组无显著变化;而miR-16 mimic组可以抑制RASFs的侵袭,穿膜细胞数为47±5(P<0.05),miR-16抑制剂组则可促进RASFs的侵袭,穿膜细胞数为149±13,均显著差异(P<0.05)。
3 miR-16对RASFs凋亡的影响
流式细胞术分析显示左下区细胞簇为活细胞,左上区细胞簇为坏死细胞,右下区及右上区细胞簇分别为早期凋亡和晚期凋亡细胞。与对照组相比,mock组、miR-16 mimic及miR-16抑制剂组的总细胞凋亡率均无显著差异(P>0.05),见图3。
4 miR-16对RASFs中MMPs表达水平的影响
将miR-16 过表达转染RASFs,RT-PCR分析表明,miR-16 mimic可明显降低RASFs中MMP3及MMP13 mRNA的水平,见图4A、B,同时MMP3及MMP13蛋白的水平明显降低,差异有统计学意义,见图4C。上述结果表明,miR-16可抑制RASFs中MMP3和MMP13的表达,提示其在缓解ECM的降解中具有重要作用。
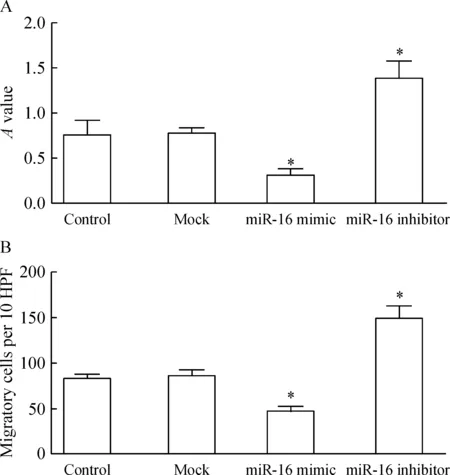
Figure 2. Effects of miR-16 on the proliferation (A) and invasion (B) of RASFs. HPF: high-power field. Mean±SD.n=3. *P<0.05 vs control.
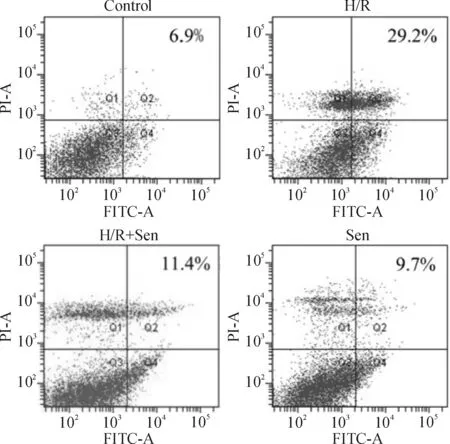
Figure 3. Effect of miR-16 on the apoptosis of RASFs.
5 miR-16对RASFs中炎症因子的影响
与对照组相比,miR-16 mimic可明显降低RASFs中IL-1β mRNA的水平,同时伴随其蛋白表达水平的下调;而miR-16抑制剂则可显著提高IL-1β的表达水平,见图5。
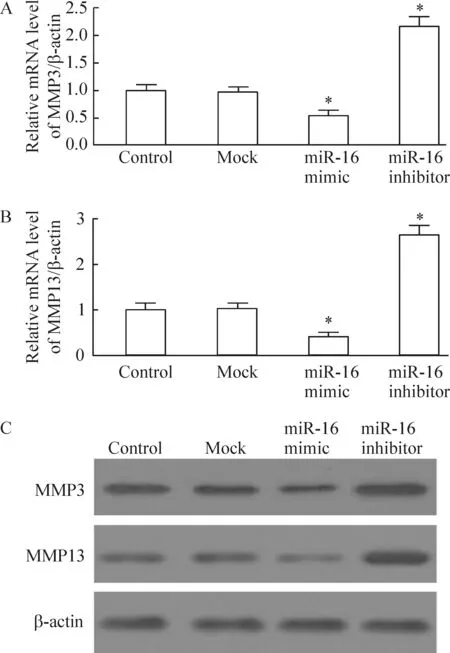
Figure 4. Effect of miR-16 on the levels of MMPs expression in RASFs.A: relative mRNA level of MMP-3; B: relative mRNA level of MMP-13; C: protein expression of MMP3 and MMP13. Mean±SD.n=3.*P<0.05 vs control.
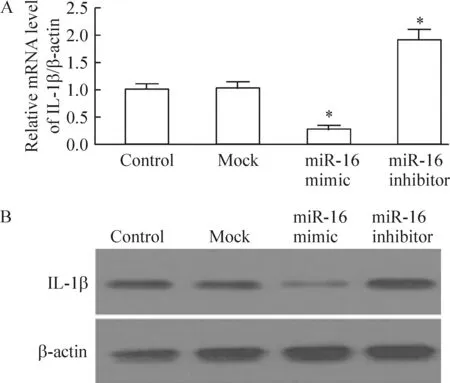
Figure 5. Effect of miR-16 on the mRNA (A) and protein (B) levels of IL-1β in RASFs.Mean±SD.n=3.*P<0.05 vs control.
讨 论
RA是一种以关节滑膜炎症为病理特征的自身免疫性疾病,研究显示RASFs的异常增生与RA的发生有着密切联系。而miRNAs是近年来发现的一类调控生物体基因表达的重要分子,参与多种免疫细胞的活化和分化过程[6]。有文献报道,与正常患者相比,RA患者血浆和滑膜液中miR-16浓度均显著上升,其值分别为1.3×103pmol/L和1.5×102pmol/L[7],提示miR-16可能在RA的病理进程中发挥重要作用。研究表明,多种miRNAs对RASFs增殖、侵袭均有影响。张晓萍等[8]发现miR-146a转染可显著抑制RASFs的增殖;Long等[9]发现miR-155也可抑制RASFs的增殖和侵袭。与上述研究结果相一致,本研究结果表明,miR-16 mimic能显著抑制体外培养RASFs的增殖和侵袭,而miR-16抑制剂则可显著促进RASFs的增殖和侵袭。提示miR-16通过抑制RASFs的增殖和侵袭从而缓解RA的发生。在骨肉瘤中,miR-16 通过靶向胰岛素样生长因子1受体抑制骨肉瘤细胞的增殖[10];在非小细胞肺癌中,miR-16 通过靶向肝癌衍生生长因子抑制肿瘤细胞的增殖和侵袭[11]。我们推测在RASFs增殖、侵袭过程中,miR-16可能通过抑制某一靶基因的表达进而抑制RASFs增殖、侵袭,但miR-16在RASFs中调控靶基因还需要进一步研究。此外,细胞凋亡实验表明miR-16对RASFs的凋亡没有显著影响,提示miR-16抑制RASFs的增殖并不是通过影响细胞凋亡实现的。
MMPs是一族锌离子依赖性的内源性蛋白水解酶,它能降解细胞外基质蛋白,直接降解软骨和骨质,从而造成RA病理过程中的骨质疏松和关节破坏[12]。MMPs家族中MMP3/13是导致软骨降解的蛋白酶,其对RA的破坏作用主要在于软骨活化后可导致软骨连结蛋白、纤维连接素以及多种胶原酶等蛋白酶的降解[13]。本研究发现,miR-16 mimic可下调RASFs中MMP3及MMP13的表达水平,而miR-16抑制剂可上调RASFs中MMP3及MMP13的表达。有文献报道,MMP的表达水平与RASFs的增殖和侵袭有着密切联系[14]。因此,我们推测miR-16可能通过下调MMP3及MMP13的表达水平来抑制RASFs的增殖和侵袭。
TNF-α和IL-1β在RA发病中起着关键作用,这2种细胞因子通过刺激RASFs增生,分泌IL-6、趋化因子以及基质蛋白酶和前列腺素等效应分子,从而造成关节损害[15]。有文献报道,miR-155可能通过抑制miR-155靶基因的表达,进而抑制RASFs增殖及IL-1β等炎症细胞因子的分泌,从而发挥抑制RA滑膜炎症的作用[8]。在本研究中,我们发现miR-16 mimic可下调RASFs中IL-1β的表达水平,而miR-16抑制剂可上调RASFs中IL-1β的表达。核转录因子κB(nuclear factor kappa B,NF-κB)活化可增加IL-1的表达水平,从而促进软骨细胞和滑膜细胞中MMPs和前列腺素PGE2的产生,进而抑制IV型胶原及蛋白多糖的合成,还可调控软骨结构蛋白的表达[16],因此,我们推测miR-16可能是通过抑制NF-κB的表达抑制RASFs增殖、侵袭及炎症细胞因子的分泌。
综上所述,miR-16在RA的发病中起着重要作用,除了抑制RASFs的增殖、侵袭外,还可抑制MMP3/13以及IL-1β的表达,但其具体机制还有待进一步研究。
[参 考 文 献]
[1] Isozaki T, Rabquer BJ, Ruth JH, et al. ADAM-10 is overexpressed in rheumatoid arthritis synovial tissue and mediates angiogenesis[J]. Arthritis Rheum, 2013, 65 (1): 98-108.
[2]HuberLC,DistlerO,TarnerI,etal.Synovialfibroblasts:keyplayersinrheumatoidarthritis[J].Rheumato-logy(Oxford),2006,45(6):669-675.
[3] Stanczyk J, Ospelt C, Karouzakis E, et al. Altered expression of microRNA-203 in rheumatoid arthritis synovial fibroblasts and its role in fibroblast activation[J]. Arthritis Rheum, 2011, 63(2):373-381.
[4]NidererF,TrenkmannM,OspeltC,etal.Down-regulationofmicroRNA-34ainrheumatoidarthritissynovialfibroblastspromotesapoptosisresistance[J].ArthritisRheum, 2012, 64(6):1771-1779.
[5] Furer V, Greenberg JD, Attur M, et al. The role of microRNA in rheumatoid arthritis and other autoimmune diseases[J]. Clin Immunol, 2010, 136(1):1-15.
[6]Duroux-RichardI,PresumeyJ,CourtiesG,etal.MicroRNAsasnewplayerinrheumatoidarthritis[J].JointBoneSpine, 2011, 78(1):17-22.
[7] Murata K, Yoshitomi H, Tanida S, et al. Plasma and synovial fluid microRNAs as potential biomarkers of rheumatoid arthritis and osteoarthritis[J]. Arthritis Res Ther, 2010, 12(3):R86.
[8] 张晓萍, 李 茹, 王世瑶, 等. 微小RNA-146a对类风湿关节炎患者滑膜成纤维细胞抑制作用的研究 [J]. 中华风湿病学杂志, 2010, 14(4): 220-222.
[9] Long L, Yu P, Liu Y, et al. Upregulated microRNA-155 expression in peripheral blood mononuclear cells and fibroblast-like synoviocytes in rheumatoid arthritis [J]. Clin Dev Immunol, 2013, 2013: 296139.
[10]ChenL,WangQ,WangGD,etal.miR-16inhibitscellproliferationbytargetingIGF1RandtheRaf1-MEK1/2-ERK1/2pathwayinosteosarcoma[J].FEBSLett, 2013, 587(9): 1366-1372.
[11] Ke Y, Zhao W, Xiong J, et al. Downregulation of miR-16 promotes growth and motility by targeting HDGF in non-small cell lung cancer cells [J]. FEBS Lett, 2013, 587(18): 3153-3157.
[12]BlasioliDJ,MatthewsGL,KaplanDL,etal.ThedegradationofchondrogenicpelletsusingcoculturesofsynovialfibroblastsandU937cells[J].Biomaterials, 2014, 35(4):1185-1191.
[13] Yoon HY, Lee EG, Lee H, et al. Kaempferol inhibits IL-1β-induced proliferation of rheumatoid arthritis synovial fibroblasts and the production of COX-2, PGE2and MMPs[J]. Int J Mol Med, 2013, 32(4):971-977.
[14]TolboomT,PietermanE,VanderLaanW,etal.Invasivepropertiesoffibroblast-likesynoviocytes:correlationwithgrowthcharacteristicsandexpressionofMMP-1,MMP-3,andMMP-10[J].AnnRheumDise, 2002, 61(11):975-980.
[15] Hu W, Xia LJ, Chen FH, et al. Recombinant human endostatin inhibits adjuvant arthritis by down-regulating VEGF expression and suppression of TNF-α, IL-1β production [J]. Inflamm Res, 2012, 61(8):827-835.
[16]PelletierJP,Martel-PelletierJ,AbramsonSB.Osteoarthritis,aninflammatorydisease:potentialimplicationfortheselectionofnewtherapeutictargets[J].ArthritisRheum, 2001, 44(6): 1237-1247.

