周络通提取物Z-6对高糖所致Schwann细胞损伤和PI3K/Akt/nNOS通路的影响*
梁俊清, 徐海波, 陈 檬, 王志鑫, 徐明远, 姚 兵, 李文燕, 李辉欣, 侯 斌, 宋燕飞, 王 娜, 庞 洁
(1北京以岭药业有限公司,北京 102600; 2承德医学院附属医院,河北 承德 067000)
糖尿病周围神经病变(diabeticperipheralneuro-pathy,DPN)是糖尿病最常见和最复杂的并发症,是导致足溃疡、感染以致坏疽截肢的主要危险因素,已成为糖尿病患者丧失劳动能力的主要原因之一[1]。目前对DPN仍无特效的治疗方法,虽然中医药治疗DPN有较多报道,但其药效物质基础和作用机理研究不够深入,目前国内尚缺乏治疗该病疗效确切特别是具有创新理论指导的中成药。中药周络通(Zhouluotong,ZLT)胶囊的研制开辟了应用络病理论治疗DPN的有效新途径[2-3]。本研究利用体外细胞水平的筛选技术筛选复方中发挥药理作用的主要有效部位,并探讨PI3K/Akt/nNOS信号通路在其改善糖尿病周围神经病变中的作用。
材 料 和 方 法
1 细胞株
雪旺氏细胞(Schwann cells),购于中国科学院细胞库。
2 主要试剂
DMEM培养基、胎牛血清(Gibco);周络通及其提取物Z-5、Z-6(石家庄以岭药业股份有限公司);甲钴胺对照品(中国食品药品检定所);CCK-8检测试剂盒(日本同仁化工所);神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)、Bcl-2、Bcl-xL、Bax、Bak和caspase-3及磷酸化Akt 抗体(CST);磷酸化nNOS抗体(Abcam);荧光Ⅱ抗(LiCor);Ca2+-ATPase试剂盒及NO测定试剂盒(南京建成生物工程研究所);细胞凋亡检测试剂盒(凯基生物);FuGENE® HD Transfection Reagent转染试剂盒(Promega)。
3 主要方法
3.1配制高糖培养基 称取一定量的D-葡萄糖溶解于无血清DMEM培养基中(含0.1% 胎牛血清),终浓度为100 mmol/L。用0.22 μm微孔滤器过滤除菌。
3.2配制周络通及其提取物Z-5、Z-6贮存液 称取一定量的周络通溶解于无血清DMEM培养基中,超声促溶1 h, 6 500×g离心10 min, 收集上清液,用0.22 μm微孔滤器过滤除菌。将周络通药物充分溶于水提取后得到的组分用不同浓度的乙醇抽提,得到不同的药物组分。其中Z-5是由75%乙醇抽提得到的活性部位,Z-6是由95%乙醇提取得到的活性部位。将2种提取物分别溶解于无血清DMEM培养基中,超声促溶1 h,6 500×g离心10 min,收集上清液,应用0.22 μm微孔滤器过滤除菌。实验前利用无血清DMEM培养基分别稀释成相应浓度的工作液(含0.1%胎牛血清)。
3.3细胞的增殖率及存活率 常规培养待细胞贴壁后,换用含不同浓度Z-5、Z-6提取物的高糖培养基(100mmol/LD-葡萄糖),培养48h后,测定细胞活力。采用CCK-8检测试剂盒检测,操作严格按照说明书进行。
3.4细胞内Ca2+-ATP ase活性测定 根据细胞存活率的测定结果,各组均选取5 mg/L的药物干预浓度进行Ca2+-ATPase活性及后续指标的测定。采用6 cm培养皿进行实验,胰酶消化细胞后,收集细胞悬液,经超声破碎仪冰浴破碎,制备样品液,采用Ca2+-ATPase试剂盒测定样品酶活性。
3.5细胞凋亡百分率的测定 收集各组细胞,生理盐水清洗2遍,待收集细胞后使用500μLbindingbuffer重悬,分别加入5μLAnnexinV-FITC和5μLpropidiumiodide,混匀,室温避光反应20min,以流式细胞仪(EPICSELITEESP)分析凋亡细胞百分比。
3.6nNOS、 Bcl-2、 Bcl-xL 、 Bax、 Bak和caspase-3及磷酸化Akt表达的测定 采用Western blotting方法检测目的蛋白的表达,将生长良好的雪旺氏细胞以5×105/well接种于6孔培养板,37 ℃进行培养。待细胞生长至70%~80%铺满时,以含0.1% FBS的含药DMEM继续培养48 h。处理的细胞及对照细胞经预冷的PBS洗涤后,用细胞裂解液于4 ℃裂解5 min。将全细胞裂解产物经间隔2 s超声10次后进行蛋白定量。取30 μg蛋白进行SDS-PAGE并转印至硝酸纤维素膜上,用nNOS、 Bcl-2、 Bcl-xL 、 Bax、 Bak和caspase-3及磷酸化Akt相应的特异性Ⅰ抗进行孵育后,加入相应的荧光Ⅱ抗并用Odyssey 蛋白印迹分析仪检测目的蛋白。
3.7显性负性突变体瞬时转染 将生长良好的雪旺氏细胞(购于中国科学院细胞库)以5×105cells/well接种于6cm培养皿中,在37 ℃、 5%CO2培养箱中培养至80%~90%铺满时,按FuGENE®HDTransfectionReagent转染试剂盒(Promega,E2311)的说明书以5μgδp85或DN-Akt分别进行转染,常规培养24h进行实验。
3.8NO含量的测定 将生长良好的雪旺氏细胞和转染有突变体的细胞以1×105cells/well接种于96孔培养板,37 ℃进行培养。待细胞生长至70%~80%铺满时,以含0.1% FBS的含药DMEM继续培养48 h,取各组细胞培养上清按照NO测定试剂盒说明书测定各上清中NO的含量。
4 统计学处理
采用SPSS 11.5分析软件进行统计学分析。数据以均数±标准差(mean±SD)表示。各组间均数比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 周络通及其提取物对雪旺细胞生存活性的影响
与正常组细胞相比,高糖模型组细胞存活率显著降低,突触缩短,细胞呈圆形。给予高糖损伤的雪旺细胞以不同药物浓度的Z-5、Z-6和周络通干预,周络通及其提取物Z-5对细胞生存活性的影响不明显。与模型组相比,Z-6组在5 mg/L和10 mg/L两个浓度时,细胞存活率显著升高,突触增长,细胞联络呈网状,说明周络通提取物Z-6能促进高糖损伤雪旺细胞的增殖发育,见图1。
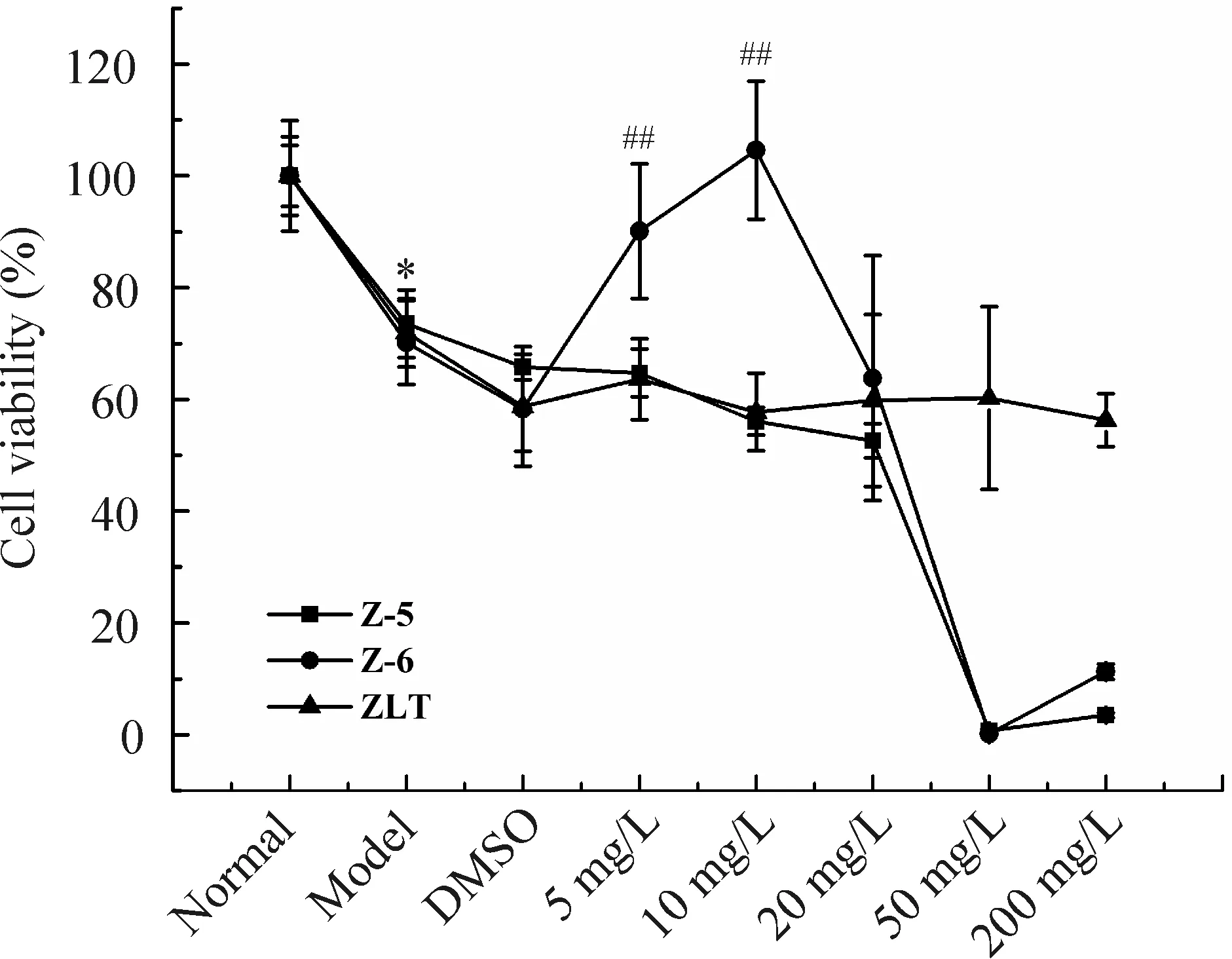
Figure 1. The relative survival rates of Schwann cells cultured with Zhouluotong and its extracts, Z-5 and Z-6, at different concentrations. Mean±SD. n=3.*P<0.05 vs normal; ##P<0.01 vs model.
2 周络通及其提取物对高糖损伤的雪旺细胞Ca2+-ATPase活性的影响
与正常组(6.24% ± 0.55%)相比,模型组(3.95% ± 0.81%)细胞的Ca2+-ATPase活性显著降低。与模型组相比,周络通及其提取物Z-5组Ca2+-ATPase活性较模型组细胞略有下降,而Z-6组Ca2+-ATPase活性显著升高,远高于阳性药甲钴胺(mecoalamine,Meco)组,见图2。

Figure 2. Effect of Zhouluotong and its extracts, Z-5 and Z-6, on the activity of Ca2+-ATPase. Mean±SD. n=3. **P<0.01 vs normal; #P<0.05 vs model.
3 周络通提取物Z-6对高糖损伤的雪旺细胞凋亡率的影响
高糖损伤72 h后检测细胞凋亡率,结果显示,与正常组相比,模型组细胞凋亡率显著升高,与模型组相比,周络通提取物Z-6组细胞凋亡率降低至正常水平以下,且Z-6作用明显优于周络通组和甲钴胺组,见图3。
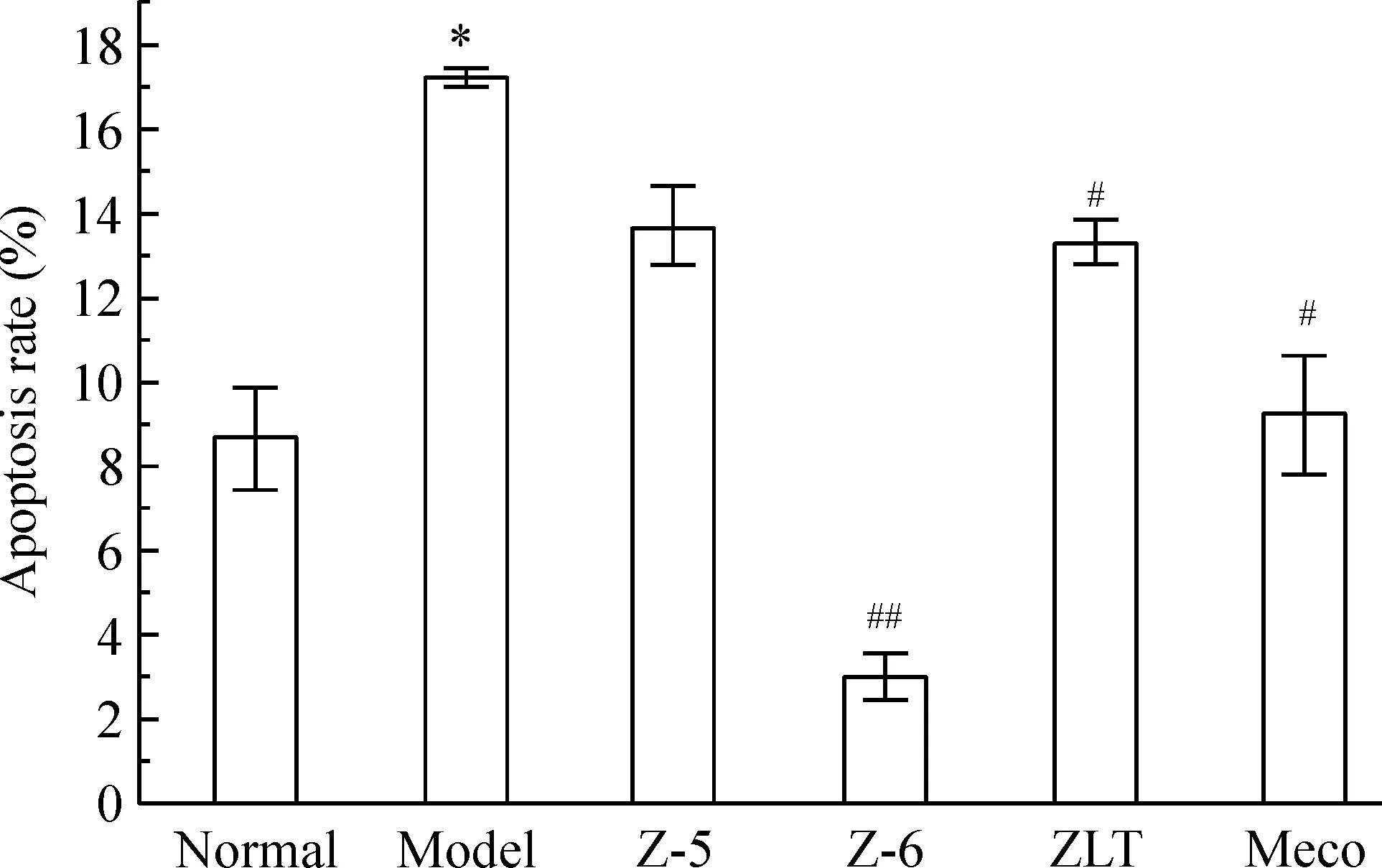
Figure 3. Effect of Zhouluotong and its extracts, Z-5 and Z-6, on the apoptosis of high-glucose damaged Schwann cells. Mean±SD. n=3. *P<0.05 vs normal; #P<0.05, ##P<0.01 vs model.
4 周络通提取物Z-6对各组细胞nNOS和Akt蛋白磷酸化水平的影响
与正常组比较,模型组细胞的p-nNOS(S1417)和p-Akt表达均显著降低,Z-6组、ZLT组和Meco组的p-Akt和p-nNOS(S1417)均有不同程度的升高。而各组间Akt1/2/3和nNOS表达无明显差异,见图4。
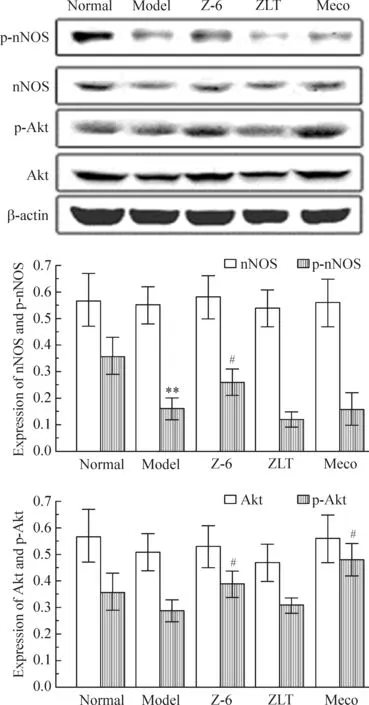
Figure 4. Effects of Zhouluotong extract Z-6 on nNOS and Akt phosphorylation in Schwann cells. Mean±SD. n=3.**P< 0.01 vs normal; #P<0.05 vs model.
5 周络通及其提取物对各组细胞Bcl-2、Bcl-xL、Bax、 Bak、Cyt C 和caspase-3蛋白表达的影响
结果显示,与模型组相比,周络通提取物Z-6组抗凋亡蛋白Bcl-2和Bcl-xL的表达显著升高(P<0.01),同时促凋亡相关蛋白Bax、Bak、Cyt C和caspase-3(P<0.01)的表达水平降低,见图5。
6 周络通提取物Z-6对雪旺细胞分泌NO含量的影响
结果显示,与模型组相比,Z-6组NO水平显著升高,采用PI3K的突变体δp85 瞬时转染Schwann细胞后,Z-6组Schwann细胞产生NO的量明显减少,见图6。
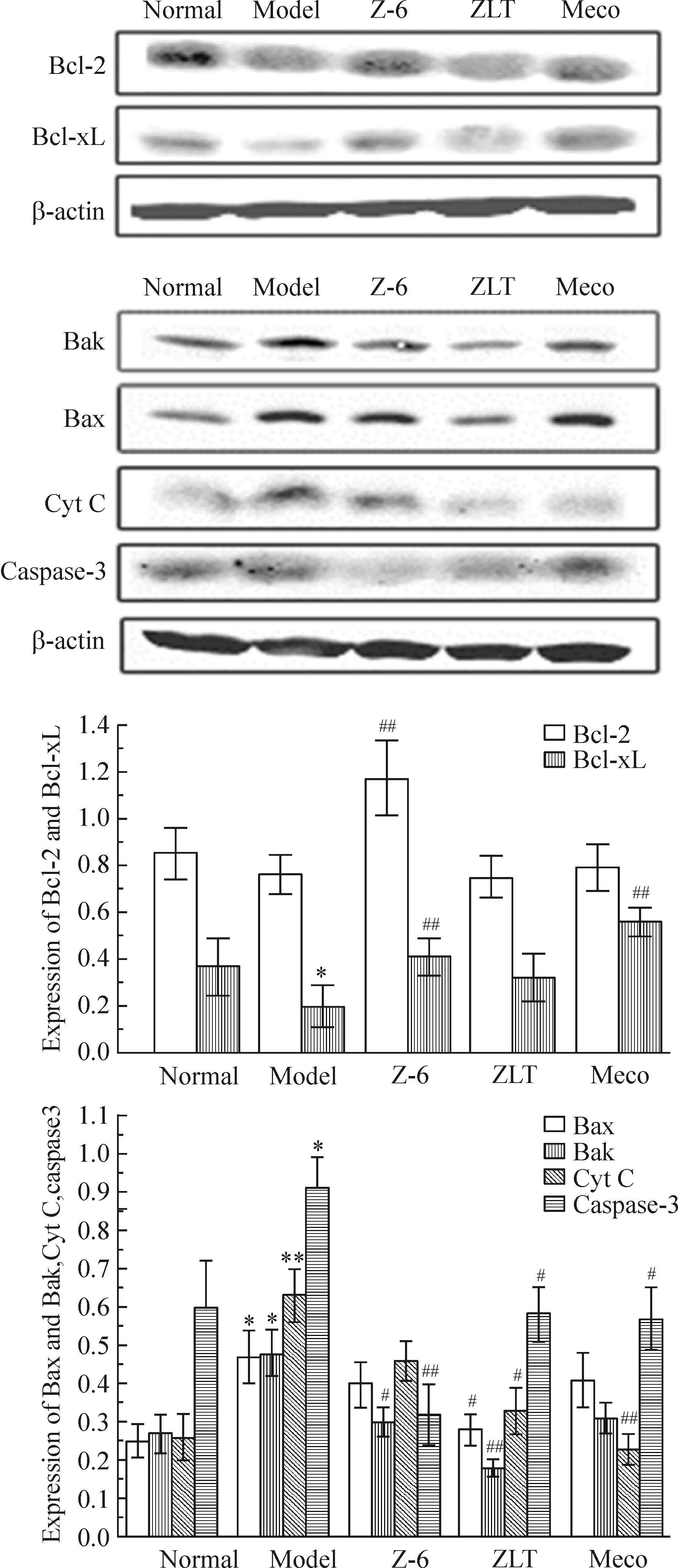
Figure 5. Effects of Zhouluotong extract Z-6 on expression of Bcl-2, Bcl-xL, Bax, Bak, Cyt C and caspase-3. Mean±SD. n=3. *P<0.05, **P<0.01 vs normal; #P<0.05, ##P<0.01 vs model.

Figure 6. Effect of Zhouluotong extract Z-6 on the secretion of nitric oxide in high glucose-damaged Schwann cells and the Schwann cells transfected with δp85. Mean±SD.n=3.*P<0.05 vs normal; ##P<0.01 vs model.
7 PI3K/Akt信号通路对周络通提取物上调p-nNOS蛋白表达的影响
与正常组比较,Z-6组、ZLT组和Meco组细胞内p-Akt及p-nNOS(S1417)的蛋白水平无显著差异。采用PI3K的突变体δp85及Akt的突变体DN-Akt瞬时转染Schwann细胞后,Z-6组p-Akt及p-nNOS的水平与正常组相比无显著差异,见图7。
讨 论
中药复方周络通由黄芪、桂枝、当归、生地、细辛等十二味中药组成,具有通络祛痰止痛的功效,在临床应用中发现,其对糖尿病周围神经病变具有较为显著的治疗作用[4],本研究试图利用周围神经胶质细胞Schwann细胞深入研究周络通活性组分的作用靶点及其与PI3K/Akt之间的关系。
PI3K/Akt信号通路参与调控糖和脂质的代谢,是经典的细胞存活通路,调控细胞的凋亡与增殖[5]。许多研究证实,神经元细胞的凋亡是诱发糖尿病周围神经病变的关键因素,而PI3K/Akt信号通路中Akt能够调控caspase家族的磷酸化达到控制凋亡的作用[6]。例如,胰岛素样生长因子I是已证实的主要通过PI3K/Akt信号通路发挥作用,而它可以显著抑制caspase-9和caspase-3前体的剪切活化从而抑制高糖影响下细胞的凋亡[7]。
本实验中采用高浓度葡萄糖损伤大鼠雪旺细胞模拟建立糖尿病周围神经病变细胞模型[8],发现细胞凋亡率显著升高,同时伴有caspase-3活化。加入周络通提取物Z-6后,改善了细胞生存状态,细胞突触增长、细胞间联络呈网状;而周络通及其提取物Z-5细胞生存状态的改变则不甚明显。进一步研究发现,周络通提取物Z-6通过提高Bcl-2、Bcl-xL抗凋亡蛋白,降低Bax、Bad等凋亡蛋白表达,减少细胞色素C释放,降低了高糖损伤引起的细胞凋亡。

Figure 7. Effects of PI3K/Akt pathway on the p-nNOS and p-Akt up-regulation caused by Z-6. Mean±SD. n=3.
在后续实验中,我们利用PI3K的显性负性突变体(δp85)或Akt的显性负性突变体(DN-Akt)阻断nNOS的上游信号通路后,虽未证实周络通提取物Z-6与PI3K/Akt信号通路的确切关系,但已知PI3K/Akt信号通路能够通过产生神经生长因子、磷酸化caspase、p53蛋白等方式抑制神经细胞凋亡[9],周络通提取物Z-6可能通过促进Akt的磷酸化,进而保护Schwann细胞免受高糖的损伤。
另一方面,在周围神经系统中,NO与周围神经的功能也有密切的关系[10-12]。例如,神经电生理研究发现NOS抑制剂可以调节坐骨神经损伤后传向神经根背侧神经节的神经冲动。神经系统中NO的含量变化主要受nNOS的磷酸化与去磷酸化调控的[13]。有研究表明,nNOS的活化主要通过胞内Ca2+的调控和Akt的磷酸化两条途径[14]。在实验中我们发现磷酸化的Akt和nNOS的含量变化不论是在模型组还是各个给药组均呈正相关,更加印证了PI3K/Akt/nNOS这一通路中各分子的相关性[15]。
综上所述,周络通各提取物中Z-6组分对高糖环境中神经细胞有较好的保护作用。Z-6组分对PI3K/Akt信号通路调节nNOS和Akt的磷酸化的影响和机制有待进一步深入研究。
[参 考 文 献]
[1]PremkumarLS,PabbidiRM.Diabeticperipheralneuropathy:roleofreactiveoxygenandnitrogenspecies[J].CellBiochemBiophys, 2013, 67(2):373-383.
[2] 张会欣, 王 超, 朱慧明, 等. 周络通胶囊激活转录因子Nrf2抑制糖尿病周围神经病变小鼠氧化应激[J]. 中国药理学通报, 2013, 29(1):136-139.
[3] 张会欣, 魏 刚, 王宏涛, 等. 周络通胶囊对糖尿病周围神经病变小鼠坐骨神经糖基化终末产物及受体的影响[J]. 中国实验方剂学杂志, 2012, 18(23):168-172.
[4] 封卫毅, 侯家玉, 陈 伟, 等. 周络通对糖尿病大鼠坐骨神经功能、醛糖还原酶活性及抗自由基能力的影响[J].北京中医药大学学报, 2004, 27(1):45-48.
[5]GaoJ,LiJ,AnY,etal.IncreasingeffectofTangzhiqingformulaonIRS-1-dependentPI3K/AKTsignalinginmuscle[J].BMCComplementAlternMed, 2014, 14:198.
[6] Yang RH, Lin J, Hou XH, et al. Effect of docosahexae-noic acid hippocampal neurons in high-glucose condition:involvement of PI-3K/Akt/nuclear factor-κB-mediated inflammatory pathways[J]. Neuroscience, 2014, 274: 218-228.
[7]LeinningerGM,BackusC,UhlerMD,etal.Phosphatidylinositol3-kinaseandAkteffectorsmediateinsulin-likegrowthfactor-Ineuroprotectionindorsalrootganglianeurons[J].FASEBJ, 2004, 18(13):1544-1546.
[8] 施 君, 张文川. 糖尿病周围神经病变发病机制的研究进展[J]. 上海交通大学学报:医学版, 2012, 32(1):116-119.
[9] 杨 帆, 周其全.PI3K/Akt信号通路与神经保护 [J]. 国际脑血管病杂志, 2013, 21(2):143-147.
[10] 李 爽, 徐春阳, 李东亮. 急性乙醇中毒大鼠学习记忆行为的改变与脑组织NO和nNOS含量变化[J]. 中国病理生理杂志, 2008, 24(1):32-35.
[11] 阎作勤,陈峥嵘. 一氧化氮合成酶在周围神经的表达[J]. 中华手外科杂志, 2000, 16(3): 175-177.
[12] 段文娟, 卫涛涛. 神经型一氧化氮合酶的活性调节[J]. 生物物理学报, 2012, 28(4):278-286.
[13]VareniukI,PavlovIA,ObrosovaIG.Induciblenitricoxidesynthasegenedeficiencycounteractsmultiplemanifestationsofperipheralneuropathyinastreptozotocininducedmousemdelofdiabetes[J].Diabetologia, 2008, 51(11):2126-2133.
[14] Rameau GA, Tukey DS, Garcin-Hosfield ED. Biphasic coupling of neuronal nitric oxide synthase phosphorylation to the NMDA receptor regulates AMPA receptor trafficking and neuronal cell death[J]. J Neuroscience, 2007, 27(13):3445-3455.
[15]El-MasMM,FanM,Abdel-RahmanAA,etal.FacilitationofmyocardialPI3K/Akt/nNOSsignalingcontributestoethanol-evokedhypotensioninfemalerats[J].AlcoholClinExpRes, 2009, 33(7):1158-1168.

