辣椒素对脂多糖诱导血管内皮细胞活化的影响及机制*
卢 阳, 赵光举, 洪广亮, 邱俏檬, 李 冬, 卢中秋△
(温州医科大学 1附属第一医院急诊医学中心, 2 温州市第三临床学院风湿免疫科,浙江 温州 325000)
脓毒症是由感染引起的全身炎症反应综合征,可进一步发展为脓毒性休克及多器官功能障碍综合征,病死率居高不下。在脓毒症致病过程中,脂多糖(lipopolysaccharide,LPS)能够上调血管内皮细胞(vascular endothelial cells,VECs)NF-κB的表达和活化水平,导致内皮细胞过度、持久及广泛的活化,是导致循环衰竭和组织器官损伤的关键环节[1]。辣椒素(capsaicin, CAP)具有抗炎、抗氧化、镇痛等广泛的药理作用。新近研究发现,辣椒素对NF-κB的表达和活化水平具有重要影响,提示其在脓毒症内皮细胞损伤中可能极具应用价值[2]。有鉴于此,本项目拟通过研究辣椒素对内毒素诱导血管内皮细胞活化的影响和机制,为其在脓毒症中的应用提供理论依据。
材 料 和 方 法
1 动物
清洁级ICR小鼠45只,雄性,体重18~22 g,由温州医科大学动物中心提供。原代培养的内皮细胞从小鼠主动脉中分离获取,连续传至3代。
2 主要试剂
DMEM/F12培养基、胎牛血清以及胰蛋白酶购自Gibco;LPS和CAP(以0.1% DMSO溶解后备用)购自Sigma; von Willebrand 因子(von Willebrand factor, vWF)兔单克隆抗体、NF-κB p65兔多克隆抗体和TATA框结合蛋白(TATA-box-binding protein,TBP)兔多克隆抗体均由Abcam提供;p-IκBα和IκBα兔单克隆抗体由Cell Signaling Technology提供;β-actin兔多克隆抗体以及细胞核蛋白和细胞浆蛋白提取试剂盒均购自中国南京Bioworld 生物公司;RIPA裂解液(强)和BCA蛋白浓度测定试剂盒(增强型)均购自中国碧云天生物技术研究所;可溶性细胞间黏附分子1 (soluble intercellular adhesion molecule 1,sICAM-1)、可溶性血管细胞黏附分子1(soluble vascular adhesion molecule 1, sVCAM-1)和可溶性P-选择素 (soluble P-selectin, sP-selectin)ELISA试剂盒购自R&D Systems,上海西唐生物科技有限公司进口分装。
3 方法
3.1血管内皮细胞提取培养和鉴定 处死清洁级健康ICR小鼠,分离主动脉并切成1.5 mm×1.5 mm小块后放入不含胶原酶的6孔板,于贴壁4 h后加入含20%胎牛血清的DMEM/F12完全培养基,培养3 d后去除组织块,每2 d更换培养基,至细胞融合成单层铺满孔底90%以上进行传代培养。传代过程中以0.125%胰蛋白酶消化,2~3 min后,轻轻吹打,传代至1%明胶预先处理的培养瓶,传代分瓶比例为1∶2。内皮细胞鉴定采用Ⅷ因子相关抗原(即vWF)免疫荧光检测,阳性信号为绿色荧光。
3.2分组及处理 取第3代内皮细胞,细胞接种于24孔培养板(5×107cells/L,1mL/well)培养12h后去除完全培养基,分为正常组、溶剂对照组、LPS组和LPS+CAP组。其中正常组只加完全培养基;溶剂对照组用与CAP等体积的0.1%DMSO刺激;LPS组用与CAP等体积的0.1%DMSO及100μg/LLPS刺激;LPS+CAP组用100μg/LLPS及不同浓度CAP(50μmol/L、100μmol/L和200μmol/L)同时刺激。分别于刺激后12h、24h和48h留取细胞及上清液备用。
3.3ELISA 取各组的细胞上清液,采用ELISA法检测上清液中sICAM-1、sVCAM-1和sP-selectin,严格按照试剂盒说明书操作。
3.4核蛋白以及胞浆蛋白提取 1 000×g离心5min,收集细胞,用预冷的PBS冲洗2次,吸取上清,加入预冷的细胞浆蛋白提取试剂A和蛋白酶抑制剂,高速漩涡振荡15s,置冰上10min。加入预冷的细胞浆蛋白提取试剂B后再次高速漩涡振荡5s,然后4 ℃、12 000×g离心10min,上清即为胞浆蛋白,吸去上清后在沉淀中加入预冷的细胞核蛋白提取试剂和蛋白酶抑制剂,高速漩涡振荡15s,置冰上40min,每隔10min高速漩涡振荡15s,4 ℃、12 000×g离心10min,将上清吸入另一离心管,即可得到核蛋白,BCA蛋白浓度测定试剂盒检测蛋白浓度,-20 ℃保存。
3.5Western blotting 蛋白上样前加5×上样缓冲液并煮沸5 min,蛋白上样量为40 μg;配制10%分离胶和4%浓缩胶(聚丙烯酰胺凝胶);在浓缩胶中90 V,分离胶中110 V电泳;湿式电泳仪转膜300 mA、60 min;5%脱脂牛奶室温下封闭1 h;Ⅰ抗和内参照抗体4 ℃孵育16 h;辣根过氧化物酶标记山羊抗兔抗体室温下孵育1 h;洗膜后ECL试剂盒显色;曝光成像。Quantity One分析软件进行灰度值分析,用同一目的蛋白与内参照灰度比值得出此目的蛋白的相对含量。
4 统计学处理
用SPSS 16.0统计软件分析。数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 小鼠主动脉血管内皮细胞的培养和鉴定
原代主动脉血管内皮细胞单层排列,细胞边界清楚,呈扁平短梭形或多角形,细胞团块中间较密,周边细胞多为长梭形并游离向外生长,细胞成铺路石样排列,见图1A。vWF免疫荧光检查:可见细胞质激发出绿色荧光, 即呈阳性反应,表明vWF存在,证明培养的细胞为内皮细胞,见图1B。
2 辣椒素对内毒素作用后sP-selectin水平的影响
与对照组相比,内毒素组内皮细胞的sP-selectin显著升高(P<0.05),且随着时间的变化 sP-selectin逐渐升高,LPS可以时间依赖性地上调 sP-selectin水平;与内毒素组相比,50 μmol/L、100 μmol/L和200 μmol/L辣椒素干预组sP-selectin水平显著降低(P<0.05),且随着辣椒素浓度增加,细胞上清液中sP-selectin逐渐降低,见表1。
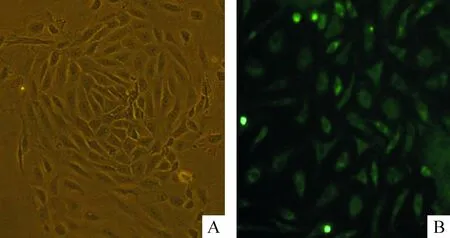
Figure 1. Cultured endothelial cells of mouse aorta observed under microscope (A;×100) and identified by von Willebrand factor immunofluorescence staining (B;×200).
3 辣椒素对内毒素作用后血管内皮细胞sVCAM-1水平的影响
与对照组相比,内毒素组内皮细胞的sVCAM-1显著升高(P<0.05),且随着时间的变化,sVCAM-1水平逐渐升高;与内毒素组相比,50 μmol/L、100 μmol/L和200 μmol/L辣椒素干预组细胞上清液sVCAM-1含量显著降低(P<0.05),见表2。
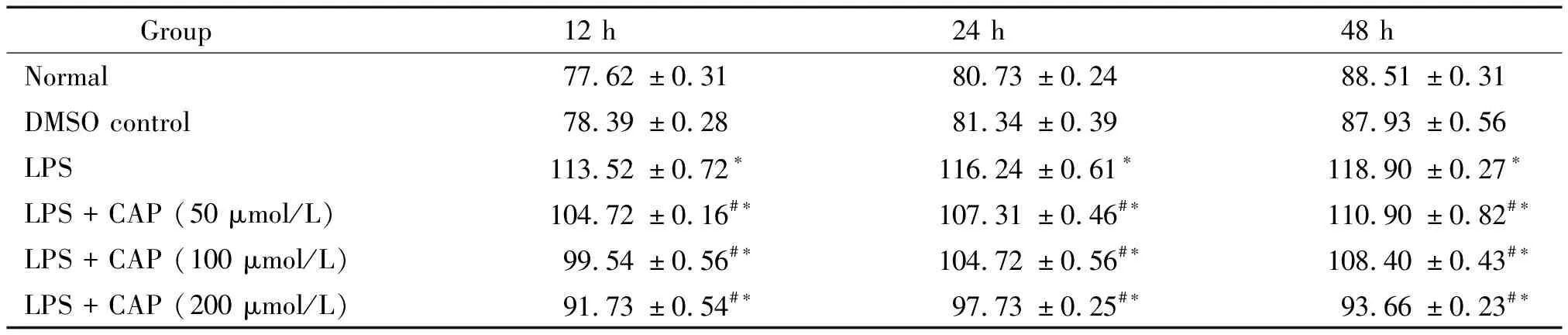
表1 辣椒素对内毒素作用后可溶性P-选择素水平的影响
*P<0.05vsDMSO control;#P<0.05vsLPS.

表2 辣椒素对内毒素作用后可溶性ICAM-1水平的影响
*P<0.05vsDMSO control;#P<0.05vsLPS.
4 辣椒素对内毒素作用后血管内皮细胞sICAM-1水平的影响
与对照组相比,内毒素组内皮细胞的sICAM-1显著升高(P<0.05),且随着时间的变化,sICAM-1的水平逐渐升高;与内毒素组相比,50 μmol/L、100 μmol/L和200 μmol/L辣椒素干预组细胞上清液sICAM-1含量显著降低(P<0.05),见表3。

表3 辣椒素对内毒素作用后可溶性VCAM-1水平的影响
*P<0.05vsDMSO control;#P<0.05vsLPS.
5 辣椒素对内毒素作用后血管内皮细胞核内NF-κB p65蛋白和胞浆p-IκBα、IκBα蛋白表达的影响
与对照组相比,LPS组细胞核内NF-κB p65蛋白和p-IκBα蛋白水平显著升高(P<0.05),LPS组胞浆IκBα蛋白水平显著降低(P<0.05)。与LPS组相比,50 μmol/L、100 μmol/L和200 μmol/L辣椒素干预组内皮细胞胞核内NF-κB p65和p-IκBα蛋白的表达均有下降,IκBα蛋白表达水平均有升高,其中100 μmol/L和200 μmol/L组显著差异(P<0.05),见图2。
讨 论
在脓毒症致病过程中,炎症介质(LPS、TNF-α等)能够诱导血管内皮细胞活化,表现为黏附分子P-选择素、E-选择素、ICAM-1、VCAM-1等表达上调[3]。细胞表面的黏附分子脱落进入血液循环或细胞上清中即称为可溶性黏附分子。研究已经证实,sP-选择素、sVCAM-1及sICAM-1水平与血管内皮细胞活化状态密切相关,是细胞活化的重要标志分子[4-5]。黏附分子的上调可促进中性粒细胞、淋巴细胞等多种细胞与血管内皮细胞形成固定黏附,进而迁移进入组织并释放大量促炎因子、蛋白酶等,进一步加剧血管内皮细胞活化水平,最终导致组织器官损伤的发生[6]。本实验亦证实,LPS作用后,血管内皮细胞上清液中sP-selectin、sVCAM-1及sICAM-1水平显著增加,其中sVCAM-1和sICAM-1水平与LPS作用时间密切相关。因此,积极评估血管内皮细胞活化水平并对其进行有效干预,对于脓毒症的治疗无疑具有重要的价值。
辣椒素是辣椒中的主要辛辣部分,其通过结合辣椒素受体释放多种神经肽而具有抗炎、清除自由基、镇痛、保护胃黏膜及抗肿瘤等的作用,而其在血管保护中的作用越发受到重视[7]。据报道,辣椒素能够与血管内皮细胞表面辣椒素受体结合,激活活化蛋白激酶A,增加内皮一氧化氮合成酶的磷酸化和一氧化氮产生,从而改善血管舒张功能[8]。虽然有研究发现,辣椒素单独作用能够促进ECV304细胞中sICAM-1的表达[9],然而其对炎症状态下血管内皮细胞活化的影响尚不清楚。本实验研究发现,辣椒素能够剂量依赖性下调细胞上清液中sICAM-1、sVCAM-1和sP-selectin的水平,提示辣椒素对于血管内皮细胞活化具有重要的抑制作用,但其最佳剂量仍有待进一步阐明。

Figure 2. The effects of capsaicin (CAP) on the expression of nuclear NF-κB p65 and cytoplasmic p-IκBα and IκBα in the endothelial cells after lipopolysaccharide (LPS) stimulation for 24 h.N: normal; C: DMSO control; TBP: TATA-box-binding protein.Mean±SD.n=3.*P<0.05 vs C; #P<0.05 vs LPS.
众多转录因子参与了感染状态下宿主的反应,包括NF-κB、ESE-1、AP-1、GATA-2及Erg-1等,其中NF-κB发挥着关键性作用[10]。虽然已经证实,转染IκBα抑制NF-κB的活性能够显著提高脓毒症小鼠的生存率,但其作为内皮细胞保护的干预靶点近年来才得到关注[11]。Ye等[12]发现,特异性阻断内皮细胞NF-κB活化后,内毒素血症小鼠内皮细胞黏附分子的表达减低,组织器官损伤程度和死亡率也明显降低。一般而言,未活化的NF-κB以p65/p50的形式与IκBα存在于细胞浆内。当刺激发生后,IκBα发生磷酸化继而泛素化降解,使p65/p50与IκBα分离并从细胞浆转位进入核内发挥转录功能[13]。本研究发现,LPS刺激24 h后细胞核内NF-κB p65和胞浆内的p-IκBα的表达水平明显增高,但胞浆内的IκBα表达水平显著降低。辣椒素能够明显下调细胞核内NF-κB p65胞浆内p-IκBα的水平,升高IκBα表达水平,提示辣椒素对LPS诱导内皮细胞活化的抑制作用可能是通过阻断NF-κB向细胞核转位而实现的。
综上所述,血管内皮细胞活化是脓毒症致病过程中的关键环节。辣椒素能够有效抑制内毒素诱导的血管内皮细胞NF-κB细胞核转位,进而下调细胞的活化水平,提示其在脓毒症治疗中可能具有重要的应用价值。
[参 考 文 献]
[1] Ding J, Song D, Ye X, et al. A pivotal role of endothelial-specific NF-κB signaling in the pathogenesis of septic shock and septic vascular dysfunction[J]. J Immunol, 2009,183(6):4031-4038.
[2]HanSS,KeumYS,SeoHJ,etal.Capsaicinsuppressesphorbolester-inducedactivationofNF-kappaB/RelandAP-1transcriptionfactorsinmouseepidermis[J].CancerLett, 2001,164 (2):119-126.
[3] Ait-Oufella H, Maury E, Lehoux S, et al. The endothelium: physiological functions and role in microcirculatory failure during severe sepsis[J]. Intensive Care Med, 2010, 36(8):1286-1298.
[4]FrijnsCJ,KappelleLJ,vanGijnJ,etal.Solubleadhesionmoleculesreflectendothelialcellactivationinischemicstrokeandincarotidatherosclerosis[J].Stroke, 1997, 28(11):2214-2218.
[5] Videm V, Albrigtsen M. Soluble ICAM-1 and VCAM-1 as markers of endothelial activation[J]. Scand J Immunol, 2008, 67(5):523-531.
[6]ZhangC.Theroleofinflammatorycytokinesinendothelialdysfunction[J].BasicResCardiol, 2008,103(5):398-406.
[7] Min JK, Han KY, Kim EC, et al. Capsaicin inhibitsinvitroandinvivoangiogenesis[J]. Cancer Res, 2004, 64(2):644-651.
[8]YangD,LuoZ,MaS,etal.ActivationofTRPV1bydietarycapsaicinimprovesendothelium-dependentvasorelaxationandpreventshypertension[J].CellMetab, 2010, 12(2):130-141.
[9] Richeux F, Cascante M, Ennamany R, et al. Implications of oxidative stress and inflammatory process in the cytotoxicity of capsaicin in human endothelial cells: lack of DNA strand breakage[J]. Toxicology, 2000, 147(1):41-49.
[10]LiuSF,MalikAB.NF-kappaBactivationasapathologicalmechanismofsepticshockandinflammation[J].AmJPhysiolLungCellMolPhysiol, 2006, 290(4):L622-L645.
[11] Li Q, Verma IM. NF-kappaB regulation in the immune system[J].Nat Rev Immunol, 2002, 2(10):725-734.
[12]YeX,DingJ,ZhouX,etal.DivergentrolesofendothelialNF-kappaBinmultipleorganinjuryandbacterialclearanceinmousemodelsofsepsis[J].JExpMed, 2008, 205(6):1303-1315.
[13] Schlegel N, Leweke R, Meir M, et al. Role of NF-κB activation in LPS-induced endothelial barrier breakdown[J]. Histochem Cell Biol, 2012, 138(4):627-641.

