糖尿病患者与健康人脂蛋白单糖组成差异研究*
郭守东, 冯 蕾, 张 颖, 崔英杰, 秦树存
(泰山医学院山东省高校动脉粥样硬化重点实验室, 山东 泰安 271000)
近年研究显示,脂蛋白自身结构的改变是影响其功能的生物学机制之一,且脂蛋白自身结构改变而失去原有功能的现象在多种疾病中普遍存在[1-3]。脂蛋白糖基化修饰是最重要的蛋白质翻译后修饰之一,其对于维持脂蛋白的功能至关重要。有研究证实,脂蛋白的唾液酸化修饰,主要是指N-乙酰神经氨酸(N-acetylneuraminic acid, NANA)化修饰,以及半乳糖、甘露糖等糖基构成对维持脂蛋白的正常生理功能十分重要;另有研究显示,脂蛋白等的去唾液酸化与动脉粥样硬化等心血管病变的发生和发展密切相关[4-6]。因此,脂蛋白单糖组成的精确测定是探究脂蛋白糖基化修饰与脂蛋白功能的重要技术手段之一。
测定单糖组成的方法主要包括高效液相色谱法、气相色谱法和液相串联质谱法等。由于糖类紫外吸收很弱,为提高检测灵敏度,研究者常将糖复合物水解后采用柱前或柱后衍生化色谱法分离和检测。1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5- pyrazolone,PMP)柱前衍生化高效液相色谱法反应条件较温和,产物无立体异构,紫外检测灵敏度较高,可用于同时检测中性、酸性及碱性单糖。本文建立一种高效液相色谱法测定脂蛋白上的中性和碱性单糖的PMP柱前衍生方法,结合串联质谱法(liquid chromatography tandem mass spectrometry, LC-MS/MS)快速定量脂蛋白颗粒上的NANA,并对糖尿病患者和健康人脂蛋白颗粒的单糖构成进行比对分析。
材 料 和 方 法
1 材料和仪器
D(+)-葡萄糖(glucose,Glc)、D(+)-甘露糖(mannose, Man)、D(+)-半乳糖(galactose, Gal)、L(-)-岩藻糖(fucose, Fuc)、L(+)-阿拉伯糖(arabinose, Ara)、D(+)-葡萄糖胺(glucosamine, GlcN)、N-乙酰D(+)-葡萄糖胺(N-acetylglucosamine, GlcNAc)、L-鼠李糖(rhamnose, Rha)、D-葡萄糖醛酸(glycuronic acid, GlcUA)、D(+)-半乳糖醛酸(galactose-uronic acid, GalUA)、NANA、PMP、乙腈和溴化钠购于Sigma;透析袋(MWCO 8000-14000)(北京Solarbio科技有限公司);蛋白测定试剂盒购于Invitrogen;去离子水从Millipore 纯水机获取;其余试剂均为分析纯。
Agilent Eclipse XDB-C18色谱柱(粒径5 μm,4.6×250 mm)(Agilent);2695型高效液相色谱仪(Waters);Laboroto-4002型低压旋转蒸发仪(Heidolph);TDL-5000B型低速冷冻离心机(中国上海嘉鹏科技有限公司);3K30型高速冷冻离心机(Sigma);Optima L-80XP型超速离心机(Beckman);LC-MS/MS由岛津 HPLC(LC-20AD、DGU-20A3脱气机和SIL-20AC自动进样器)、AB SCIEX的串联质谱仪(4000 QTRAP)和PEAK牌氮气发生器(ABN2ZA)组成。
2 方法
2.1脂蛋白分离 健康人(平均年龄52.5岁)及糖尿病患者(平均年龄51.8岁)血浆样本采集于空腹12 h之后的早餐前,抗凝血液经1 000×g离心15 min获得血浆,定量移入离心管,采用溴化钠固体调节密度至1.006,充N2,封口,10 ℃下40 000 r/min离心24 h,取上层极低密度脂蛋白(very-low-density lipoprotein, VLDL);下层采用溴化钠固体调节密度至1.063,10 ℃下40 000 r/min离心48 h,获得低密度脂蛋白(low-density lipoprotein, LDL);余下液体采用溴化钠固体调密度至1.21,10 ℃下40 000 r/min离心48 h,得高密度脂蛋白(high-density lipoprotein, HDL)。脂蛋白经透析,充N2,封口备用。
2.2单糖组成分析 分别精密称取适量的Man、GlcN、Rha、GlcUA、GalUA、GlcNAc、Glc、Gal、Ara和Fuc等10种单糖标准品,加去离子水配制成100 mmol/L的单糖标准品储备液。衍生过程及标准曲线制作等详见参考文献[7]。色谱柱:Agilent Eclipse XDB-C18色谱柱(粒径5 μm,4.6×250 mm);流动相:0.1 mol/L磷酸盐缓冲液/乙腈 (82∶18,V/V);流速:1.0 mL/min;柱温,30 ℃;紫外检测波长:245 nm。脂蛋白经4 μmol/L三氟乙酸于120 ℃酸水解5 h,低压旋转蒸发去除三氟乙酸。所得单糖混合物采用PMP柱前衍生。将样品色谱峰面积代入相应单糖的回归方程即可得出各脂蛋白单糖构成的摩尔比例。
脂蛋白唾液酸的分析采用LC-MS/MS分析。取20 μg脂蛋白样本加入pH=2的醋酸溶液200 μL,80 ℃下水解2 h,所得水解液加4倍甲醇沉淀蛋白,40 000×g离心20 min,0.22 μm滤膜过滤,滤出液进行LC-MS/MS分析[8-9]。色谱柱为Waters C18分析柱(Waters Symmetry®, 外径3.5 μm, 内径2.1 mm×100 mm);流动相为含有4 mmol/L甲酸铵和0.1%甲酸的5%的甲醇溶液;加样体积为5.0 μL,流动相流速为0.4 mL/min;质谱采用电喷雾离子源的多反应监测(multiple reaction monitoring, MRM)模式进行,监测离子对的m/z为308.1/86.7;温度500 ℃,雾化气、辅助气和气帘气分别设定为55、55和20 psi,其中碰撞气为中等(medium),在负离子模式下的喷雾电压(ion-spray voltage)为-4 500V,碰撞能量为-16 eV,去簇电压为-60 V。数据分析采用AB SCIEX 1.6分析软件。
3 统计学分析
采用SPSS 17.0进行统计学分析。数据以均数±标准差(mean±SD)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
完全酸水解样品经PMP衍生后,经Agilent Eclipse XDB-C18色谱柱分离衍生产物,采用紫外检测器进行检测。图1A为10种单糖标准品经PMP柱前衍生后所得液相色谱图,图中的标注以单糖名称代指其衍生产物。实验中衍生引入杂质的保留时间小于16 min,而单糖衍生物的保留时间在20 min以上,实现了衍生过程中引入的杂质与样品衍生产物之间的有效分离,即该法可有效分离哺乳动物常见的中性、酸性和碱性单糖。健康人HDL(H-HDL)和糖尿病患者HDL(D-HDL)单糖组成如图1B和C所示,可见HDL糖链由Man、GlcN、GlcNAc、Glc和Gal构成。如表1所示,采用LC-MS/MS法测定的H-HDL和D-HDL中NANA的含量分别为(2.14±0.12)和(3.53±0.27) mmol/(g protein)。如表1和图1所示,H-HDL中Man、GlcN、GlcNAc、Glc和Gal的含量依次为:(5.88±0.94)、(16.49±4.11)、(1.31±0.33)、(0.87±0.16)、(7.18±1.64) mmol/(g protein);D-HDL中Man、GlcN、GlcNAc、Glc和Gal的含量依次为:(8.68±0.39)、(24.73±5.50)、(1.91±0.54)、(1.23±0.35)和(9.73±2.85) mmol/(g protein)。可知,D-HDL中Glc和Gal的含量显著升高(P<0.05),且Man、GlcN和NANA的含量较H-HDL上升更显著(P<0.01)。
LDL的单糖组成与HDL相同,如表1和图2所示。采用LC-MS/MS法测定的H-HDL和D-HDL中NANA的含量分别为(6.86±0.11)和(6.45±0.18) mmol/(g protein)。H-LDL中Man、GlcN、GlcNAc、Glc和Gal的含量依次为:(29.20±3.57)、(50.77±4.72)、(5.28±0.64)、(10.06±1.37)和(28.44±3.96) mmol/(g protein);D-LDL中Man、GlcN、GlcNAc、Glc和Gal的含量依次为:(30.08±3.78)、(38.52±6.38)、(3.79±0.78)、(7.63±1.50)和(20.05±2.63) mmol/(g protein)。经比对分析,可知D-LDL较H-LDL中GlcN和Gal含量显著下降(P<0.05),同时GlcNAc、Glc和NANA含量均有所下降,但无显著差异。
VLDL由Man、GlcN、Glc、Gal和NANA构成,如表1和图3所示。采用LC-MS/MS法测定的H-VLDL和D-VLDL中NANA的含量分别为(2.95±0.24)和(4.42±0.15) mmol/(g protein)。H-VLDL中Man、GlcN、Glc和Gal的含量依次为:(91.21±4.12)、(27.05±2.34)、(4 230.95±15.83)、(43.40±3.75) mmol/(g protein);D-VLDL中Man、GlcN、Glc和Gal的含量依次为:(82.40±0.51)、(30.16±0.32)、(4 722.73±93.27)、(34.05±2.81) mmol/(g protein)。可知D-VLDL较H-VLDL中的NANA含量显著上升(P<0.01),而Gal的含量也显著升高(P<0.05)。此外,VLDL的单糖组成色谱图中存在一无法归属的色谱峰。

表1 健康人和糖尿病患者血浆脂蛋白单糖组成
*P<0.05,**P<0.01vsH-group.

Figure 1. Typical chromatograms of 10 kinds of monosaccharide standards and the HDL samples after complete acid hydrolysis. A: typical chromatogram of 10 kinds of monosaccharide standards after PMP derivatization; B: monosaccharide composition of the HDL from healthy participants after acid hydrolysis; C: monosaccharide composition of the HDL from diabetic patients after acid hydrolysis.
讨 论
由于糖基之间连接位点的复杂性,糖结构的研究一直是生物化学研究中的重点和难点。随着质谱的发展,LC-MS/MS已成功应用于多种疾病相关分子的检测,为探讨疾病发生发展的分子机制提供了必不可少的技术手段[10]。本文采用PMP柱前衍生法建立了测定脂蛋白样本单糖组成的方法,该法可将脂蛋白上的中性和碱性单糖完全分离,实现定量分析;同时结合液相串联质谱法检测脂蛋白上的唾液酸含量。本研究结果显示,糖尿病患者脂蛋白上糖基化修饰与健康人相比发生了显著改变,而每种脂蛋白单糖组成的改变情况不同。如表1所示,糖尿病患者HDL的糖基化修饰程度较同龄健康人HDL升高达35.52%;糖尿病患者LDL的GlcN和Gal的糖基化修饰程度下降24.13%;糖尿病患者VLDL的Gal糖基化修饰下降达21.54%,但NANA含量升高达49.83%。本团队正在借助阴离子交换柱层析、凝胶柱层析和高分辨串联质谱等技术手段开展糖尿病患者与健康人脂蛋白糖基化差异的精细研究。
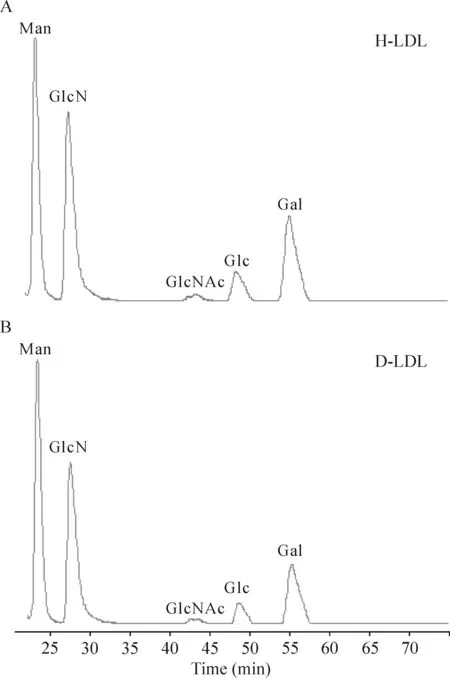
Figure 2. Typical chromatograms of the LDL samples after complete acid hydrolysis and PMP derivatization. A: monosaccharide composition of the LDL from healthy participants after acid hydrolysis; B: monosaccharide composition of the LDL from diabetic patients after acid hydrolysis.
已有研究表明,脂蛋白上大约50%的负电荷是由唾液酸提供的。糖尿病患者HDL和VLDL唾液酸含量较之健康人显著升高(P<0.01),而糖尿病患者LDL唾液酸含量却有所下降。脂蛋白,特别是HDL糖基化修饰改变势必影响HDL的抗氧化、抗炎症[11]和胆固醇逆向转运等功能。我们尚未发表的数据显示,NANA具有抗氧化功能,在清除DPPH自由基、·OH自由基和对抗H2O2等方面具有较好的生物活性,上述研究结果与先前报道一致[12-14]。氧化应激伴随着糖尿病的发生发展[15],因此,氧化应激可能对脂蛋白的糖基化产生重要影响。已有研究表明,在心血管疾病状态下,肝脏会产生大量唾液酸化的糖蛋白,且伴随唾液酸转移酶活性的显著升高。据此,可以假设在氧化应激状态下,机体为了保护脂蛋白等颗粒或细胞的正常功能,产生富唾液酸化的糖蛋白,一方面增强自身抗氧化功能,另一方面唾液酸提供的负电荷可有效保护血管内脂蛋白之间以及脂蛋白与内皮细胞之间的黏附和蓄积。另有研究显示,LDL的去唾液酸化或经甘露糖苷酶水解处理后,可让LDL中的胆固醇蓄积[16-18]。结合文献报道及本研究的实验结果,可以推测糖尿病患者较同龄健康人LDL的去唾液酸化可能是糖尿病患者易发动脉粥样硬化等心血管疾病的诱发因素之一。

Figure 3. Typical chromatograms of the VLDL samples after complete acid hydrolysis and PMP derivatization. A: monosaccharide composition of the VLDL from diabetic patients after acid hydrolysis; B: monosaccharide composition of the VLDL from healthy participants after acid hydrolysis.
[参 考 文 献]
[1] Dodani S, Grice DG, Joshi S. Is HDL function as important as HDL quantity in the coronary artery disease risk assessment?[J]. J Clin Lipidol, 2009, 3(2):70-77.
[2]MillarJS,AnberV,ShepherdJ,etal.Sialicacid-containingcomponentsoflipoproteinsinfluencelipoprotein-proteoglycaninteractions[J].Atherosclerosis, 1999, 145(2):253-260.
[3] Park KH, Cho KH. High-density lipoprotein (HDL) from elderly and reconstituted HDL containing glycated apolipoproteins A-I share proatherosclerotic and prosenescent properties with increased cholesterol influx[J]. J Gerontol A Biol Sci Med Sci, 2011, 66(5):511-520.
[4]StrattonPD,LumbPJ,PagangaG,etal.Influnceofsialicacidcontentoflow-densitylipoproteinparticlesonendothelium-dependentvasorelaxationinrabbitaorta[J].Atherosclerosis, 2001, 154(2):285-290.
[5] Gavella M, Lipovac V, Car A, et al. Serum sialic acid in subjects with impaired glucose tolerance and in newly diagnosed type 2 diabetic patients[J]. Acta Diabetol, 2003, 40(2):95-100.
[6]SerdarZ,YesilbursaD,DiricanM,etal.Sialicacidandoxidizabilityoflipidandproteinsandantioxidantstatusinpatientswithcoronaryarterydisease[J].CellBiochemFunct, 2007, 25(6):655-664.
[7] 郭守东. 微生物胞外多糖的结构及其抗氧化活性研究[D]. 青岛: 中国海洋大学, 2010.
[8] 栗 晖, 金一宝, 刘红霞, 等. 液相色谱-质谱法对奶粉中唾液酸含量的测定[J]. 分析测试学报, 2008, 27(增刊):193-194.
[9] 侯向昶, 朱丽萍, 刘春生, 等. 超高效液相色谱-串联质谱法测定燕窝中唾液酸的含量[J]. 现代食品科技, 2013, 29(7): 1706-1720.
[10] 徐 丹, 孟 宇, 胡 波, 等. 基于HPLC-MS/MSQ-TOF分析糖尿病肾病维持性血透患者含糖透析的代谢特征[J]. 中国病理生理杂志, 2013, 29(3):455-461.
[11] 桑 慧, 姚树桐, 杨娜娜, 等. HDL3抗脂多糖诱导的人脐静脉内皮细胞损伤[J]. 中国病理生理杂志, 2011, 27(10):1857-1862.
[12]IijimaR,TakahashiH,NammeR,etal.Novelbiologicalfunctionofsialicacid(N-acetylneuraminicacid)asahydrogenperoxidescavenger[J].FEBSLett, 2004, 561(1-3):163-166.
[13] Iijima R, Ichikawa T, Yamazaki M. Sialic acid attenuates the cytotoxicity of the lipid hydroperoxides HpODE and HpETE[J]. Carbohydr Res, 2009, 344(7):933-935.
[14]OgasawaraY,NamaiT,YoshinoF,etal.Sialicacidisanessentialmoietyofmucinasahydroxylradicalscavenger[J].FEBSLett, 2007, 581(13):2473-2477.
[15] 金启辉, 管文花, 王 辉, 等. 氧化应激在糖尿病大鼠胃动力学改变中的意义[J]. 中国病理生理杂志, 2012, 28(12):2238-2243.
[16]AksenovDV,MedvedevaLA,SkalbeTA,etal.DeglycosylationofapoB-containinglipoproteinsincreasetheirabilitytoaggregateandtopromoteintracellularcholesterolaccumulationin vitro[J].ArchPhysiolBiochem, 2008, 114(5):349-356.
[17] Lindbohm N, Gylling H, Miettinen TA. Sialic acid content of low density lipoprotein and its relation to lipid concentrations and metabolism of low density lipoprotein and cholesterol[J]. J Lipid Res, 2000, 41(7):1110-1117.
[18]FilipovicI,SchwarzmannG,MrazW,etal.Sialic-acidcontentoflow-densitylipoproteinscontrolstheirbindinganduptakebyculturedcells[J].EurJBiochem, 1979, 93(1):51-55.

