广藿香油对家兔内毒素性发热的作用*
周彦希, 彭 成, 万 峰, 曹小玉, 肖丽萍, 刘建林, 贺 抒, 杜巧辉, 龚小红
(1成都中医药大学, 2中药资源系统研究与开发利用省部共建国家重点实验室培育基地,中药材标准化教育部重点实验室,四川 成都 610075)
广藿香油(patchoulioil)为唇形科植物广藿香Pogostemoncablin(Blanco)Benth. 的干燥地上部分经水蒸气蒸馏提取的挥发油[1],是广藿香的主要药用成分。该成分具有抗细菌[2]、刺激胃肠分泌[3]、抗真菌、抗病毒、抗疟原虫、保护肠屏障功能、调节胃肠运动功能、免疫调节、抗炎、镇痛、抗氧化、止咳化痰、镇吐等[4]广泛药理作用,但有关其解热作用尚未见报道。本教研室前期实验研究发现广藿香油具有广谱抗菌活性,并具有极强的抗菌效力。基于此,本实验复制大肠杆菌内毒素致家兔发热模型,观察广藿香油对家兔体温的影响,并测定家兔血清中内生致热原白细胞介素1β(IL-1β)和肿瘤坏死因子α (TNF-α)含量及下丘脑中的中枢发热介质环磷酸腺苷(cAMP)和前列腺素E2(prostaglandin E2, PGE2)含量,旨在探讨广藿香油对内毒素性发热家兔的解热作用及其解热机制。
材 料 和 方 法
1 材料、动物和实验分组
广藿香,购自湛江雷州市,经成都中医药大学中药鉴定教研室李敏老师鉴定,为唇形科植物广藿香Pogostemoncablin(Blanco)Benth.的干燥地上部分,炮制后采用水蒸气蒸馏法提取广藿香油,使用时用0.5% 吐温80配成广藿香油乳。脂多糖(lipopolysaccharide, LPS; Sigma);注射用赖氨匹林(lysine acetylsalicylate for injection, LAI;扬州一洋制药有限公司);双黄连注射液(Shuanghuanglian injection,SI;河南福森药业有限公司);Rabbit cAMP ELISA Kit、Rabbit TNF-α ELISA Kit、Rabbit IL-1β ELISA Kit和Rabbit PGE2ELISA Kit购自R&D。
电子天平(上海天平仪器厂,JA-2603);OMRON电子体温计(欧姆龙有限公司,MC-347);离心机(Thermo Scientific, Legend Micro 17R);酶标仪(Thermo Scientific, Varioskon Flash);电热恒温鼓风干燥箱(上海跃进医疗器械有限公司,101-3-BS-Ⅱ);超声波清洗器(昆山市超声仪器有限公司,KQ5200E型)。
雄性普通级家兔,体重(2.0±0.5)kg,由成都中医药大学实验动物研究中心提供,许可证编号为SCXK(川)2008-11。将家兔于实验室饲养3 d,使其适应环境。分别在实验前2 d及实验当天晨测家兔肛温,选择3次肛温值在38.5~39.5 ℃之间,波动不超过0.5 ℃者用于实验。取实验当天晨测肛温为基础体温。根据实验当天体重及基础体温值均分为7组,分别为空白对照组、模型对照组、西药阳性组、中药阳性组及广藿香油高、中、低(2%、1%、0.5%)3个剂量组,每组6只。
2 方法
2.1复制LPS致家兔发热模型 用无热原的生理盐水将精制的LPS稀释成2 mg/L,除空白对照组外,其余各组均按1 mL/kg经家兔左耳的耳缘静脉注射LPS。空白对照组按1 mL/kg耳缘静脉注射无热原生理盐水。
2.2给药LPS注射0.5h后,按以下方式顺次经家兔右耳的耳缘静脉注射给药:空白对照组:0.5% 吐温80 1mL/kg;模型对照组:0.5% 吐温80 1mL/kg;西药阳性组:LAI1mL/kg;中药阳性组:SI每只0.5~1mL;广藿香油高、中、低剂量组:广藿香油乳高、中、低(2%、1%和0.5%)1mL/kg。
2.3体温测定 分别测定给药后0.5 h、1 h、1.5 h、2.5 h、3.5 h、4.5 h和5.5 h(相当于造模后1 h、1.5 h、2 h、3 h、4 h、5 h和6 h)家兔的肛温,比较不同时点肛温与基础肛温之差值(ΔT)为体温变化的指标。
2.4样品采集与检测 造模后3h耳缘静脉取血3mL,静止1~2h,离心(1 400×g, 15min),取上清液,按试剂盒说明书测定IL-1β和TNF-α含量。于末次测量体温后,立即断头处死家兔,取出全脑,在冰浴下于视交叉与灰结节之间取出下丘脑,纵向切成2等份,取1份称重,放入盛有0.5mL生理盐水的匀浆器中粉碎匀浆。将悬浮液倒入10mL试管内(冰浴),用0.3mL生理盐水洗匀浆器并倒入悬浮液中,混匀静置5min,离心(1 400×g, 15min),收集上清液,按试剂盒说明书测定cAMP和PGE2的含量。
3 统计学处理
数据用均数±标准差(mean±SD)表示,利用SPSS 17.0软件处理,采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 广藿香油对内毒素性发热家兔体温的影响
实验过程中,空白对照组家兔体温在正常范围内波动,模型对照组造模后各时点体温升高明显,与空白对照组比较有显著差异(P<0.01)。阳性组及给药组造模后各时点体温均升高,但升高度数均低于各时点模型对照组的体温升高度数。西药阳性组给药后0.5 h有明显的解热作用,与模型对照组比较有显著差异(P<0.05),其余各时点与模型对照组比较无显著差异。中药阳性组给药后1 h和2.5 h无明显的解热作用,其余各时点均有明显的解热作用,与模型对照组比较有显著差异(P<0.05)。广藿香油高剂量组从给药后1.5 h开始有明显的解热作用,一直持续到给药后5.5 h,与模型对照组比较有显著差异(P<0.05)。广藿香油中剂量组给药后3.5 h开始有明显的解热作用,一直持续到给药后5.5 h,与模型对照组比较有显著差异(P<0.05)。这表明广藿香油对内毒素所致发热模型家兔有显著解热作用,见表1。
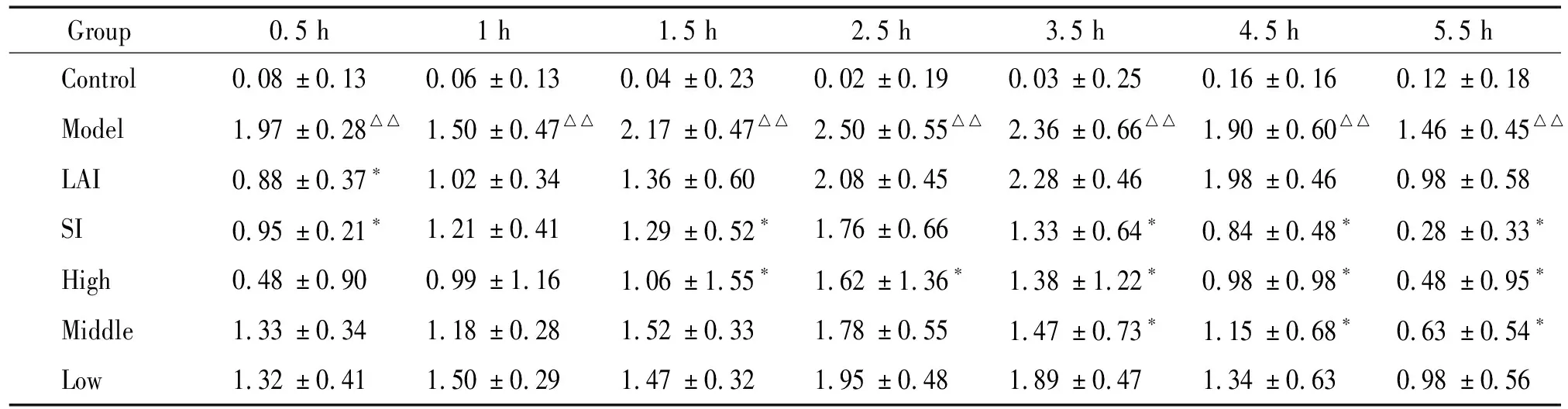
表1 广藿香油对内毒素性发热家兔体温的影响
LAI: lysine acetylsalicylate for injection; SI: shuanghuanglian injection.△△P<0.01vscontrol group;*P<0.05vsmodel group.
2 广藿香油对内毒素性发热家兔血清中IL-1β和TNF-α含量的影响
模型对照组家兔血清中IL-1β和TNF-α含量均明显高于空白对照组,与空白对照组比较均有显著差异(P<0.05)。西药阳性组和中药阳性组家兔血清中IL-1β和TNF-α含量均明显低于模型对照组(P<0.01或P<0.05)。广藿香油各剂量组家兔血清中IL-1β含量与模型对照组比较无显著差异,但均有降低IL-1β含量的趋势。广藿香油中剂量组家兔血清中TNF-α含量明显低于模型对照组(P<0.05)。这表明广藿香油可明显抑制内毒素致发热家兔血清中TNF-α含量的产生,见表2。
表2广藿香油对内毒素性发热家兔血清中IL-1β和TNF-α对含量的影响
Table 2. The effect of IL-1β and TNF-α contents in the serum of rabbits with LPS-induced fever(Mean±SD.n=6)
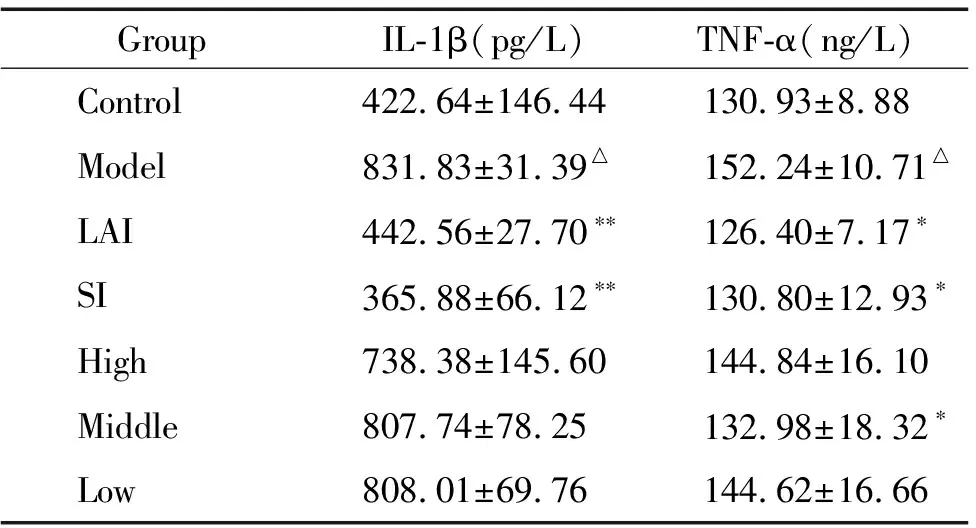
GroupIL-1β(pg/L)TNF-α(ng/L)Control422.64±146.44130.93±8.88Model831.83±31.39△152.24±10.71△LAI442.56±27.70∗∗126.40±7.17∗SI365.88±66.12∗∗130.80±12.93∗High 738.38±145.60144.84±16.10Middle807.74±78.25132.98±18.32∗Low808.01±69.76144.62±16.66
△P<0.05vscontrol group;*P<0.05,**P<0.01vsmodel group.
3 广藿香油对内毒素性发热家兔下丘脑中cAMP和PGE2含量的影响
模型对照组家兔下丘脑中cAMP和PGE2含量均明显高于空白对照组,与空白对照组比较均有显著差异(P<0.05)。西药阳性组和中药阳性组家兔下丘脑中cAMP含量均明显低于模型对照组,与之比较均有显著差异(P<0.05)。西药阳性组和中药阳性组家兔下丘脑中PGE2含量与模型对照组比较均无显著差异。广藿香油各剂量组家兔下丘脑中cAMP含量明显低于模型对照组,与之比较有显著差异(P<0.05)。广藿香油各剂量组家兔PGE2含量与模型对照组比较均无显著差异,但均有降低PGE2含量的趋势。这表明广藿香油可明显抑制内毒素致发热家兔下丘脑中cAMP含量的产生,见表3。
表3广藿香油对内毒素性发热家兔下丘脑中cAMP和PGE2含量的影响
Table 3. The cAMP and PGE2contents in the hypothalamus of rabbits with LPS-induced fever (Mean±SD.n=6)

GroupcAMP (nmol/L)PGE2 (ng/L)Control18.48±1.9683.82±15.28Model21.65±1.36△114.66±10.12△LAI17.96±1.42∗93.11±15.53SI17.13±1.53∗97.02±4.79High17.30±0.77∗98.10±12.47Middle18.66±4.34∗110.51±31.88Low17.49±1.10∗87.64±18.90
△P<0.05vscontrol group;*P<0.05vsmodel group.
讨 论
内毒素是外源性致热原,通过激活体内的单核巨噬细胞产生并释放内生致热原引起发热反应[5]。本实验观察到家兔耳缘静脉注射内毒素后,体温明显升高,而广藿香油有明显的解热作用,可明显抑制内毒素导致的体温升高。与西药赖氨匹林和中药双黄连注射液比较,西药赖氨匹林主要特点是降体温快,但持续时间短;中药双黄连注射液主要特点是间歇性降体温,但作用不稳定;而广藿香油降体温的作用效果稳定、持久、无反复。
内生致热原是多种致热性细胞因子,包括IL-1、IL-6、干扰素、TNF、巨噬细胞炎症蛋白-1等[6]。IL-1是重要的致热性细胞因子,因基因编码不同分为IL-1α和IL-1β,实验证实IL-1β具有明显的致热性,是参与多种致热原性发热的重要细胞因子[7]。TNF主要以2种蛋白质形式存在,即:TNF-α和TNF-β,而TNF-α被认为是其发热的主要调节因子[8],大量资料表明,内毒素性发热时血浆和脑脊液中TNF-α含量均明显升高[9]。内生致热原可直接或间接作用于体温调节中枢,引起发热中枢介质cAMP、PGE2、促皮质激素释放激素等的释放,继而引起发热。cAMP为脑内多种介质的第二信使,许多学者主张cAMP是主要的中枢发热介质[10]。在多种动物发热模型的研究中均发现,下丘脑中cAMP含量与体温变化呈正相关[11]。内毒素性发热呈多相性,PGE2在其所有阶段皆有调节作用,是重要的中枢调节介质[12]。内毒素性发热时,下丘脑中PGE2含量明显升高[13]。
本实验观察到静脉注射内毒素后3 h,模型对照组血清中IL-1β和TNF-α以及下丘脑中cAMP和PGE2含量均明显升高。广藿香油可明显抑制血清中TNF-α和下丘脑中cAMP含量的升高,广藿香油中剂量组血清中TNF-α含量明显低于模型对照组,广藿香油各剂量组下丘脑中cAMP含量均明显低于模型对照组;有降低血清中IL-1β和下丘脑中PGE2含量升高的趋势。
综上所述,广藿香油对内毒素性发热家兔有解热作用,其解热机制可能与抑制内毒素性发热家兔血清中TNF-α和下丘脑中cAMP含量升高有关。
[参 考 文 献]
[1] 国家药典委员会. 中华人民共和国药典一部[M]. 2010年版.北京:中国医药科技出版社,2010:373.
[2] 杨甫传,徐丽珍,邹忠梅,等. 广藿香醇及广藿香油中广藿香醇在大鼠体内药代动力学比较[J]. 药学学报,2004, 39(9):726-729.
[3] 肖翔林,龙膺西. 近年来广藿香的研究概况[J]. 中药材,2004, 27(6):456-458.
[4] 刘红淼,李艳玲,杨继章. 广藿香油的药理作用研究进展[J]. 中国药房,2012, 23(47):4506-4507.
[5] 赵红艳,张 璠,李守拙,等. 野黄芩甙对发热家兔下丘脑及脑脊液中环磷腺苷含量的影响[J]. 中国医科大学学报,2003, 32(2):115-119.
[6] 蒋玉凤,张丹卉,黄启福,等. 清开灵对内毒素性发热家兔的解热机制研究[J]. 北京中医药大学学报,2003, 26(5):53-55.
[7] Kozak W, Kluger MJ, Soszynski D,et al. IL-6 and IL-1 beta in fever: studies using cytokine-deficient (knockout) mice[J]. Ann N Y Acad Sci, 1998, 856:33-47.
[8] 徐志勇. 穿心莲软胶囊部分毒理、药效学研究及解热机制初探[D]. 广州:广州中医药大学临床药理研究所,2005:1-43.
[9] Kao TY, Huang WT, Chang CP, et al. Aspirin may exert its antipyresis by inhibiting the N-methyl-D-aspartate receptor-dependent hydroxyl radical pathways in the hypothalamus[J]. J Pharmacol Sci, 2007, 103(3):293-298.
[10] 马仁强,吴先哲. 清金注射液解热作用机制的探讨[J]. 时珍国医国药, 2003, 14(6):330-331.
[11] 李 东,杨芳炬,黄继华,等. 注射用清开灵冻干粉解热镇痛作用及解热机制的试验研究[J]. 中药材, 2005, 28(9):796-799.
[12]YaoXJ,YinJA,XiaYF,etal.Puerarinexertsantipyreticeffectonlipopolysaccharide-inducedfeverinratsinvolvinginhibitionofpyrogenproductionfrommacrophages[J].JEthnopharmacol, 2012, 141(1):322-330.
[13] Tsai CC, Lin MT, Wang JJ, et al. The antipyretic effects of baicalin in lipopolysaccharide-evoked fever in rabbits[J]. Neuropharmacology, 2006, 51(4):709-717.

