高脂血症大鼠主动脉HSP22、TNF-α和eNOS的表达及阿托伐他汀的影响*
方海洋, 陈 琦, 项 建, 吴延庆, 程晓曙
(南昌大学第二附属医院心内科,江西 南昌 330006)
热休克蛋白(heat shock proteins, HSPs)是一类应激蛋白,因其与热应激有关故冠名HSPs,它们属于进化上较为保守的蛋白家族。 HSP22为一种丝/苏氨酸激酶,分子量21.6 kD,又称为HSPB8和H11,属于小HSP家族成员,广泛分布于哺乳动物的各种组织中,尤其是肌肉相关性组织[1]。早期研究表明高脂环境刺激下内皮细胞HSP70的表达明显升高,并证明对人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)有保护作用[2]。Ghayour-Mobarhan等[3]发现他汀可以降低脂质代谢紊乱患者HSP60、HSP65和HSP70抗体滴度,可能与他汀调脂外的抗炎及免疫调节等保护作用有关。最近有报道他汀可使高脂血症小鼠血清HSP70抗体滴度降低而使HSP90抗体滴度升高[4]。高脂环境下动脉HSP的表达究竟如何,因HSP家族成员众多,且实验条件均不可能完全相同,尚无统一定论。目前HSP22与高脂血症的研究甚少,高脂血症环境下HSP22的表达如何尚不明确,他汀的干预下,HSP22的表达情况亦不清楚。本研究通过复制高脂血症大鼠模型,主要探究高脂血症时大鼠主动脉HSP22的表达,同时观察高脂血症时内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)及肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)的表达和阿托伐他汀干预对其的影响。
材 料 和 方 法
1 动物与材料
18只7周龄、体重180~210 g的SPF级雄性SD大鼠(实验动物合格证号为0109526)及高脂饲料(配方:1%胆固醇、5%蛋黄粉、10%猪油、0.2%胆盐、5%砂糖、0.1%丙基硫氧嘧啶和78.7%基础饲料)由广东省医学实验动物中心提供。HSP22 Ⅰ抗购于Abnova;TNF-α Ⅰ抗购于Abcam;eNOSⅠ抗购于Signalway Antibody;阿托伐他汀钙片购于北京嘉林药业股份有限公司;维生素D3注射液购于上海通用药业股份公司;甘油三酯(triglyceride,TG)试剂盒和总胆固醇(total cholesterol,TC)试剂盒均购自浙江伊利康生物技术公司;低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒和高密度脂蛋白试胆固醇(high-density lipoprotein cholesterol,HDL-C)剂盒均购自北京北化康泰临床试剂公司;免疫组化试剂盒购自博士德生物技术公司;SDS-PAGE凝胶配制试剂盒购自碧云天生物科技研究所。
2 主要方法
2.1高脂血症模型的建立及实验分组 将上述18只SD大鼠适应性喂养7 d,禁食不禁水12 h,眼眶后静脉丛采血1 mL左右,制备血清,参照试剂盒方法测定大鼠血清TC、TG、HDL-C和LDL-C水平观察其基础值;18只大鼠随机分为正常对照组4只和模型组14只,正常对照组给予基础饲料,模型组给予高脂饲料喂养,同时按照7×105U/kg体重的剂量腹腔注射维生素D3注射液(分3 d注射,1次/d)[5],连续喂饲10周,于末次喂饲后禁食不禁水12 h,再次测定大鼠血脂水平并与造模前的血脂结果比较,确定是否建成高脂血症模型。造模成功后模型组大鼠随机分为高脂对照组8只和他汀干预组6只。正常对照组继续喂饲基础饲料,高脂对照组喂饲高脂饲料,他汀干预组则在喂饲高脂饲料基础上,同时给予阿托伐他汀2 mg/kg灌胃,其它各组则给予同体积生理盐水灌胃。各组均连续喂饲及灌胃21周。干预结束后,3%戊巴比妥钠40 mg/kg腹腔注射全身麻醉,腹主动脉取血,离心分离血清,一部分用于检测血脂水平,一部分-80 ℃留存备用。取血后迅速摘取大鼠主动脉,一半于4%多聚甲醛固定,一半液氮速冻。
2.2主动脉组织切片制作及HE染色 经4%多聚甲醛固定24 h的主动脉组织,经修块、流水冲洗、脱水、透明、浸蜡、石蜡包埋后,每条主动脉行4 μm厚连续石蜡切片5张,2张用于HE染色,选择染色较好的用Olympus BX41显微镜拍照。余下3张用于免疫组织化学染色。
2.3免疫组织化学染色 参照试剂盒方法步骤检测大鼠主动脉HSP22、TNF-α的表达。HSP22 Ⅰ抗浓度为1∶200,TNF-αⅠ抗浓度为1∶200。阳性染色为明显高于背景的棕黄色染色。根据以下标准将阳性染色分为4级:-:无明显高于背景的棕黄色染色;+:阳性染色少于10%;++:介于弱阳性与强阳性标准之间;+++:阳性染色60%以上。染色较好的用OlympusBX41显微镜拍照。
2.4免疫印迹法检测eNOS的表达 从液氮中取出主动脉经匀浆后,经BCA法蛋白定量,取相同数量的蛋白样品进行SDS-PAGE,并电转移至NC膜上。用5%脱脂奶粉(用PBS稀释)室温封闭30 min,分别滴加1∶500工作浓度的兔抗鼠Ⅰ抗eNOS或GAPDH抗体4 ℃孵育膜过夜。1∶5 000羊抗兔Ⅱ抗37 ℃反应1 h,洗膜后用WO-9413B型凝胶成像系统自带Gelpro32软件分析数据。
3 统计学处理
用SPSS 16.0统计软件分析,数据以均数±标准差(mean±SD)表示,组间比较若方差齐用方差分析,方差不齐用秩和检验。以P<0.05为差异有统计学意义。
结 果
1 一般情况及血脂水平
高脂饲料喂饲后,模型组大鼠出现拒食,先后有3只大鼠死亡。高脂饲料诱导10周后,与正常对照组比较,高脂模型组大鼠血清TC和LDL-C水平均明显升高,升高幅度分别为正常对照组的1.6倍(3.54±0.33vs2.15±0.33,P<0.05)和1.9倍(1.98±0.18vs1.03±0.30,P<0.05),而血清TG与HDL-C水平无显著变化,形成了高胆固醇血症。
他汀干预期间,高脂对照组大鼠先后有2只大鼠分别于第14周和第20周处死用于观察大鼠主动脉病变程度,他汀干预组大鼠有1只死亡。至他汀干预结束时,血清TC和LDL-C水平:高脂对照组分别为正常对照组5.2倍(P<0.01)和8.0倍(P<0.01);他汀干预组分别为正常对照组3.6倍(P<0.01)和5.8倍(P<0.01),均显著低于高脂对照组。血清TG水平:与正常对照组相比高脂对照组及他汀干预组均无明显升高(P>0.05)。血清HDL-C水平:他汀干预组为正常对照组的2.1倍(P<0.05);高脂对照组为正常对照组的1.9倍(P<0.05)。他汀干预组与高脂对照组相比无显著差异(P>0.05),见表1。
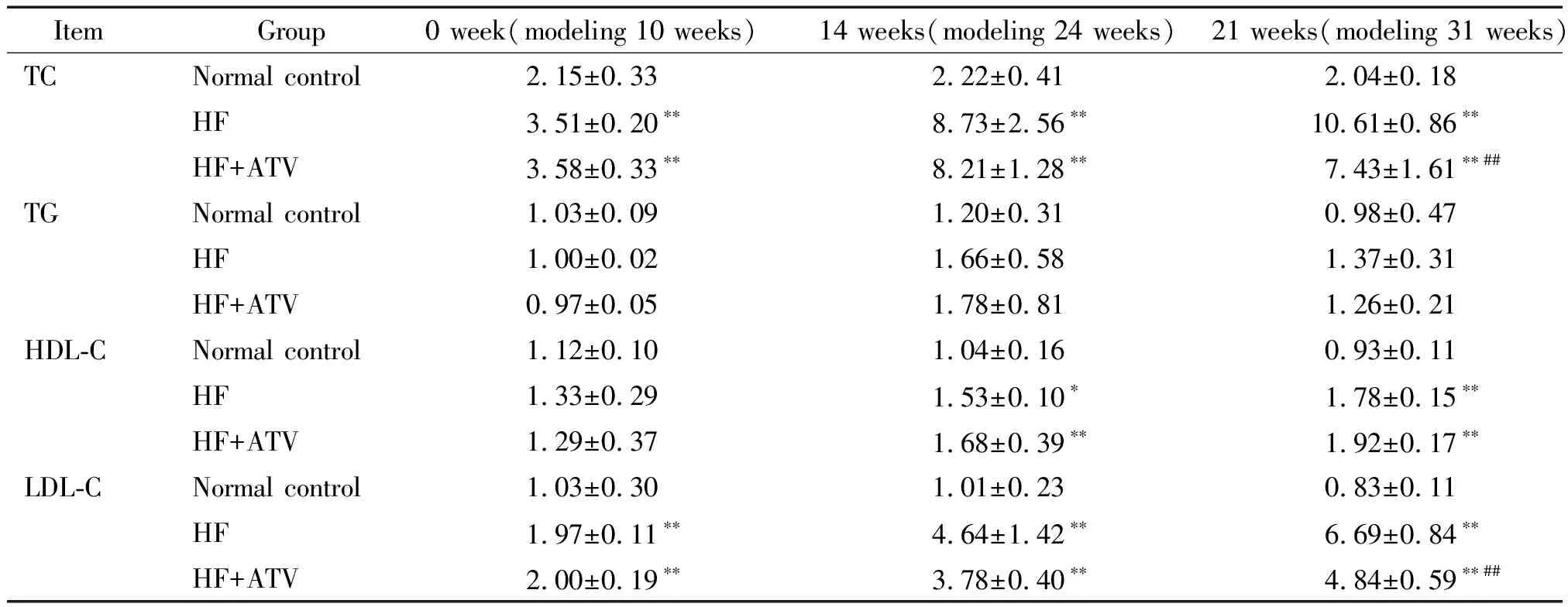
表1 阿托伐他汀干预前及干预14周和21周大鼠血脂情况
*P<0.05,**P<0.01vsnormal control;##P<0.01vsHF (high fat).
2 大鼠主动脉病理变化
阿托伐他汀干预21周后,处死所有大鼠。正常对照组大鼠主动脉镜下均未见病理改变,见图1A。高脂对照组大鼠主动脉管腔明显不规则,管壁厚薄不均,内膜部分破坏,中膜层排列紊乱,弹性纤维结构不清,可见明显钙化病变,未见脂质沉积和泡沫细胞聚集,部分可见软骨样细胞增生,见图1B箭头所示。他汀干预组大鼠主动脉管腔不规则,管壁厚薄不均,内膜、中膜见明显钙化,弹性纤维结构明显不清,与高脂对照组比较略有改善,见图1C。模型观察大鼠于第14周处死后观察主动脉病理变化,无典型动脉粥样硬化改变(图1D),故各组继续按原方案进行。
3 主动脉HSP22的表达
正常对照组大鼠胸主动脉管壁均未见HSP22阳性表达,见图2A;高脂对照组大鼠胸主动脉管壁可见呈线状或点状分布的棕黄色阳性着色,主要较集中分布在中膜,部分散在分布于内膜,见图2B箭头所示;他汀干预组大鼠胸主动脉管壁可见呈线状分布的棕黄色阳性着色,主要位于中膜,棕黄色着色较高脂对照组稍浅,见图2C箭头所示。他汀干预组平均吸光度值明显低于高脂对照组(0.211±0.014vs0.345±0.042,P<0.05),见图2D。
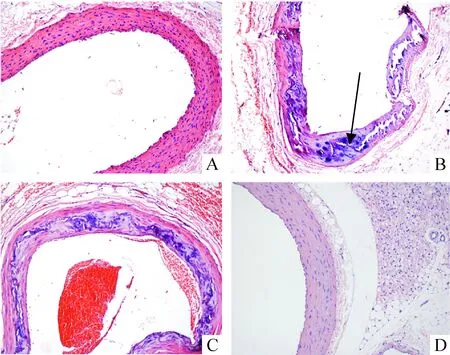
Figure 1. Representative sections of HE staining of rat aortas(×200).A: normal control group (20 weeks); B: HF group (20 weeks);C: HF+ATV group (20 weeks);D: HF observation rat (14 weeks).

Figure 2. The expression of HSP22 protein in the aorta of rats (immunohistochemistry, ×400). A: normal control group; B: HF group; C: HF+ATV group; D: statistical bar graph indicates the result of mean optical density of positive particles in each group.Mean±SD.n=4.*P<0.05 vs HF.
4 主动脉TNF-α的表达
正常对照组大鼠胸主动脉中膜和内膜未见TNF-α阳性表达,外膜可见棕黄色着色,见图3A;高脂对照组大鼠胸主动脉外膜可见棕黄色着色,同时中膜、内膜可见呈线状或点状分布的棕黄色阳性着色,见图3B箭头所示;他汀干预组大鼠胸主动脉外膜可见棕黄色着色,同时中膜、内膜可见呈线状或点状分布的棕黄色阳性着色,见图3C箭头所示。他汀干预组平均吸光度值明显低于高脂对照组(0.218±0.090vs0.377±0.094,P<0.05),见图3D。

Figure 3. The expression of TNF-α protein in the aorta of rats (immunohistochemistry, ×400).A: normal control group; B: HF group; C: HF+ATV group; D: statistical bar graph indicates the result of mean density of positive particles in each group.Mean±SD.n=4.*P<0.05 vs HF.
5 主动脉eNOS的表达
经高脂饮食干预后大鼠主动脉eNOS的表达较正常对照组明显降低(0.968±0.168vs0.126±0.130,P<0.01),形成高脂血症后给予阿托伐他汀干预21周,他汀干预组大鼠主动脉eNOS的表达仍明显低于正常对照组(0.968±0.168vs0.202±0.177,P<0.01),他汀干预组eNOS表达水平略高于高脂对照组,但差异无显著(P>0.05),见图4。
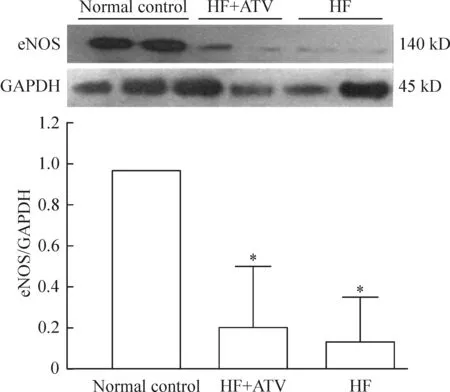
Figure 4. The expression of eNOS protein in the aorta of rats.Mean±SD.n=4. *P<0.05 vs normal control.
讨 论
动脉是构成循环系统的重要组成部分,并在一系列应激反应如局部的损伤、毒物、吸烟和高脂血症形成过程中不断变化,这些刺激直接或间接导致血压升高和血管壁的损伤,并可进一步导致血管僵硬度增加和形成动脉硬化,机体为了在各种应激条件下存活,为了维持血管壁的稳态,内皮细胞及平滑肌细胞等血管壁细胞会产生大量的HSP而对抗应激状态下的血管损伤[6-7]。新近研究发现人内皮细胞在高脂血症患者血清刺激下形成了内皮源性泡沫细胞,并出现HSP27、HSP70和HSP90高表达[8]。
目前,尚未发现HSP22与高脂血症的相关研究。本研究中我们参考前人的经验[5]成功复制出高脂血症大鼠模型,发现高脂血症大鼠主动脉HSP22的表达较正常对照组高,与其它HSP成员如HSP27、HSP70在高脂环境下表达升高呈一致的现象[8]。同时,高脂血症大鼠主动脉TNF-α的表达较正常对照组高,eNOS的表达则较正常对照组低。TNF-α表达水平上调可导致血管内皮细胞的功能损害而下调eNOS的表达[9]。TNF-α可诱导血管平滑肌细胞转化、迁移、增殖和凋亡,而这些改变在血管损伤的形成和进展中均起着关键作用[10-11]。而本研究HE染色结果显示高脂血症大鼠主动脉管腔明显不规则,管壁厚薄不均,内膜部分破坏,中膜层排列紊乱,弹性纤维结构不清,可见明显钙化病变,呈现出明显的血管损伤改变。推测HSP22表达的升高很可能是一种对血管损伤的炎症性刺激的保护性反应,需进一步研究以证实。
阿托伐他汀目前广泛应用于高胆固醇血症、冠心病的预防和治疗,是胆固醇合成限速酶羟甲基-戊二酸单酰辅酶还原酶抑制剂,能明显降低心血管死亡[12]。他汀类药物除有效调脂作用外,还具有抑制炎症反应,抗氧化应激,降低血小板活性及改善内皮功能等多重调脂外作用[13]。本研究中阿托伐他汀干预后血脂的变化与他汀类药物主要降低LDL-C和TC水平,轻度升高HDL-C水平的作用相一致。
阿托伐他汀干预后,大鼠主动脉HSP22的表达较高脂对照组明显降低。Ghayour-Mobarhan等[3]发现辛伐他汀和阿托伐他汀都可降低脂质代谢紊乱患者血清热休克蛋白60、65、70抗体滴度。同时血清C-反应蛋白(C-reactive protein,CRP)浓度也均明显降低,但他汀对HSP抗体滴度的影响与CRP浓度的改变并不具有相关性,提示他汀使HSP抗体滴度降低的作用并不能完全以其抗炎症反应进行解释,而可能存在其它的免疫相关调节机制。本研究中,阿托伐他汀干预后TNF-α的表达较高脂对照组明显降低,eNOS的表达则略有升高,表明阿托伐他汀干预后血管炎症反应已有所抑制,但内皮功能尚未能完全恢复。Zhang等[14]进行的研究中阿托伐他汀干预组自实验开始即给予他汀,共干预30 d,大鼠主动脉eNOS表达明显较高脂组高(P<0.05),与正常对照组无明显差异,血管内皮功能明显恢复。而本研究则是形成明显高脂血症后再行阿托伐他汀干预,未能明显恢复血管内皮功能。HE结果显示他汀干预组与高脂对照组的差异并不十分显著,他汀干预组依然存在明显的血管损伤,这与eNOS的表达未见明显升高呈一致表现,如能早期进行他汀干预,可能更好地保护血管内皮功能。阿托伐他汀是否通过HSP22途径抑制血管炎症,恢复内皮功能,本研究尚不能阐明。在内皮功能尚未完全恢复下,阿托伐他汀干预后HSP22及TNF-α的表达均降低,通过何种机制实现的亦有待进一步探索。
本研究属于观察性探索,首次发现高脂血症大鼠主动脉HSP22表达升高,阿托伐他汀的干预可降低HSP22的表达。本研究的对象为SD大鼠,形成的高脂血症中TG水平变化不明显,分析可能与外源性TG摄取后在血液中主要以乳糜微粒形式存在、代谢较快有关。参照前人的造模方法成功复制高脂血症模型,但未形成典型的动脉粥样硬化病变,大鼠动脉硬化以血管的钙化病变为主要表现,形成了Monckeberg型动脉硬化,研究提示大剂量的维生素D3可能通过诱导平滑肌细胞氧化应激,加速平滑肌细胞向成骨细胞转化等复杂机制促进血管钙化病变形成[15]。本研究中主动脉HSP22及TNF-α的阳性表达均成线状或点状分布,具体机制尚不明确,分析可能与血管钙化病变形成,管壁中正常的细胞被钙化物质取代有关。故后续进行HSP22在高脂血症中的具体机制研究时需进一步完善研究方案,减少可能的干扰因素。所选用的动物数量偏少,可能对实验结果有一定影响。
[参 考 文 献]
[1]KimMV,Seit-NebiAS,MarstonSB,etal.SomepropertiesofhumansmallheatshockproteinHsp22 (H11orHspB8)[J].BiochemBiophysResCommun, 2004, 315(4):796-801.
[2] Zhu W, Roma P, Pirillo A, Angela P, et al. Human endothelial cells exposed to oxidized LDL express hsp70 only when proliferating[J]. Arterioscler Thromb Vasc Biol, 1996, 16(9):1104-1111.
[3]Ghayour-MobarhanM,LambDJ,VaidyaN,etal.Heatshockproteinantibodytitersarereducedbystatintherapyindyslipidemicsubjects:apilotstudy[J].Angiology, 2005, 56(1):61-68.
[4] Uyy E, Ivan L, Boteanu RM, et al. High-fat diet alters protein composition of detergent-resistant membrane microdomains[J]. Cell Tissue Res, 2013, 354(3):771-781.
[5] 赵 娟,李相军,孙 波,等. 维生素D3联合高脂饲料建立大鼠动脉粥样硬化模型[J]. 实用医学杂志,2009, 25(21):3569-3571.
[6] Xu Q. Biomechanical-stress-induced signaling and gene expression in the development of arteriosclerosis[J]. Trends Cardiovasc Med, 2000, 10(1): 35-41.
[7]XuQ.Disturbedflow-enhancedendothelialturnoverinatherosclerosis[J].TrendsCardiovascMed, 2009, 19(6):191-195.
[8] Ivan L, Antohe F. Hyperlipidemia induces endothelial-derived foam cells in culture[J]. J Recept Signal Transduct Res, 2010, 30(2):106-114.
[9]BayramgurlerD,KarsonA,YazirY,etal.Theeffectofetanerceptonaorticnitricoxide-dependentvasorelaxationinanunpredictablechronic,mildstressmodelofdepressioninrats[J].EurJPharmacol,2013, 710(1-3):67-72.
[10] Stintzing S, Ocker M, Hartner A, et al. Differentiation patterning of vascular smooth muscle cells (VSMC) in atherosclerosis[J]. Virchows Arch, 2009, 455(2):171-185.
[11]ChuWM.Tumornecrosisfactor[J].CancerLett, 2013, 328(2):222-225.
[12] Baigent C, Keech A, Kearney PM, et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins[J]. Lancet, 2005, 366(9493):1267-1278.
[13]BeowskiJ,A.ModulationofH2Smetabolismbystatins:anewaspectofcardiovascularpharmacology[J].AntioxidRedoxSignal, 2012, 17(1):81-94.
[14] Zhang R, Niu H, Wang N, et al. Daming capsule restores endothelial dysfunction induced by high-fat diet[J]. BMC Complement Altern Med, 2012, 12:21
[15]McCartyMF,DiNicolantonioJJ.Themolecularbiologyandpathophysiologyofvascularcalcification[J].PostgradMed, 2014,126(2):54-64.

