葡萄多酚对雨蛙肽诱导的急性胰腺炎胰腺组织的保护作用*
鱼毛毛, 刘金姣, 王雨楠, 连 冠, 王宇辉, 刘国庆, 祁 荣
(北京大学心血管研究所,分子心血管学教育部重点实验室,北京 100191)
急性胰腺炎(acutepancreatitis,AP)是由于胰腺分泌的消化酶自我消化胰腺及其周围组织而导致的严重的急性炎症反应[1],并可能继发一系列的多器官功能障碍,是临床上危急重症中较难治疗的疾病之一[2]。AP的发病机制非常复杂,其发生发展受多种因素影响[3],其中胰酶活化以及炎症介质、细胞因子和氧自由基大量产生引发机体超强的炎症反应是造成AP早期病理损害的主要机制。此外,AP时细胞膜的结构和功能遭到损害,引起和(或)加重细胞内游离Ca2+水平的增高,从而导致胰腺腺泡细胞凋亡也是AP发展的一个重要机制[4]。
In following years, many of the original colonists celebrated the autumn harvest with a feast of thanks.
雨蛙肽(caerulein)是胆囊收缩素(cholecystokinin,CCK)的类似物,小鼠腹腔过量给予雨蛙肽刺激,可以引起类似于人类急性胰腺炎疾病时的生化及病理生理改变[5-6]。因此,雨蛙肽诱导的急性胰腺炎小鼠模型对临床研究急性胰腺炎的发病机制、病理过程、诊断及药物干预治疗效果等方面有重要意义。
葡萄多酚(grapepolyphenol,GP)是从葡萄中提取的天然植物多酚类活性物质,广泛存在于葡萄的皮、籽、果肉中,主要成分包括表儿茶酸等酚酸类、黄烷醇类、花色苷类、黄酮醇类和缩聚单宁等物质;其中含量最高的为原花色苷,可达80%~85%[7]。在众多植物多酚中,以葡萄多酚清除自由基能力最强,其有效成分的抗氧化能力为维生素E的 50倍,是维生素C的20倍左右,是迄今为止发现的最高效的抗氧化剂之一[8]。葡萄多酚还有保护心肌细胞[9]、降低血清胆固醇[10]、保护血管内皮不受损伤[11]、防癌抗癌[12]、抗疲劳、抗炎、抗突变等生物活性。本研究旨在研究葡萄多酚对雨蛙肽诱导的小鼠急性胰腺炎的保护作用,并探讨可能的机制。
材 料 和 方 法
1 动物
2月龄雌性ICR小鼠,体重约25 g,由北京大学医学部实验动物部提供。所有小鼠均在12 h光照、12 h 黑暗的标准周期下,于无菌设备中饲养,自由进食及饮水。实验方案经北京大学医学部实验动物伦理管理委员会批准。
2 主要试剂
葡萄多酚由新疆石河子西部牧业提供;Caerulein、TMB 和DEPC 购自Sigma;α-淀粉酶测定试剂盒购自北京中生北控生物科技股份有限公司;动物组织总RNA Trizol提取液购自北京鼎国昌盛生物技术有限公司;TransScript First-Strand cDNA Synthesis Supermix购自北京全式金生物技术有限公司;Eva Green qPCR Master Mix购自ABM;引物由北京诺赛基因组研究中心合成;Mac-2抗体(rabbit polyclonal IgG)购自Santa Cruz;兔二步法检测试剂盒、DAB显色液均购自北京中杉金桥生物技术有限公司。
我国历史上设置时间最长的图书管理机构为秘书监或秘书省。据史料记载,我国自东汉延熹二年(公元159年)开始,设置专门掌管朝廷典籍与藏书整理、编校工作的机构秘书监或秘书省,至洪武十三年(1380年),明太祖撤销秘书监为止,历代沿袭了1200余年。
3 主要方法
夏天一身汗、冬天一身霜,晴天一身土、雨天一身泥。简短几句话道出了养路工作的艰辛。他虽然身在中层领导岗位,仍然保持着养路工人的作风。为了保证公路通畅,他同养路工人们一样,冬天,不畏严寒,除雪保畅;夏天,不惧酷暑,奋战一线,真心守护着公路,挥洒着青春和汗水。夏季工作,他迎着初升的太阳,上路巡检,安排工人处置病害。中午气温达到零上30多度,汗水浸透了橘黄色的工作服,艰难困苦并没有吓倒他,他带领工人们以苦为乐、以路为业,用忘我的奉献精神战胜了困难,铺平了道路。工作带给他无尽的欢乐,丰富了他奋进的心灵,鞭策他更加奋进、更加执著。
由表3可知,“小叶茼蒿”叶片的SPAD值x与叶绿素b含量y(单位:mg/g,下同)之间的相关性均表现为极显著性差异,“大叶茼蒿”叶片SPAD值x与叶绿素b含量y(单位:mg/g,下同)之间的相关性则较差。其中“小叶茼蒿”的最佳函数模型是对数函数y=.5596Ln(x)-1.8316(r=0.845**),“大叶茼蒿”的最佳函数模型是线性函数 y=0.0009x+0.2058(r=0.065)。
3.1.2 加大资金投入,丰富产品结构。在旅游业还没发展的时候,张家界主要以发展第一产业为主,第二三产业发展缓慢。在工业基础薄弱的背景下,资金不足、基础设施落后,导致第三产业的发展缺乏保障。生态旅游产品从规划设计到投入实施都需要强有力的资金支持,城市化发展水平滞后成为制约张家界生态旅游业发展的一个瓶颈因素。同时,由于资金的短缺,导致旅游区基础设施发展滞后,高品质旅游接待设施数量少、餐饮业缺乏本地特色、购物环境不良、旅游公共服务不达标。以上综合因素导致旅游产品缺乏良好的孵化环境,高品质的生态产品没有扎根的土壤。
3.2急性胰腺炎小鼠模型的建立 在药物预处理小鼠的第7 d开始造模。造模前,所有实验小鼠自由饮水条件下禁食12 h。AP组以及GP预处理AP组小鼠腹腔注射caerulein(50 μg/kg)的生理盐水溶液,每 h 1次,连续注射7次。NC组小鼠同法注射生理盐水。予第1次注射后24 h处死小鼠,取胰腺组织,分别用于病理形态学及炎症因子、氧化应激标志分子表达的研究。取肺组织,用于髓过氧化物酶(myeloperoxidase,MPO)活性的测定。
与NC组相比,AP组小鼠的胰腺组织HO-1、SOD-1、SOD-2和NOX-2 mRNA表达上调,其中SOD-1和NOX-2的上调有显著差异(P<0.05,P<0.01),见图5。GP预处理AP组小鼠的胰腺组织氧化应激分子SOD-1、SOD-2和NOX-2 mRNA表达较AP模型组有明显的下调(P<0.05,P<0.05,P<0.01)。结果表明,葡萄多酚能够明显下调AP时氧化应激水平。
各组小鼠的胰腺组织病理切片HE染色结果见图2。NC组小鼠胰腺形态结构完好,无炎症改变。与NC组相比,AP组小鼠胰腺组织有明显的水肿改变,小叶间隙增宽、结构紊乱,腺泡细胞局限性或广泛性坏死,小叶间及坏死灶内均有大量炎症细胞浸润; GP预处理AP组小鼠胰腺组织的水肿,腺泡细胞的空泡、坏死,以及炎症细胞浸润较AP模型组明显减轻。
3.5胰腺组织巨噬细胞浸润的观察 用免疫组化法检测胰腺组织中巨噬细胞的浸润情况,选择Mac-2分子作为巨噬细胞表达的标志分子。3%H2O2封闭胰腺切片的内源性过氧化物酶,10%正常羊血清孵育1h封闭。滴加抗Mac-2 Ⅰ抗(1∶200),4 ℃冰箱中过夜。PBS缓冲液振荡清洗切片3次后,滴加辣根过氧化物酶标记的Ⅱ抗,DAB显色,苏木精复染,常规封片。显微镜下观察,棕染的细胞即为浸润的巨噬细胞。

表1 胰腺组织病理评分标准
HPF: high-power field.
3.6肺脏组织MPO活性的测定 参照文献[15]的方法,采用分光光度分析法测量MPO的活性。将小鼠冰冻肺组织匀浆,应用BCA法测量不同匀浆样品的蛋白浓度。将匀浆样品离心(16 000×g,15 min),收集得到的沉淀物用磷酸盐(pH 5.4,含0.5% HETAB和10 mmol/L EDTA)重悬,再次离心后得到上清。以TMB为底物,加入工作液,于650 nm处读取吸光度(A)值,得到的结果用蛋白浓度校正,即为 MPO的活性。
4 统计学处理
各组小鼠胰腺组织巨噬细胞浸润情况见图3。与NC组相比,AP组小鼠胰腺组织的小叶间隙以及坏死灶内有大量的巨噬细胞浸润。GP预处理AP组小鼠的胰腺组织均未见明显的巨噬细胞浸润。结果表明,葡萄多酚能够减轻AP时巨噬细胞对胰腺组织的浸润。
结 果
1 胰腺相对重量
对各组小鼠的胰腺切片进行病理评分,结果显示:与NC组相比,AP模型组水肿、炎症、坏死、空泡等指标的评分以及总分均显著升高(P<0.05,P<0.01,P<0.05, P<0.01,P<0.01),见图2,提示造模成功。与AP组相比,GP预处理AP组小鼠的胰腺组织的水肿、炎症以及空泡的评分明显降低(P<0.05),但坏死和病理总评分没有明显变化。结果表明,GP能够显著改善AP时胰腺的病理损伤,表现在减轻胰腺水肿、空泡,减少炎症细胞对胰腺的浸润。

Figure 1. Changes of relative pancreas weight of mice from each group.Mean±SD.n=7.
2 胰腺病理损伤
3.4胰腺组织炎症因子和氧化应激标志物表达测定 取小鼠胰腺组织约50 mg,于2 mL RNA Trizol提取液中匀浆,提取胰腺组织总RNA。利用TransScript First-Strand cDNA Synthesis Supermix试剂盒将总RNA 反转录,获得cDNA。实时定量PCR(real-time quantitative PCR)测定各胰腺组织中的IL-1β、TNF-α、MCP-1 和TGF-β1等炎症因子以及NOX-4、SOD-1 mRNA 表达水平。每个样品重复3 次,并以SYBR Green 作为荧光剂,结果以18S rRNA 的表达水平标准化。
现在,社会正处于一种“后买方时代”,在这种消费环境中,消费者的观念一定会对企业的生产产生一定的影响力。从环保的角度看,很多高污染、高消耗、高排放的产品会被消费者拒绝,这样的产品在市场上自然没有需求。[3]企业在这一大背景下,想要在市场上占据较大的市场份额就必须通过科技创新,替换掉不具备竞争力的产品,同时,升级整个产业链,主动寻求合作伙伴,力求将手头的各种资源进行优化配置和有效利用。另外,企业还可以通过自身产品的影响力,借助新闻媒体的宣传手段,积极引导消费者改变原有的消费习惯和模式,适应时代的变化。
各组小鼠的胰腺相对重量见图1。与NC组相比,AP组和GP预处理AP组的小鼠胰腺相对重量有增加趋势,但2组间没有显著差异,表明GP并不影响AP时胰腺的相对重量。
所以从这个角度讲,我就觉得这部戏格局确实小了。就是说我们一定要把历史上的改革、工业革命与今天中国所面临的现实(这个现实既有国际的形势,也有国内工业发展存在的问题)和今天改革开放工业革命所肩负的使命联系起来。不见得写得那么直白,但是这个精神一定要有,要站在今天这个历史高度来看当年的改革开放。现在多少还有一点就当年的改革开放写那一段历史现实的局限的问题,我觉得思路还要打开。

Figure 2. Morphology and pathological scores of pancreatic tissues of the mice with different treatments (HE staining,×100). Mean±SEM.n=7.*P<0.05,**P<0.01 vs NC; #P<0.05 vs AP.
3 胰腺组织巨噬细胞浸润情况
采用SPSS统计软件处理数据。数据以均数±标准误(mean±SEM)表示。组间差异比较采用单因素方差分析和SNK-q检验。组织学评分数据的组间比较采用Mann-WhitneyU秩和检验。以P<0.05为差异有统计学意义。
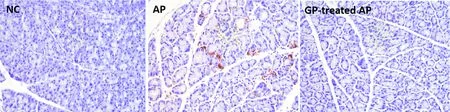
Figure 3. Macrophage infiltration in the pancreatic tissues of mice from each group (Mac-2 immunohistochemical staining, ×100).
4 胰腺组织炎症因子的表达
与NC组相比, AP组小鼠的胰腺组织炎症因子MCP-1、TNF-α和IL-1β的mRNA表达上调,其中MCP-1和TNF-α的上调有显著差异(P<0.05),见图4。GP预处理AP组小鼠的胰腺组织炎症因子MCP-1和TNF-α mRNA表达较AP组有明显的下调(P<0.05)。结果表明,葡萄多酚能够明显下调AP时炎症因子的升高。
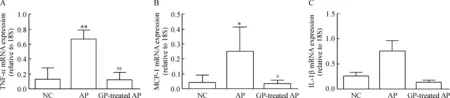
Figure 4. The expression of inflammatory factors, TNF-α (A), MCP-1 (B) and IL-1β (C), in the pancreatic tissues of the mice with different treatments.Mean±SEM.n=7.*P<0.05, **P<0.01 vs NC; #P<0.05, ##P<0.01 vs AP.
5 胰腺组织氧化应激分子的表达
3.3胰腺组织病理学评分 对取得的各组小鼠胰腺组织进行福尔马林缓冲液固定、石蜡包埋和切片。对切片进行HE染色。按照病理学评分标准[13-14](表1),对各胰腺组织的切片进行双人、双盲的病理评分。对评分结果进行统计学分析。
3.1药物预处理 ICR雌性小鼠共21只,随机分为正常对照组(NC组)、AP模型组(AP组)和药物处理AP组(GP预处理AP组),每组7只。各组小鼠给予相应的处理:GP预处理AP组灌胃给予GP水溶液1.5 g/kg, NC组和AP组同法给予生理盐水。各组均每天给药1次,连续给药7 d。同时给予普通饲料(chow diet)喂饲。
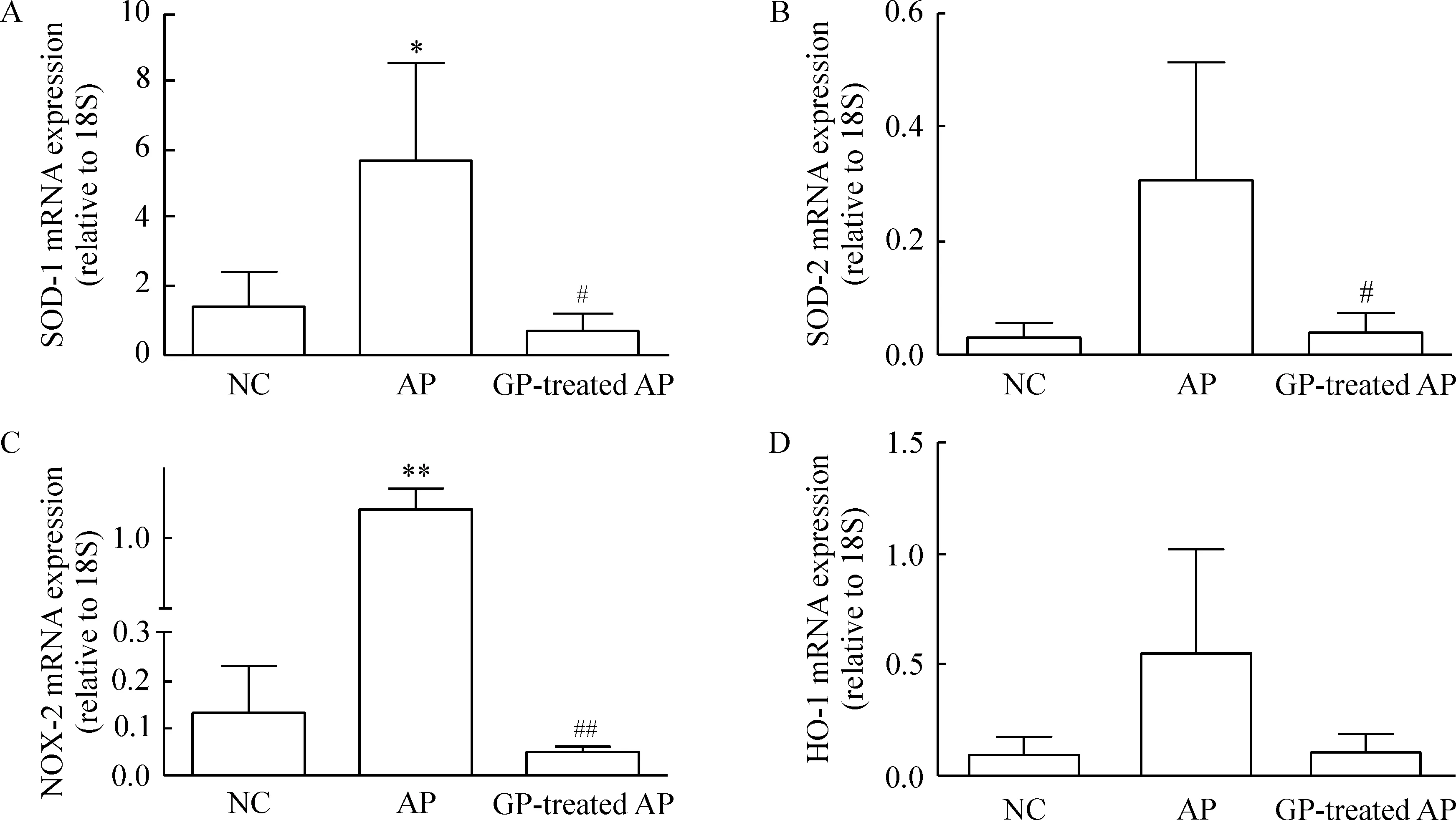
Figure 5. The expression of oxidative stress markers, SOD-1 (A), SOD-2 (B), NOX-2 (C) and HO-1 (D), in the pancreatic tissues of the mice with different treatments.Mean±SEM. n=7.*P<0.05,**P<0.01 vs NC; #P<0.05,##P<0.01 vs AP.
6 肺脏的MPO活性变化
与NC组相比,AP组小鼠肺脏组织MPO的活性明显升高(P<0.05)。GP预处理AP组小鼠肺脏组织MPO的活性较AP组显著降低(P<0.01),见图6。结果表明,葡萄多酚能够明显降低AP时中性粒细胞对远端组织的浸润。
讨 论
AP 是发生在胰腺组织的急性炎症性疾病,有时亦累及胰腺临近脏器和远隔器官,其病理生理过程与许多因素有关,包括胰腺消化酶的激活、炎症介质、细胞因子的大量产生等[16]。Caerulein是CCK的类似物,有研究揭示它可与胰腺细胞的CCK-A低亲和受体结合,引起胰酶分泌,大剂量时可诱导AP 发生,被广泛应用于AP的实验研究中[17]。本实验研究结果表明,经caerulein诱导建立的AP模型,胰腺组织出现明显的病理改变,包括水肿,腺泡细胞的空泡、坏死,以及炎症细胞浸润等,与人类急性胰腺炎发病时胰脏组织病理改变相似。此外,caerulein诱导的AP模型小鼠胰腺组织炎症因子MCP-1、TNF-α和氧化应激分子SOD-1、SOD-2、HO-1、NOX-2的表达水平明显升高。虽然SOD-1、SOD-2以及HO-1被广泛认为是抗氧化分子,对多种疾病具有保护作用。但是我们的研究发现,在caerulein诱导的AP模型上,上述3个分子的表达都是显著上调的,这可能是由于AP时大量活性氧物质产生,抗氧化分子的表达代偿性增加。同时我们的研究结果显示NOX-2的表达显著增加,而NOX-2是活性氧产生过程中一个重要的NADPH氧化酶,这意味着AP时活性氧的大量产生是确定的,这也支持了抗氧化分子代偿性增加的结论。
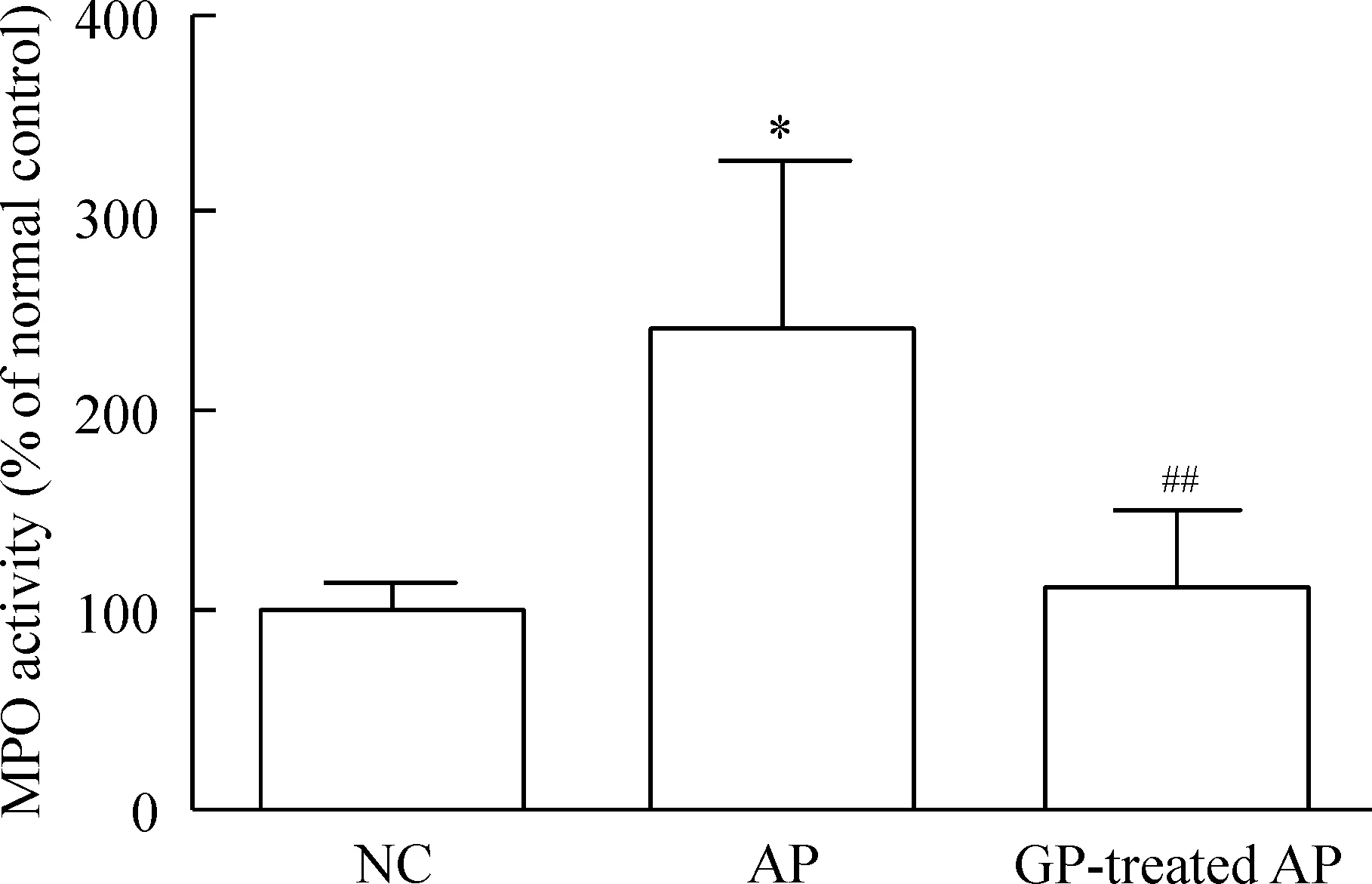
Figure 6. MPO activity in the lung tissues of the mice with different treatments.Mean±SEM.n=7.*P<0.05 vs NC; ##P<0.01 vs AP.
炎症在AP发生发展的过程中起着非常关键的作用,也是影响预后的重要指标。AP时,细胞因子通过相互交叉、相互代偿的炎症信号转导网络作用,触发炎症介质的级联效应,进而引起炎症扩布,引起全身炎症反应,胰腺组织受损,病情加重。在众多细胞因子中,TNF-α处于核心地位,主要由免疫细胞产生,是炎症反应的始动因子,作为关键促炎因子与NF-кB相互作用,可在体内启动连锁反应,募集中性粒细胞,产生过量的炎症因子及氧自由基,在AP的病理生理发展过程中起到重要作用[18]。MCP-1作为AP 早期的主要炎症介质之一,由腺泡细胞和浸润的白细胞产生,同时在血清中有显著升高,不仅能够募集单核巨噬细胞到胰腺局部加重炎症,而且也能使巨噬细胞移行,损伤肺脏等远隔器官,在AP的炎症损伤和肺损伤中起着重要的作用[19]。文献研究表明,将MCP-1阻断、敲除或给予MCP-1的抑制剂后,都可以有效改善AP的各项病理指标,包括胰腺病变,肺损伤等方面[20-22]。因此,通过对炎症反应通路中关键细胞因子(TNF-α和MCP-1)的调控,遏制炎症介质进一步激活,理论上能够减轻AP引起的炎症反应。多酚类物质因其独特的结构成为非常理想和有效的抗炎物质。有实验研究表明[23],茶多酚作为抑制NF-κB 活化的抗氧化剂,通过调控前炎症因子的活化,抑制炎症细胞因子的分泌,发挥抗炎作用,进而改善和减轻AP的严重程度。本研究所应用的葡萄多酚也起到了类似的作用。治疗组TNF-α以及MCP-1 mRNA表达水平较AP模型组均显著降低,表明葡萄多酚能够明显抑制AP时炎症因子TNF-α、MCP-1的产生,从而减轻机体的炎症,达到抑制AP进展的作用。我们的实验结果还表明,葡萄多酚预处理组胰腺组织的巨噬细胞浸润较AP模型组明显减少。这和MCP-1的结果是一致的,趋化因子的表达减少,导致胰腺组织局部的巨噬细胞浸润也减少。
AP时,浸润的炎症细胞和腺泡细胞产生过量的活性氧物质,其中过氧化氢、超氧化物是造成细胞损害的主要因素。活性氧不但可通过破坏细胞膜,裂解蛋白质及核酸导致细胞坏死,而且可以损伤毛细血管内皮,增加血管通透性,还可激活补体,促进白细胞黏附、活化和迁移,引起微循环障碍,加重胰腺损伤。此外,活性氧物质可以通过诱导IκB-α磷酸化激活NF-κB,上调炎症介质表达[24],发挥协同作用,触发共同的信号转导通路,导致炎症的级联放大,最终加重胰腺组织和远隔器官的损伤。研究表明,抗氧化剂能保护细胞核DNA、膜脂质、胞质蛋白等生物大分子免受氧化损伤,能有效地清除多种自由基,减轻多种物质诱导的多种组织的氧化应激反应[25],因此能够有效地抑制AP时的氧化应激水平,从而保护胰腺组织不受损伤。葡萄多酚中的有效成分具有超强的抗氧化能力,在很多领域都有广泛的应用,比如抗衰老、抗肿瘤、抗动脉粥样硬化、改善视觉功能等。本研究结果显示,与AP模型组相比,葡萄多酚能够显著降低氧化应激分子SOD-1、SOD-2和NOX-2的mRNA表达水平。由此可见,葡萄多酚的抗氧化活性是其减轻AP病理程度的一个重要方面。
远隔器官的损伤,例如肺损伤,是急性胰腺炎非常危险的并发症,也是影响AP结局和预后的关键因素。肺损伤主要是由于中性粒细胞、单核巨噬细胞、淋巴细胞的激活和移行,引发炎症介质和氧化应激分子大量产生而导致的。本研究结果表明,给予葡萄多酚预处理后,小鼠肺脏组织的MPO活性较AP模型组显著降低,提示肺部中性粒细胞的浸润减少,炎症减轻,肺损伤程度较轻。这一结果也与炎症因子、氧化应激分子表达水平降低的结果是一致的。
本研究所采用的葡萄多酚剂量为1.5 g/kg。该剂量的确定是基于本研究组前期对葡萄多酚降脂和抗动脉粥样硬化作用的研究结果。我们发现该剂量条件下,葡萄多酚对于小鼠不仅安全,而且降脂和抗动脉粥样硬化的效果最为显著。因而,在本研究中我们采用该剂量研究葡萄多酚对雨蛙素诱导的小鼠急性胰腺炎的作用。结果表明,葡萄多酚能够明显减轻雨蛙素诱导的急性胰腺炎时小鼠胰腺组织的损伤。
综上所述,葡萄多酚具有抗炎和抗氧化作用,通过下调炎症因子和氧化应激分子的表达,减轻AP时胰腺的病理改变程度,减少胰腺组织巨噬细胞的浸润,降低肺组织MPO活性等,最终达到急性胰腺炎时对胰腺组织的保护作用。
[参 考 文 献]
[1] 张化宇, 唐 寅, 常 青, 等.小鼠对雨蛙肽诱发急性胰腺炎易感性的品系差异[J]. 中国病理生理杂志, 2011, 27(11): 2170-2174.
[2] 田 雨. 急性胰腺炎的临床表现[J]. 中国社区医师, 2009, 25(2): 8-9.
[3] 杨卫振,脱红芳,彭彦辉,等.EGCG对雨蛙素诱导的小鼠急性胰腺炎的治疗作用[J]. 实用医学杂志, 2012, 28(24): 4061-4064.
[4] 李永渝, 林旭红. 急性胰腺炎发病机制及相关治疗的研究进展[J]. 中国病理生理杂志, 2010, 26(5): 1029-1032.
[5] 李全生, 陈晓理, 周总光, 等.雨蛙素腹腔注射法建立小鼠急性坏死性胰腺炎模型的实验研究[J]. 中国普外基础与临床杂志, 2004, 11(4): 335-337.
[6] 吕 帅, 冯佳燕, 高志荣, 等. LPS和雨蛙肽诱导大鼠离体胰腺组织损伤并抑制HSP60蛋白的变化[J]. 中国病理生理杂志, 2010, 26(6): 1146-1150.
[7] 吕禹泽. 葡萄多酚的抗氧化活性[J]. 食品科学, 2006, 27(12):213-216.
[8] Bagchi D, Garg A, Krohn RL, et al. Oxygen free radical scavenging abilities of vitamins C and E, and a grape seed proanthocyanidin extractinvitro[J]. Res Commun Mol Pathol Pharmacol, 1997, 95(2): 179-189.
[9]DuY,GuoH,LouH.Grapeseedpolyphenolsprotectcardiaccellsfromapoptosisviainductionofendogenousantioxidantenzymes[J].JAgricFoodChem, 2007, 55(5):1695-1701.
[10] Ngamukote S, Mäkynen K, Thilawech T, et al. Cholesterol-lowering activity of the major polyphenols in grape seed[J]. Molecules, 2011, 16(6): 5054-5061.
[11] 高维明, 张会临. 山葡萄多酚对血管内皮细胞损伤的保护作用[J]. 中国公共卫生, 2006, 2(6): 715-716.
[12] 孙向军, 梁志强, 陈秋宇 .葡萄籽和皮萃取物对小鼠乳腺癌细胞迁移的影响[J]. 食品科学, 2012, 33(1): 239-243.
[13]SchmidtJ,LewandrowsiK,WarshawAL,etal.Morphometriccharacteristicsandhomogeneityofanewmodelofacutepancreatitisintherat[J].IntJPancreatol, 1992, 12(1): 41-51.
[14] Grewal HP, Mohey el Din A, Gaber L, et al. Amelioration of the physiologic and biochemical changes of acute pancreatitis using an anti-TNF-alpha polyclonal antibody[J]. Am J Surg, 1994, 167(1): 214-219.
[15]LaukkarinenJM,VanAckerGJ,WeissER,etal.AmousemodelofacutebiliarypancreatitisinducedbyretrogradepancreaticductinfusionofNa-taurocholate[J].Gut, 2007, 56(11): 1590-1598.
[16] Pandol SJ, Saluja AK, Imrie CW, et al. Acute pancreatitis: bench to the bedside[J]. Gastroenterology, 2007, 132(3): 1127-1151.
[17]NakadaS,TsuneyamaK,KatoI,etal.Identificationofcandidategenesinvolvedinendogenousprotectionmechanismsagainstacutepancreatitisinmice[J].BiochemBiophysResCommun, 2010, 391(3): 1342-1347.
[18] Malleo G, Mazzon E, Siriwardena AK, et al. Role of tumor necrosis factor-alpha in acute pancreatitis: from biological basis to clinical evidence[J]. Shock, 2007, 28(2): 130-140.
[19]RauB,BaumgartK,KrügerCM,etal.CC-chemokineactivationinacutepancreatitis:enhancedreleaseofmonocytechemoattractantprotein-1inpatientswithlocalandsystemiccomplications[J].IntensiveCareMed, 2003, 29(4): 622-629.
[20] Ishibashi T, Zhao H, Kawabe K, et al. Blocking of monocyte chemoattractant protein-1 (MCP-1) activity attenuates the severity of acute pancreatitis in rats[J]. J Gastroenterol, 2008, 43(1):79-85.
[21]ZhouGX,ZhuXJ,DingXL,etal.ProtectiveeffectsofMCP-1inhibitoronaratmodelofsevereacutepancreatitis[J].HepatobiliaryPancreatDisInt, 2010, 9(2): 201-207.
[22] Frossard JL, Lenglet S, Montecucco F, et al. Role of CCL-2, CCR-2 and CCR-4 in cerulein-induced acute pancreatitis and pancreatitis-associated lung injury[J]. J Clin Pathol, 2011, 64(5): 387-393.
[23]BabuBI,MalleoG,GenoveseT,etal.Greenteapolyphenolsamelioratepancreaticinjuryincerulein-inducedmurineacutepancreatitis[J].Pancreas, 2009, 38(8):954-967.
[24] 王艳红, 冯志杰, 郝 晓. 急性胰腺炎与氧化应激[J]. 世界华人消化杂志, 2007, 15(11): 1266-1272.
[25]MaQ,ZhangM,WangZ,etal.Thebeneficialeffectofresveratrolonsevereacutepancreatitis[J].AnnNYAcadSci, 2011, 1215: 96-102.

