柴胡疏肝散通过抗氧化反应对二氯二丁基酯联合乙醇诱发小鼠胰腺纤维化的防治作用*
张晓芹, 许小凡, 姜婷婷, 陈 瑜, 刘 芳, 史迎莉, 李 涛, 顾 杰, 张 红△
(陕西中医学院 1基础医学院病理生理学教研室, 2医学科研实验中心,陕西 西安 712046)
慢性胰腺炎(chronic pancreatitis,CP)是由于长期饮酒或胆道疾患引起的胰腺实质局限性或弥漫性的慢性炎症,胰腺腺泡和胰岛细胞会出现不可逆性损害、萎缩或消失,继而纤维化,引起不同程度的胰腺内、外分泌功能障碍,严重影响患者的生活质量[1]。有效遏制胰腺纤维化,是当前临床上急需解决的难题。柴胡疏肝散是临床上用于治疗急、慢性胰腺炎的常用方剂,但是该方能否抑制胰腺纤维化及其相关机制目前尚不清楚[2]。本课题采用尾静脉注射二氯二丁基酯(dibutyltin dichloride, DBTC)联合10%乙醇饮用复制小鼠慢性胰腺炎模型[3],给予柴胡疏肝散灌胃,观察其对慢性胰腺炎小鼠胰腺丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase, SOD)的影响,及防治胰腺纤维化的作用,探讨柴胡疏肝散防治胰腺纤维化的作用及机制。
材 料 和 方 法
1 药品、试剂和仪器
DBTC购于Sigma-Aldrich;柴胡疏肝散由柴胡6 g、赤芍5 g 、枳壳5 g、陈皮6 g、川芎5 g、香附5 g、炙甘草3 g组成,购自陕西中医学院第一附属医院中药房,加水煎煮2次,过滤去除药渣,药液浓缩至70 mL(0.5 kg/L),分装后置于4 ℃保存备用。羊抗小鼠β-actin 单克隆抗体购于博奥森公司;羊抗小鼠I型胶原α1链(collagen type I alpha 1 chain, COLA1)多克隆抗体购于Santa Cruz;HRP标记的兔抗羊IgG、ECL发光试剂盒和即用型SABC免疫组化试剂盒购于博士德试剂公司;淀粉酶、SOD和MDA试剂盒购于南京建成生物研究所;其它为当地试剂公司提供的最高纯度化学试剂;酶标仪(Bio-Tek ELX808IU);Western blotting电泳转膜系统(Bio-Rad)。
2 动物、分组及造模
健康昆明小鼠120只(6~8周龄,体重20~28 g),雌雄各半,实验前置清洁级环境适应性饲养1周,常规饲料,常规饮水,保持室温在20~25 ℃,12 h昼夜交替,7 d后适应环境,用于实验研究。小鼠随机分为3组:空白组、模型组和治疗组(每组n=40)。空白组(尾静脉注射0.9%氯化钠溶液+正常饮水);模型组(尾静脉注射DBTC+饮10%乙醇);治疗组(尾静脉注射DBTC+饮10%乙醇+柴胡疏肝散)。各组分为造模前及造模后1周、2周、4周、8周5个时点(各时点n=8)。
DBTC 80 mg溶于30 mL无水乙醇,缓慢加入甘油10 mL,再添加生理盐水至50 mL,摇至清亮(1.6 g/L),经尾静脉一次性注射DBTC(8 mg/kg)后加饮10%乙醇饲喂造模。造模后第3天随机分为模型组和柴胡疏肝散治疗组,模型组给予常规饲料和10%乙醇饲喂复制慢性胰腺炎模型[3-4];柴胡疏肝散治疗组造模后72 h开始给予柴胡疏肝散浓缩液(0.5 kg/L)灌胃(生药6 g·kg-1·d-1),每天1剂,分别灌胃1周、2周、4周和8周, 治疗的同时给10%乙醇继续饲饮。空白组经尾静脉注射0.9%氯化钠溶液(50 μL/10 g体重),注射后常规饲料及饮水。
3 方法
3.1标本采集与检测 造模至相应时点麻醉处死动物,经下腔静脉取血,分离血清;完整摘除胰腺、称重,将一部分胰腺置于4%中性甲醛溶液浸泡固定,另一部分胰腺迅速置入液氮中,再转入-80 ℃冰箱,待提取蛋白行Western blotting检测。
3.2胰腺组织的病理学观察 一部分胰腺组织经脱水、石蜡包埋、切片,HE染色观察各组小鼠胰腺组织的形态学改变及纤维化程度。
3.3血清淀粉酶和血清透明质酸的检测 采用化学比色法检测血清淀粉酶的水平;采用ELISA法检测血清透明质酸的变化。
3.4Westernblotting检测胰腺组织COL1A1的表达 取胰腺组织50mg,加蛋白裂解液400μL匀浆,冰上放置30min,10 000r/min、4 ℃离心10min,提取上清液,采用BCA法进行蛋白定量后,用5×loadingbuffer将样品稀释至4g/L;以分子量18~94kD的marker为内参照,SDS-PAGE胶蛋白电泳,电转移至PVDF膜,封闭液(5%脱脂奶粉)中缓慢摇荡1h,用TBST洗脱,滴加Ⅰ抗[分别为β-actin(1∶1 000);COL1A1(1∶500)]至PVDF膜,4 ℃摇床上孵育过夜。TBST漂洗3次,每次5min。HRP标记的兔抗羊IgGⅡ抗(1∶1 000稀释),室温孵育1h。TBST漂洗3次,每次10min。ECL滴加于PVDF膜上,在暗盒中将X光片曝光,显影、定影后,根据marker的位置进行扫描与分析。
3.5酶化学法检测胰腺组织匀浆SOD活性和MDA的水平 取胰腺组织50 mg,加蛋白裂解液400 μL匀浆,制成组织匀浆,采用化学比色法检测每毫克组织蛋白中SOD活性和MDA水平。
4 统计学处理
数值用均数±标准差(mean±SD)表示,应用SPSS 10.0统计软件处理,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 胰腺组织的病理学变化
DBTC尾静脉注射联合饮用乙醇1 d后可见胰腺腺泡细胞肿胀, 间质有大量炎细胞浸润及少量出血,并可见胰腺腺泡不同程度的片状坏死;造模后1周可见胰腺明显肿胀, 大量炎症细胞浸润,胰管扩张并可见胰管上皮细胞坏死脱落。2周可见胰腺腺泡细胞明显萎缩、坏死,大量炎症细胞浸润,并出现胰腺实质的少量纤维化;造模后4周可见部分胰腺小叶内腺泡细胞消失,被大量纤维组织所取代,并见大量炎细胞浸润;8周可见多个胰腺小叶内的腺泡组织及胰岛消失,纤维组织广泛增生呈网格状分布。而柴胡疏肝散治疗组各时点胰腺的炎症损伤及纤维化程度明显减轻,见图1。
2 血清淀粉酶活性变化
DBTC尾静脉注射后1 d,血清淀粉酶的活性明显升高;联合饮用乙醇1周后,血清淀粉酶活性较造模1 d有所回落,但仍高于正常对照组;造模后2周、4周,血清淀粉酶维持在较高水平, 与对照组相比差异显著(P<0.01);柴胡疏肝散治疗组2周和4周血清淀粉酶活性明显下降,与相应时点模型组相比有显著差异 (P<0.05)。造模后8 周血清淀粉酶水平显著降低,与正常组小鼠相比有显著差异;而柴胡疏肝散治疗组8 周,血清淀粉酶活性没有出现明显下降,与模型组相比有显著差异(P<0.01),见图2。

Figure 1. The effect of Chaihushugansan on the pancreatic morphology of mice with chronic pancreatitis (CP) induced by DBTC plus ethanol (HE staining, ×100).

Figure 2. The effect of Chaihushugansan on the amylase activity in the serum of mice with chronic pancreatitis (CP). Mean±SD. n=8.△△P<0.01 vs control; *P<0.05,**P<0.01 vs CP.
3 血清透明质酸的变化
如图3所示,DBTC尾静脉注射联合饮用乙醇2 周、4 周后,血清透明质酸明显升高, 8 周后进一步升高,与对照组相比差异显著(P<0.01);柴胡疏肝散治疗组血清透明质酸明显降低,与相应时点模型组相比有显著差异 (P<0.01)。

Figure 3. The effect of Chaihushugansan on the hyaluronic acid level in the serum of mice with chronic pancreatitis (CP). Mean±SD. n=8.△△P<0.01 vs control; *P<0.05,**P<0.01 vs CP.
4 胰腺组织Ⅰ型胶原的表达
如图4所示,对照组小鼠胰腺未见Ⅰ型胶原的表达;DBTC尾静脉注射联合饮用乙醇1 周、4周和8周后胰腺Ⅰ型胶原的表达量明显增加;而柴胡疏肝散治疗组各个时点胰腺Ⅰ型胶原的表达量明显少于模型组(P<0.01)。

Figure 4. The expression of type I collagen in the pancreas following the development of chronic pancreatitis (CP). Mean±SD. n=3. △△P<0.01 vs control;**P<0.01 vs CP.
5 柴胡疏肝散对慢性胰腺炎小鼠不同时点胰腺组织匀浆SOD活性的影响
如图5所示,DBTC尾静脉注射联合饮用乙醇模型组,可见胰腺组织中SOD活性持续降低, 4周和8 周明显低于正常对照组(P<0.01)。经柴胡疏肝散治疗后,胰腺组织SOD活性下降的趋势减弱,至4 周、8 周胰腺组织SOD活性明显高于模型组,与相应时点模型组相比有显著差异(P<0.05)。
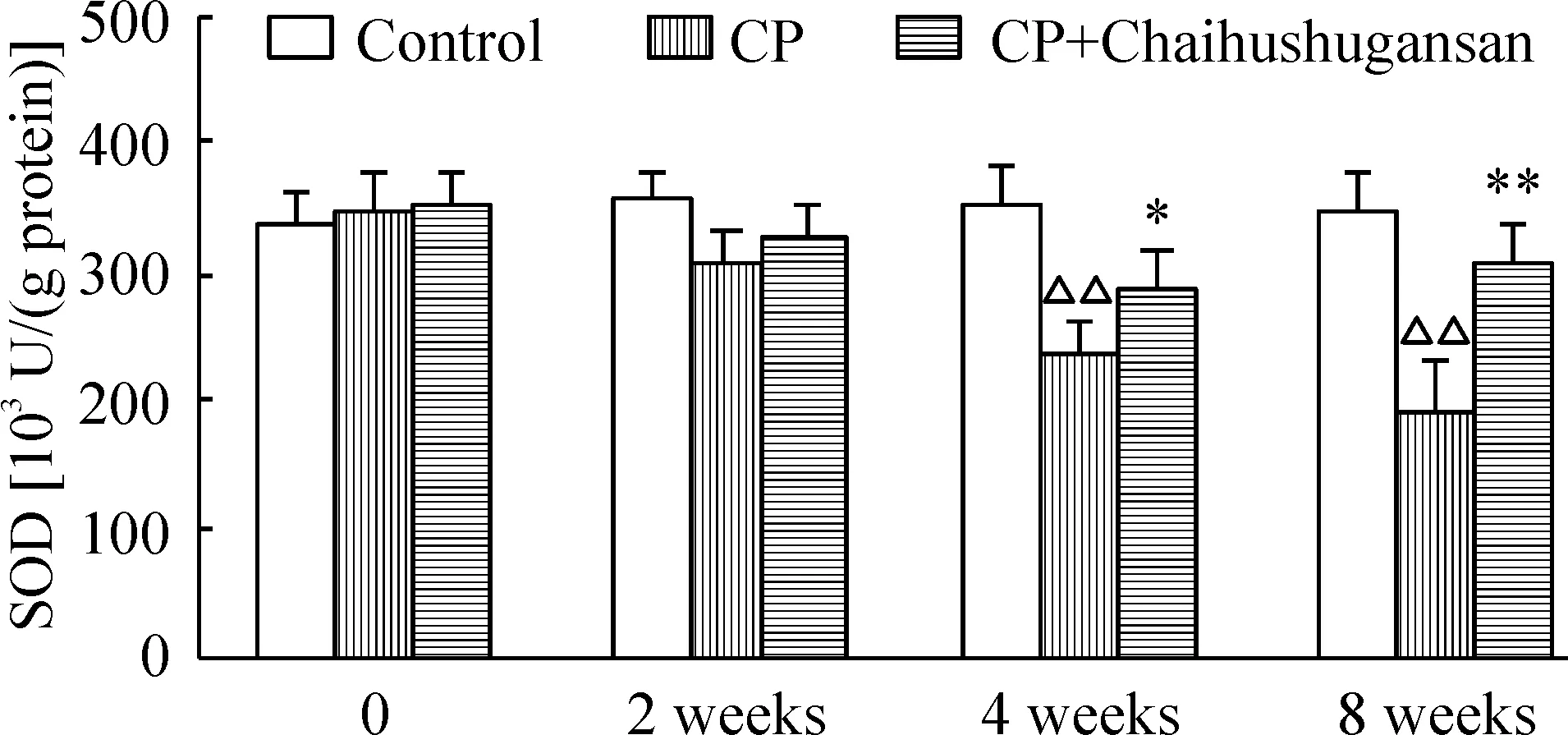
Figure 5. The effect of Chaihushugansan on the activity of SOD in the pancreas of mice with chronic pancreatitis (CP). Mean±SD. n=8. △△P<0.01 vs control; *P<0.05,**P<0.01 vs CP.
6 柴胡疏肝散对慢性胰腺炎小鼠不同时点胰腺组织匀浆MDA水平的影响
如图6所示,DBTC尾静脉注射联合饮用乙醇2 周、4 周和8周模型组中,随时间延长胰腺组织中MDA水平呈逐渐升高趋势,与正常组比有显著差异(P<0.01)。柴胡疏肝散治疗组MDA水平明显低于相应时点的模型组(P<0.05)。
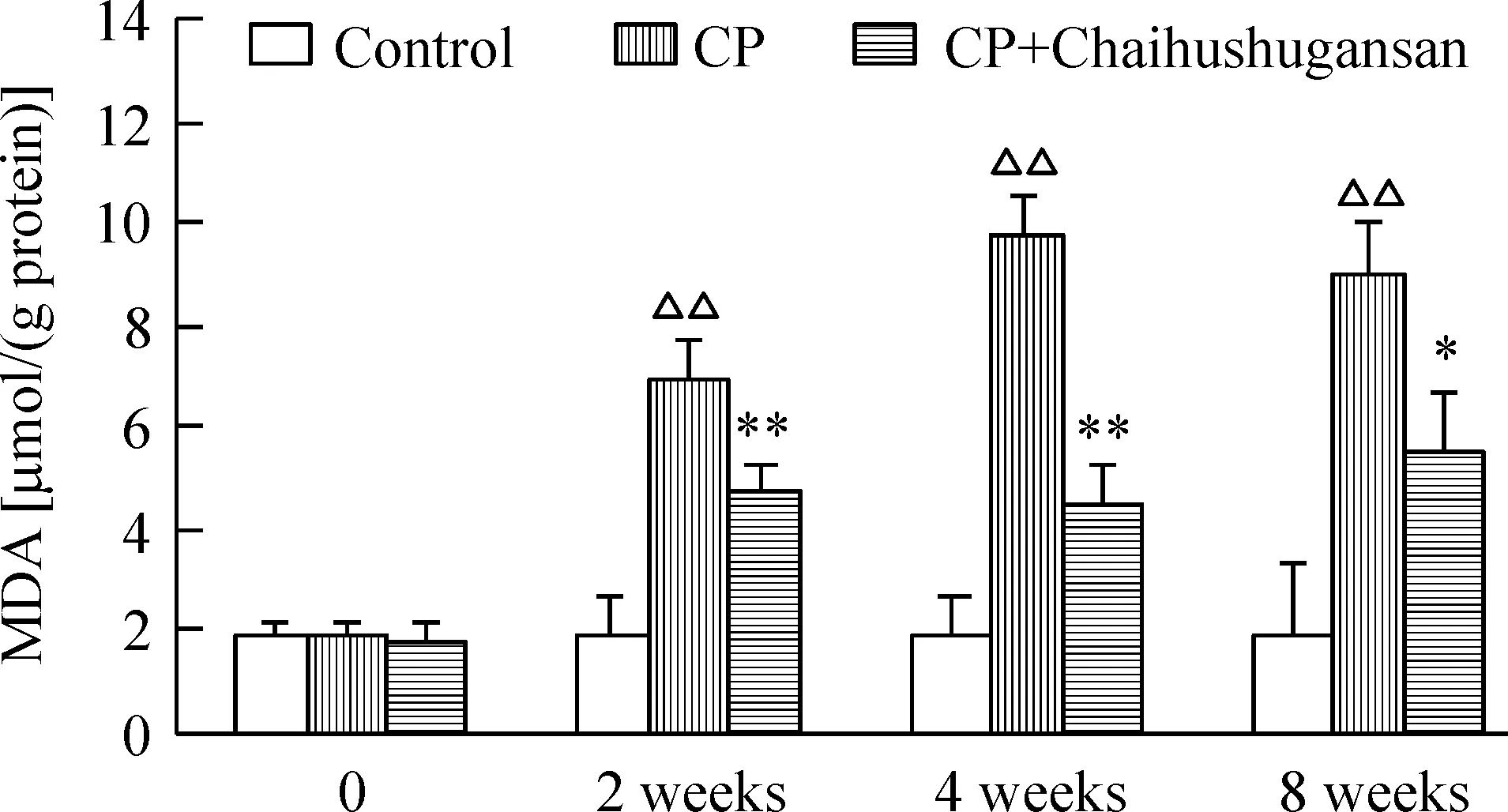
Figure 6. The effect of Chaihushugansan on the content of MDA in the pancreas of mice with chronic pancreatitis (CP). Mean±SD. n=8.△△P<0.01 vs control; *P<0.05,**P<0.01 vs CP.
讨 论
慢性胰腺炎虽然病因不同、起始步骤各异,但是持续进展的慢性炎症发展最终导致胰腺腺泡萎缩并逐渐被纤维组织所取代,进行性胰腺纤维化已被看作慢性胰腺炎主要的病理学特征[5]。
目前的研究发现,慢性胰腺炎的病因复杂,我国慢性胰腺炎以胆源性疾病引发的胆管狭窄、梗阻为主要病因,而慢性酒精中毒是西方国家慢性胰腺炎患者的主要病因,近年来酒精引发的慢性胰腺炎在我国也呈现增多趋势[6]。DBTC是脂溶性物质,尾静脉注射后在动物体内可经肝脏、胆囊排泄至胰管,引起胰管上皮细胞损伤和坏死增生,坏死的上皮细胞聚集进而造成胰胆管阻塞,类似临床上的胰、胆管阻塞[7]。Merkord等[3]采用DBTC复制大鼠慢性胰腺炎,同时在饮水中加入乙醇,发现乙醇可以加剧胰腺损伤的强度和进程。DBTC尾静脉注射联合饮用乙醇可以诱导大鼠慢性胰腺炎模型已经被多个实验所证实[3-4],但是由于小鼠的胆道解剖结构与大鼠有所不同[8],此种方法是否会诱发小鼠慢性胰腺炎,目前尚不清楚。我们的实验结果与人类慢性胰腺炎的特征性病理改变相类似[9],提示DBTC联合饮用乙醇可以成功复制小鼠慢性胰腺炎模型。
近来研究发现[10-11],氧化应激与慢性胰腺炎的发生存在密切的关系。MDA是氧自由基攻击生物膜不饱和脂肪酸的终产物,作为机体脂质过氧化的主要产物,其含量可间接反映机体细胞受氧自由基攻击的程度[11-12]。SOD是生物体内固有的天然活性蛋白,也是机体内唯一的以自由基为底物的酶类抗氧化剂,能有效清除人体内最主要的自由基,保护细胞免受自由基损伤[12]。
大量研究显示[13-14]:氧化应激可以促进细胞因子及黏附分子的释放,增强炎症细胞的黏附能力,导致炎症细胞在局部浸润、聚集、活化,引发局部炎性损伤。而局部浸润的炎症细胞不仅可以促进细胞因子的释放,而且可以促进局部的脂质过氧化反应。由此可见:氧化应激与炎症反应二者可以相互作用使慢性炎症得以持续、炎症损伤不断加强。另外有研究发现慢性胰腺炎患者的抗氧化能力明显减弱,抑制氧化应激反应可以有效减轻慢性胰腺炎伴发的疼痛[15]。鉴于大量的数据证实氧化应激在慢性胰腺炎进展中发挥重要作用,探索抗氧化剂对慢性胰腺炎的影响逐渐成为慢性胰腺炎治疗学研究中的热点。
本研究发现,DBTC联合乙醇造模后1 周、2 周、4 周血清淀粉酶活性明显升高,但是8周淀粉酶的活性急剧下降,提示胰腺组织广泛损伤、外分泌能力严重破坏。由于血清透明质酸可以反映活动性炎症导致细胞外基质的动态变化情况,近年来被用于监测组织的纤维化程度[7]。本实验发现,随着造模时间的延长,透明质酸的含量不断升高,胰腺组织Ⅰ型胶原的表达也明显增强,提示胰腺的纤维化程度不断加重。造模后2周胰腺组织中MDA的含量明显升高、4周达到高峰, 而SOD的活性持续降低,提示慢性胰腺炎进展中机体的抗氧化能力不断减弱,氧化应激不断增强。同时我们也发现MDA含量的变化与局部组织的炎细胞浸润程度变化相一致,提示氧化应激与炎症反应可能通过相互作用促进慢性胰腺炎的进展。
祖国医学将慢性胰腺炎归属于“腹痛、胁痛、泄泻、癥瘕”等范畴[16],长期以来认为本病多为恣食肥甘、长期嗜酒、损伤脾胃, 脾胃虚弱, 运化失职;或因砂石阻滞胆道加之情志不畅, 致使肝胆失疏、肝失条达、 疏泄不利、肝气郁结。脾虚则失于健运,影响肝的疏泄功能,导致气机郁滞,即脾虚肝郁气滞。脾为后天之本,气血生化之源,气为血之帅,气行则血行,气滞则血瘀,故脾虚肝郁气滞日久会导致血瘀。因此,治疗宜用健脾疏肝活血的药物。柴胡疏肝散由柴胡、陈皮、川芎、香附、枳壳、芍药、甘草组成,具有疏肝解郁、行气止痛的功效,近来的临床实践表明柴胡疏肝散治疗慢性胰腺炎不仅能较好地缓解临床症状,而且能有效地改善预后[17-18]。
本实验观察发现,与模型组比较,柴胡疏肝散治疗后血清淀粉酶活性、透明质酸的含量明显改善,胰腺组织炎症及纤维化程度明显减轻。胰腺组织MDA在2周明显回落,并持续维持较低水平,SOD活性呈回升趋势,提示柴胡疏肝散可以通过提高胰腺组织的抗氧化能力,有效遏制CP病程进展中的氧化应激反应,降低胰腺组织的氧化损伤,进而减轻炎症反应及胰腺纤维化程度。本研究结果为柴胡疏肝散用于临床防治慢性胰腺炎提供了实验依据。
[参 考 文 献]
[1] 王洛伟, 李兆申, 李淑德, 等. 慢性胰腺炎全国多中心流行病学调查[J]. 胰腺病学, 2007, 7(1):1-5.
[2] 王玉凤, 章学林. 中医药防治慢性胰腺炎作用机理研究进展[J]. 辽宁中医药大学学报, 2011, 13(11):55-57.
[3] Merkord J, Weber H, Jonas L, et al. The influence of ethanol on long-term effects of dibutyltin dichloride (DBTC) in pancreas and liver of rats[J]. Human Exp Toxicol, 1998, 17(3):144-150.
[4]SparmannG,MerkordJ,JaschkeA,etal.Pancreaticfibrosisinexperimentalpancreatitisinducedbydibutyltindichloride[J].Gastroenterology, 1997, 112(5): 1664-1672.
[5] Treiber M, Neuhöfer P, Anetsberger E, et al. Myeloid, but not pancreatic, RelA/p65 is required for fibrosis in a mouse model of chronic pancreatitis[J]. Gastroenterology, 2011, 141(4):1473-1485.
[6] 叶 博, 胡良皞, 廖 专, 等. 2180 例慢性胰腺炎临床特征及治疗模式变迁分析[J]. 中华消化内镜杂志, 2013, 30(1):10-14.
[7] 何新红, 陆建平, 廖 专, 等. 二丁基二氯化物尾静脉注射建立大鼠慢性胰腺炎模型[J]. 胰腺病学, 2007, 7(1):17-20.
[8] 田小芸,孙敬方. 啮齿类动物胰管开口的比较及胰液采集方法[J].中国实验动物学报, 2000, 8(4):255-258.
[9] 张汝玲, 王兴鹏, 吴 恺, 等. 核因子-κB 在血管紧张素 II 介导的大鼠胰腺纤维化发生中的作用[J]. 中国病理生理杂志, 2004, 20(11):1972-1976.
[10]ShimizuK.Mechanismsofpancreaticfibrosisandapplicationstothetreatmentofchronicpancreatitis[J].JGastroenterol, 2008, 43(11):823-832.
[11] Kirk GR, White JS, Mckie L, et al. Combined antioxidant therapy reduces pain and improves quality of life in chronic pancreatitis[J]. J Gastrointest Surg, 2006, 10(4):499-503.
[12]PalmieriVO,GrattaglianoI,PalascianoG.Ethanolinducessecretionofoxidizedproteinsbypancreaticacinarcells[J].CellBiolToxicol, 2007, 23(6):459-464.
[13] Bhardwaj P, Yadav RK. Chronic pancreatitis: role of oxidative stress and antioxidants[J]. Free Radical Res, 2013, 47(11):941-949.
[14]SchoenbergMH,BirkD,BegerHG.Oxidativestressinacuteandchronicpancreatitis[J].AmJClinNutr,1995, 62(Suppl):1306S-1314S.
[15] Bhardwaj P, Garg PK, Maulik SK, et al. A randomized controlled trial of antioxidant supplementation for pain relief in patients with chronic pancreatitis[J]. Gastroente-rology, 2009, 136(1):149-159.e2.
[16] 陈永灿, 白 钰. 中医药治疗慢性胰腺炎的进展及思考[J]. 陕西中医, 2009 (7):930-932.
[17] 刘 健, 赵战朝, 薛承锐. 柴胡疏肝散对慢性胰腺炎患者胰腺外分泌功能不全的治疗作用[J]. 中国中西医结合外科杂志, 2010, 16(3):275-277.
[18] 邱建强, 白晓娟, 董明娥. 柴胡疏肝散加味配合穴位注射治疗慢性胰腺炎 32 例 [J]. 陕西中医, 2003, 24(11):997-998.

