第三脑室脊索样胶质瘤1例临床及病理分析
廖秋林,王蔚,崔华娟,彭大云,周永梅,张伟
论著·临床
第三脑室脊索样胶质瘤1例临床及病理分析
廖秋林,王蔚,崔华娟,彭大云,周永梅,张伟
目的探讨第三脑室脊索样胶质瘤的临床、影像及病理学特点。方法回顾1例第三脑室脊索样胶质瘤患者的诊断和治疗过程,并结合文献进行分析。结果第三脑室脊索样胶质瘤影像学上主要表现为三脑室及鞍上占位影,均匀强化,边缘清晰。组织学上肿瘤呈均匀弥漫分布,簇状、条索状上皮样细胞埋在空泡状黏液样基质中,肿瘤间隔及周边间质内出现特征性淋巴细胞、浆细胞浸润。瘤细胞缺乏多形性、核分裂及坏死。免疫组化染色示GFAP弥漫性强阳性。手术全切是目前主要治疗措施,预后介于良、恶性之间。结论第三脑室脊索样胶质瘤是一种具有独特临床、组织病理学、免疫表型和电镜特点的罕见中枢神经系统肿瘤,容易误诊。病理确诊主要是根据肿瘤特定的生长部位、脊索样组织结构和免疫组化GFAP弥漫强阳性。
第三脑室脊索样胶质瘤;影像学特征;病理学特征
第三脑室脊索样胶质瘤(chordoid glioma of the third ventricle) 是一种罕见的局限发生于第三脑室的起源不定的低级别神经上皮肿瘤,国内外文献报道较少,容易误诊。临床、影像及病理均酷似脑膜瘤、室管膜瘤及胶质瘤等。但在组织学、超微结构及免疫组化等方面都有不同的特征。我院2012年收治第三脑室脊索样胶质瘤患者1例,现对其诊断及治疗进行分析,以期总结经验,加强对该疾病的认识,提高诊断与治疗水平。
1 病例介绍
患者,女,34岁,主因停经5年,肢体乏力6个月入院。患者于5年前产后停经,无头痛、头晕,无肢体抽搐,曾用中药调理效果不佳。近6个月来,感全身疲乏无力,视力无明显变化,5月29日于外院行头颅MR检查示:鞍上、三脑室内占位性病变,明显较均匀强化,边界清楚。为进一步诊治来我院就诊。入院查体:意识清楚,查体合作,对答切题。双侧瞳孔正大等圆,光反射灵敏,眼镜矫正视力。四肢自动运动、肌力、肌张力未见明显异常,病理征未引出,脑膜刺激征阴性,腱反射存在,无亢进及减低。实验室检查:性激素6项正常。复查MR示:鞍上可见一不规则肿块影,大小约3.4 cm×3.2 cm×3.6 cm,与脑灰质信号相比,T1呈等信号,T2呈等或稍高信号,注入造影剂后可见明显较均匀强化,肿块呈实性位于鞍上,边缘可见分叶,边界较清,与下丘脑关系密切(见图1);三脑室受压,垂体及垂体柄显示较好,垂体柄起始段稍受压,视交叉向下受压;松果体注入造影剂后呈环形强化,体积未见增大;扫描脑实质未见明显特殊。MR提示鞍上占位,考虑实性颅咽管瘤可能性大,需与脑膜瘤鉴别。临床诊断鞍上、三脑室内占位性病变。术中所见:肿瘤位于三脑室内,表面质硬,灰红色。分块全切肿瘤,手术标本组织病理学特征:大体观察为灰白灰红色碎组织,总体积约6 cm×5cm×2 cm,切面灰白灰红色、实性、质中质脆。组织学上肿瘤呈结节状,有不连续纤维性间隔,瘤细胞呈团簇状、条索状或束状排列,分布于空泡状黏液样基质中,瘤细胞圆形到多边形,胞质伊红染色,界限清楚或不清,部分有突起,核类圆形,大小形态较一致,染色质均匀,部分核内可见小核仁,可见核内包涵体,未见核分裂相(图2见封3) ,可见微囊及Russell小体。肿瘤与周围脑组织界限较清,并可见反应性纤维性星形细胞形成杂乱无章排列。纤维性间隔及肿瘤周边有呈簇或散在分布的淋巴细胞、浆细胞浸润。免疫表型及特殊染色:瘤细胞胞质均弥漫性强表达GFAP (图3见封3) 和vimentin,EMA呈灶性或单个散在阳性,CKpan及CK7呈局灶阳性,CD34阳性(图4见封3),D2-40少许弱阳性,EGFR弱阳性,Ki-67示瘤细胞增殖指数为1%。其余S-100、P63、CEA、CD31、NSE、Syn、CgA、CD38、CD138、LCA、ER、PR、SMA、Desmin、TTF-1、HMB45、CD68、NeuN、NF、CD10、P53等均为阴性。PAS染色示肿瘤黏液样基质阳性,网状纤维染色均示瘤细胞簇团周围有网状纤维,单个瘤细胞周围无网状纤维。肿瘤组织经福尔马林液固定后再做电镜检查(标本处理欠佳),镜下部分细胞器结构不清。肿瘤细胞为圆形或短梭形,细胞交错状分布,偶尔见短的细胞突起,细胞间未见桥粒等细胞连接,胞质丰富,核周可见少量线粒体、较多的核糖体,可见胶质微丝(见图5)。电镜检查确诊为第三脑室脊索样胶质瘤。
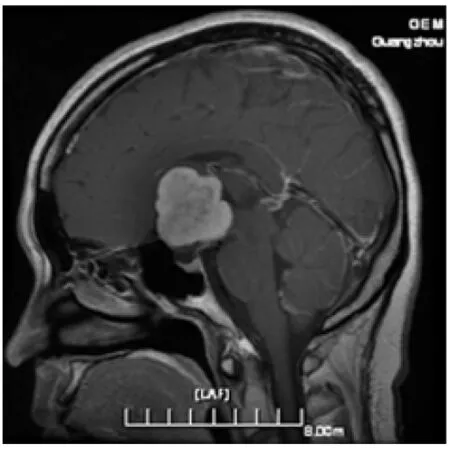
图1 MR示鞍上及三脑室实性肿块影,均匀强化,边界较清
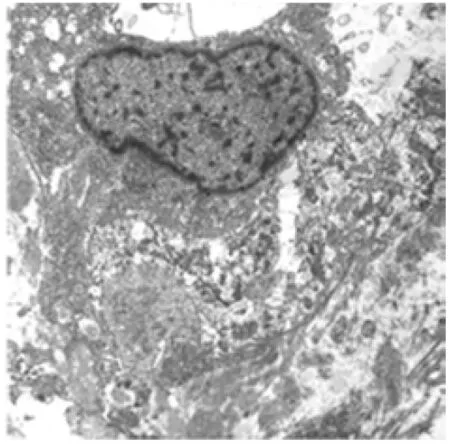
图5 肿瘤组织电镜检查特点(×10000)
2 讨 论
2.1 临床表现 该病国内外已报道近60例[1~8],其中儿童患者2例,分别为7和12岁[7];脊索样胶质瘤好发于成年人,年龄25~75岁,中位数45岁[8]。女性多见,最近报道男/女患病率为1∶(1.9~2.0)[5]。肿瘤多位于第三脑室,部分位于鞍上—下丘脑区,近来报道位于侧脑室1例[7]。病变常充满脑室中间和后部,常起源于中线,可造成周边正常结构移位,神经影像及小而局限性的肿瘤特征提示肿瘤起源于第三脑室壁终板。临床上主要表现为第三脑室占位引起梗阻性脑积水所致的头痛、恶心、呕吐和运动失调等;也可使下丘脑和视交叉向下移位,引起内分泌紊乱和视力障碍,还可压迫内侧颞叶引起心理和记忆异常等。
2.2 神经影像学特征 神经影像学表现为大的肿块,边界清楚,导致梗阻性脑积水和头痛、共济失调、视觉和内分泌功能异常、体质量波动明显、精神/器质性脑综合征。影像学上缺乏特征性改变,一般为局限于蝶鞍上第三脑室或附近球状、边界清楚的包块影,肿瘤边界较清,一般直径2~4 cm,囊性变及钙化少见,呈现均一性对比增强,并与下丘脑和鞍上结构相邻。肿瘤一般很少浸润周围脑组织,生物学行为属低度恶性,归为WHO II级肿瘤[9,10]。本例术前影像学仅提示第三脑室占位性病变,考虑为脑膜瘤,未诊断胶质瘤。
2.3 病理学特征 大体检查一般为灰红色或灰白色碎肿物,边界清楚。切面灰红色或灰白色、实性、质软及质中,有黏液样感。镜下是实性肿瘤,卵圆形到多形性富有红染胞质的上皮样细胞,簇状,条索状排列,埋在黏液基质中(呈空泡状)。瘤细胞常可显示有限的胶质细胞分化而出现纤维状突起。瘤细胞核中等大,大小相对一致。核分裂相少见,一般<1/10HPF。一般不浸润周围脑组织。未见小血管增殖与组织坏死,也未见漩涡状结构及砂粒小体。可出现局灶性不完整的纤维性间隔,周围可见反应性星形细胞、Rosenthal纤维、慢性炎细胞(包括淋巴细胞、浆细胞)和Russell小体,有些病例还可见局灶性组织细胞和Touton巨细胞及化生的软骨岛,但一般不形成淋巴滤泡[6]。但本病例可见到明显淋巴滤泡形成。一般不见坏死及血管增殖。Raizer等[11]报道的第三脑室脊索样胶质瘤还可表现为呈乳头状或腺泡状的生长方式。免疫组化检查一般GFAP、Vimenitin强阳性,S-100、CD34、CK等表达不定,EMA灶性阳性,EGFR、merlin阳性,TP53、P21、MDM2阴性。Ki67/MIB-1平均指数非常低,为0~1.5%。
电镜检查发现细胞胞质内具有丰富的中间丝、微绒毛及基板样结构,有些肿瘤细胞中出现零星的半桥粒结构和中间连接,并在肿瘤细胞中发现了异常纤毛,提示肿瘤可能起源于位于中脑导水管入口的连合下器(subcommissural organ, SCO),并具有室管膜分化特征的细胞。伸长细胞可能位于第三脑室的某个特殊位置,第三脑室也是脊索样胶质瘤的好发部位,因此推测该肿瘤可能起源于伸长细胞。笔者推测脊索样胶质瘤可能是室管膜瘤的一种亚型,而这种脊索样胶质瘤的细胞可能来源于SCO的高度特异性的室管膜细胞或者伸长细胞。
2.4 鉴别诊断 第三脑室脊索样胶质瘤罕见,临床特征不明显,极易误诊。确诊主要是根据肿瘤特定的生长部位、脊索样组织结构和免疫组化GFAP 弥漫强阳性。需与以下疾病鉴别诊断。
2.4.1 脊索样脑膜瘤:两者形态学上很相似,脊索样胶质瘤缺乏细胞性漩涡结构、核内假包涵体和沙砾体,脑膜瘤GFAP阴性而EMA阳性,而且总会找到典型的脑膜瘤特征且与硬脑膜相连,两者均有簇状上皮样细胞和淋巴浆细胞浸润,但脑膜瘤可形成生发中心。脑膜瘤炎细胞浸润常呈斑片状,也可以很显著;多表现为脊索样区域与脑膜瘤样区域相混,单纯表现为脊索瘤样结构的病例罕见。
2.4.2 脊索瘤:其可见特征性的PAS染色阳性的液滴状脊索瘤样细胞,无淋巴细胞、浆细胞浸润,Vim弥漫强阳性,CK、S-100可阳性,而GFAP阴性可与脊索样胶质瘤鉴别。
2.4.3 毛细胞性星形细胞瘤:其一般没有脊索样组织结构以及多数淋巴细胞、浆细胞浸润,因此,比较容易鉴别。第三脑室脊索样胶质瘤也不具有星形细胞瘤所具有的微囊、瘤内Resenthal 纤维或颗粒状小体等结构。
2.5 治疗及预后 脊索样胶质瘤属于低级别肿瘤。然而,因肿瘤发生部位的特殊性,使肿瘤不易切除干净。肿瘤全切加辅助治疗的作用还不清楚,即使经过放射性治疗,有些残余肿瘤仍可复发。患者多死于肿瘤切除引起的下丘脑功能障碍。本患者术后未进行化疗或者放疗,预后良好。
1 Ni HC, Piao YS, Lu DH, et al. Chordoid glioma of the third ventricle: four cases including one case with papillary features[J]. Neuropathology, 2013, 33(2): 134-139
2 Shi HY, Tian Y, Shi YZ,et al. The MRI findings in chordoid glioma of the third ventricle[J]. Zhonghua-Yi-Xue-Za-Zhi, 2013, 93(5): 373-375.
3 Narisawa A, Kumabe T, Saito R, et al. Case of chordoid glioma of the third ventricle[J].No-Shinkei-Geka, 2012,40(9): 805-811.
4 Varthauwaert DJ,Clement F,Van Dorpe J,et a1.Chordoid glioma of the third ventricle[J].Acta Neurochir(Wien),2008,150:1183-1191.
5 Iwami K,Arima T,Oooka F,et a1.Chordoid glioma with calcification and neurofilament expression:case report and review of the literature[J].Surg Neurol,2009,71(1):115-120.
6 赵飞行,汪春年,石群立,等.第三脑室脊索样胶质瘤3例报道及文献复习[J].临床与实验病理学杂志,2008,24(4):399-406.
7 Jain D,Sharma MC,Sarkar C,et a1.Chordoid glioma:report of two rare examples with unusual feature [J]. Acta Neurochir(Wien),2008,150(3):295-300.
8 Buccoliero AM,Caldarella A,Gallian P,et al.Chordoid glioma:clinicopathologic profile and differential diagnosis of an uncommon tumor[J].Arch Pachol Lab Med,2004,128(11):e141-e145.
9 Ortega-Martinez M, Cabezudo JM, Bernal-Garcia LM, et al.Chordoid glioma of the III ventricle. Case report and revision of the literature[J]. Neurocirugia (Astur),2007,18(2):115-122.
10 Pasquier B, Peoc′h M, Morrison AL, et al. Chordoid glioma of the third ventricle: a report of two new cases, with further evidence supporting an ependymal differentiation, and review of the literature[J]. Am J Surg Pathol,2002,26(10):1330-1342.
11 Raizer JJ, Shetty T, Gutin PH, et al. Chordoid glioma: report of a case with unusual histologic features, ultrastructural study and review of the literature[J]. J Neurooncol,2003,63(1):39-47.
有效数字的确定
Clinicalandpathologicalanalysisofchordoidthirdventriclegliomas:1casereport
LIAOQiulin,WANGWei,CUIHuajuan,PENGDayun,ZHOUYongmei,ZHANGWei.
DepartmentofPathology,GuangzhouGeneralHospitalofGuangzhouMilitaryRegion,Guangzhou510010,China
ObjectiveTo investigate the clinical, imaging and pathological features of the third ventricle chordoid glioma.MethodsThis paper investigated and reviewed the clinic pathology feature of a case of chordoid glioma of the third ventricle by light-microscopy, electron microscopy, and immunohistochemistry study, and reviewed the literatures.ResultsGlioma of the third ventricle chordoid imaging mainly as placeholders shadow on the third ventricle and saddle, homogeneous enhancement, edge clarity. Histologically, the tumor showed diffuse evenly distributed, clustered, cord-like epithelial cells buried in the vacuoles myxoid matrix, the interval between tumor cells and the surrounding endoplasmic characteristic with plasma cell infiltration. Tumor cells lacking pleomorphic mitotic and necrotic. GFAP immunohistochemistry shows diffuse strongly positive. Complete removal is the main treatment, prognosis between benign and malignant.ConclusionChordoid glioma of the third ventricle is a unique clinical, histopathological, immunological phenotype characterized by electron microscopy and rare central nervous system tumors, easily misdiagnosed. Pathological diagnosis is mainly based on the growth of tumor -specific parts chordoid organizational structure and GFAP immunohistochemistry diffuse strongly positive.
Chordoid third ventricle glioma; Imaging features; Pathological features
510010 广州军区广州总医院病理科
10.3969/ j.issn.1671-6450.2014.02.011
2013-10-26)

