腹主动脉阻断术后合并脓毒症大鼠肾脏损伤TNF-α的变化
朱睿瑶,尹述洲,张 迪,夏文芳,邹捍东,周青山
腹主动脉阻断术后合并脓毒症大鼠肾脏损伤TNF-α的变化
朱睿瑶1,尹述洲2,张 迪1,夏文芳1,邹捍东1,周青山1
(1. 武汉大学人民医院,湖北 武汉 430060;2. 上海交通大学医学院苏州九龙医院,江苏 苏州 215021)

目的 观察大鼠腹主动脉阻断缺血再灌注术后合并脓毒症时肾脏组织病理学改变及肾脏组织中肿瘤坏死因子-α(TNF-α)的变化。方法 SPF级Wistar大鼠32只随机分为4组:假手术组(A组),腹主动脉阻断组(B组),脓毒症组(C组)及腹主动脉阻断合并脓毒症组(D组)。所有动物于再灌注后8 h处死。4%多聚甲醛灌注固定后取肾脏,采用HE染色光镜下对各组肾脏进行组织形态学对比观察,免疫组化法检测肾脏组织中TNF-α的表达。结果 HE染色显示A组无明显病理改变,B组可见轻度损伤,C组较B组病理改变严重,D组最为严重。TNF-α表达平均总面积A、B、C、D组依次递增,与A组比较,B、C、D组均显著增加(P均<0.05),但B组与C组无显著性差异(P>0.05);TNF-α表达平均积分光密度A、B、D、C组依次递增,各组间有显著性差异(P均<0.05)。结论 腹主动脉阻断术后合并脓毒症时急性肾损伤最为严重,TNF-α作为一种至关重要的前炎性因子发挥了重要作用;免疫紊乱和肾脏再灌注无复流,对肾脏TNF-α表达造成了复杂的影响。
腹主动脉阻断;脓毒症;肾损伤;肿瘤坏死因子-α
腹主动脉阻断术(AAC)造成阻断平面以下的多个脏器缺血,在动脉开放后,缺血脏器聚集的代谢产物及炎症物质可进入血液循环。这种缺血再灌注损伤不仅能够引起缺血组织的损害,还能导致全身炎症反应,损害远处脏器如心、肾、肺等,进而造成多器官功能不全综合征,甚至死亡[1]。严重的可发展为脓毒症。脓毒症是ICU常见的一种严重感染性疾病,来势凶猛,病情进展迅速,病死率高。脓毒症导致的多器官功能衰竭(包括急性肾损伤)病死率可达70%[2]。在脓毒症患者中急性肾损伤是一种常见并发症[3]。肾脏是缺血再灌注脏器损伤中最早、最易受累的器官之一。目前针对AAC后缺血再灌注损伤基础上序贯发生的脓毒症导致急性肾损伤的研究甚少。本研究在AAC导致缺血再灌注损伤合并内毒素致脓毒症模型的基础上,观察大鼠肾脏组织病理学改变及肿瘤坏死因子-α(TNF-α)表达的变化。
1 实验资料
1.1 动物分组 SPF级Wistar大鼠32只(湖北省疾病控制中心实验动物中心提供),雄鼠27只,雌鼠5只,体质量为(250±30)g。实验前12 h予禁食,可自由饮水。将动物随机分为4组(实际造模成功数目,每组8例):假手术组(A组),腹主动脉阻断组(B组),脓毒症组(C组),腹主动脉阻断合并脓毒症组(D组)。
1.2 模型制备 缺血再灌注损伤模型:以45 mg/kg戊巴比妥钠经腹腔注射麻醉大鼠后,经侧腹切口,腹膜后分离出腹主动脉及左肾动脉,在靠近膈肌处,以无创动脉夹夹闭腹主动脉,夹闭即刻可见左肾立即由红色转为苍白,20 min后可见有花斑状改变,松开动脉夹颜色转红。脓毒症模型:再灌注后2 h对应时间点经腹腔注射脂多糖内毒素20 mg/kg。所有动物以手术后存活8 h为造模成功标准。A组仅分离腹主动脉但不阻断,不注射内毒素,仅于相应时间点经腹腔注射生理盐水20 mg/kg;B组分离腹主动脉并阻断,再灌注2 h后经腹腔注射生理盐水20 mg/kg;C组假手术后2 h经腹腔注射内毒素 20 mg/kg;D组腹主动脉阻断再灌注2 h后,腹腔注射内毒素 20 mg/kg。
1.3 主要试剂 脂多糖内毒素,DAB显色剂,多聚甲醛,左旋多聚赖氨酸(Sigma公司),兔抗大鼠TNF-α抗体,SABC试剂盒(武汉博士德生物有限公司)。
1.4 检测指标及方法 术后8 h,行腹腔麻醉,开胸放血,胸主动脉插管行灌注固定,左右肾各取一段,4%多聚甲醛固定过夜,常规脱水,透明,石蜡包埋。苏木素-伊红(HE)染色:常规脱蜡入水,取肾脏进行HE染色观察肾脏组织病理学的损害。使用免疫组化观察TNF-α表达的变化,对各组切片进行图像采集,使用Image Program Plus 6.0图像分析系统测定阳性表达平均总面积(Sum Area)和平均积分光密度(MIOD),以棕黄色颗粒为阳性表达。
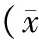
2 结 果
2.1 各组大鼠肾脏组织病理学改变 A组肾小球形态正常,结构清晰,无毛细血管淤血表现;肾小囊囊腔充盈;肾小管上皮细胞结构完整,排列整齐,管腔通畅;间质无明显水肿及炎性细胞浸润。见图1。B组多数皮质肾小球皱缩,毛细血管轻度淤血,红细胞渗出,髓质肾小球病理改变较轻微;皮质肾小囊无明显变化,髓质肾小囊囊腔变窄;部分肾小管上皮细胞水肿变性,细胞扁平、脱落,排列稀疏、紊乱,管腔变窄,部分管腔内可见少量细胞和蛋白管型,外髓质及皮髓交界处、外髓内带的近端小管受损较为严重,主要表现为刷状缘脱落;可见间质轻度水肿,出血,炎症细胞浸润,以髓质较为严重。见图2。C组可见绝大部分肾小球皱缩,毛细血管淤血,红细胞渗出;皮质肾小囊与髓质肾小囊均可见囊腔明显变窄;肾小管上皮细胞肿胀、变性、坏死脱落,刷状缘坏死脱落,管腔狭窄明显,并可见大量细胞或蛋白管型形成;肾间质广泛水肿,出血,大量炎性细胞浸润。见图3。D组多数肾小球皱缩,毛细血管严重淤血,红细胞渗出,但髓质肾小球病理改变较B组更为严重,但较C组稍轻;皮质肾小囊与髓质肾小囊囊腔均明显变窄;肾小管上皮细胞水肿变性明显,刷状缘脱落严重,管腔闭塞,内可见大量细胞或蛋白管型形成;肾间质严重水肿,出血,大量炎性细胞浸润。见图4。
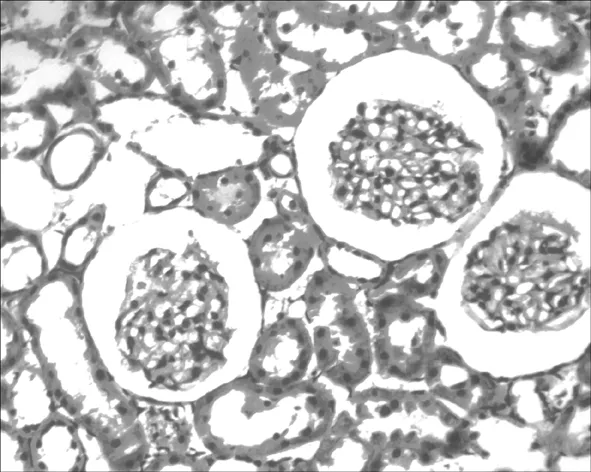
图1 A组大鼠肾脏组织病理学改变(HE,×400)
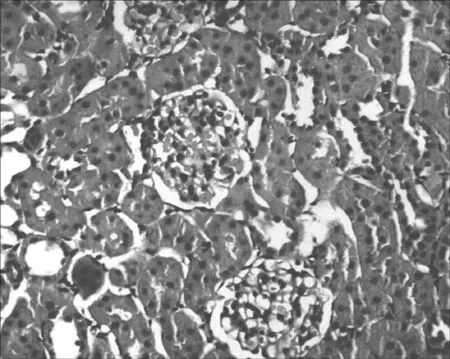
图2 B组大鼠肾脏组织病理学改变(HE,×400)

图3 C组大鼠肾脏组织病理学改变(HE,×400)
2.2 各组免疫组织化学肾脏组织TNF-α表达变化 A组少量肾小球及肾小管可见阳性染色,主要在肾小球及肾小管内壁线状表达,部分肾小管上皮细胞胞浆可见弱阳性染色;B、C、D各组均可见肾小球及肾小管内壁线状表达,部分肾小管因上皮细胞损害而无典型线性表达,但肾小管上皮细胞胞浆仍可见强阳性表达;B组肾小球表达增加,C组与D组更为明显;所有阴性对照切片无阳性染色。TNF-α阳性表达总面积A、B、C、D 4组依次递增,B组与C组无显著性差异(P>0.05),余各组比较均有显著性差异(P均<0.05)。TNF-α表达面积积分光密度:A、B、D、C 4组依次递增,各组比较均有显著性差异(P均<0.05)。见表1。
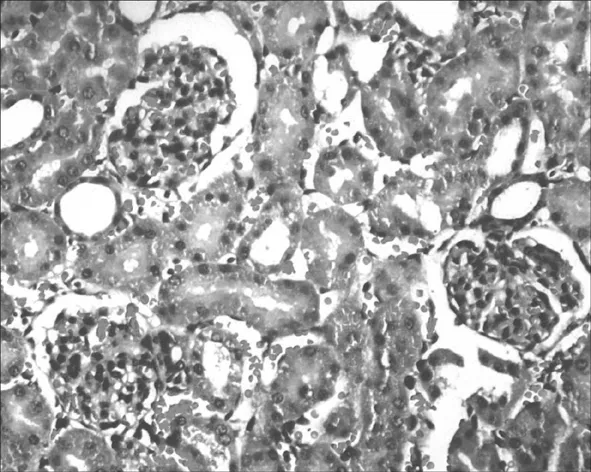
图4 D组大鼠肾脏组织病理学改变(HE,×400)
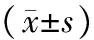
表1 4组肾脏TNF-α阳性表达总面积和MIOD比较
注:①与A组比较,P<0.05;②与B组比较,P<0.05;③与C组比较,P<0.05。
3 讨 论
AAC造成阻断平面以下的多个脏器缺血再灌注损伤,导致全身炎症反应综合征,损害远端脏器,进而造成多器官功能不全综合征,甚至导致死亡。严重脓毒症是机体免疫系统与侵入病原体之间发生的不适当反应,是过度的炎症反应和过度的凝血反应等而导致机体组织、器官损害的病理生理学状态,并导致循环系统紊乱及其一系列的损害[4]。脂多糖内毒素是目前已知的诱导白介素和肿瘤坏死因子的重要因子,与宿主免疫系统进一步相互作用后可激发细胞因子的释放。有研究认为其中TNF-α可能起核心作用,它在炎症反应中最早释放,可进一步引起炎症因子IL-6、IL-8、IL-11、IL-12及其他脂质介素如白三烯、血栓素、血小板活化因子、前列腺素、补体等的释放,进一步放大炎症反应[5]。由此可见,在缺血再灌注损伤和脓毒症的发生与发展中,TNF-α均扮演了重要角色。
肾缺血再灌注损伤存在多种机制,包括小管细胞凋亡、氧自由基形成、线粒体功能衰竭、炎性细胞因子以及中性粒细胞扣押[6]。许多学者认为炎症因子在缺血再灌注损伤中占据着重要的地位。有研究表明,肾脏缺血再灌注损伤后,肾组织TNF-α表达显著提高[7]。另外,肾组织过量表达TNF-α可以引发显著的细胞损伤及功能障碍[8]。肾脏TNF-α可以促进中性粒细胞浸润以及缺血再灌注早期肾损伤的发生及发展[9]。TNF-α不仅是机体炎症反应中激发细胞因子产生级联反应的主要递质,也是导致创伤后机体免疫功能紊乱的重要因素之一,并且TNF-α能刺激其他几种促炎性细胞因子如IL-1β、IL-6及IL-8等产生[10]。
Amanda等[11]研究显示,肾脏缺血再灌注后(缺血60 min),肾血流量显著降低,最低至基础值50%以下。Legrand 等[12]注射LPS制作脓毒症模型发现,注射LPS后30 min,MAP下降至基础值的65%,大约3 h后回升至接近基础值,最后再次下降,在5 h降至基础值的55%左右。显然,腹主动脉阻断和腹腔注射LPS均可导致肾脏缺血再灌注损伤。当肾脏缺血再灌注时,肾血流量可有一定程度的恢复,但是肾皮质、皮髓结合处以及外髓的微循环并未完全恢复,亦即再灌注无复流现象。事实上腹主动脉阻断亦可导致肠源性内毒素血症。在本实验中,20 min的腹主动脉阻断与腹腔注射20 mg/kg LPS所致的TNF-α表达在总面积上十分接近,但是平均积分光密度却以后者为多。笔者推断,20 min的腹主动脉阻断以及再灌注,肾脏经历了一次缺血再灌注损伤,肾脏存在再灌注无复流,因而TNF-α可能更多地来自于肾脏本身扣押的巨噬细胞,而不是来自循环中,因为循环中的TNF-α无法进入或者很少进入无复流的肾组织;而假手术后腹腔注射20 mg/kg LPS,可以导致肾脏及循环中的TNF-α迅速增加;当腹主动脉阻断术后2 h腹腔注射20 mg/kg LPS时,因为腹主动脉阻断所致的缺血再灌注损伤,已经消耗了大量的巨噬细胞,此时造血系统尚未产生足够多新的巨噬细胞,故而免疫系统对LPS的反应不太明显,这一点可以解释为何双重打击组与腹主动脉阻断组相比TNF-α表达面积增加,但平均光密度仅仅轻度增加,甚至低于假手术后腹腔注射20 mg/kg LPS所导致的TNF-α表达;尽管如此,AAC后2 h腹腔注射20 mg/kg LPS仍然加重了肾脏组织病理改变,增加了病死率。
AAC术后合并脓毒症大鼠急性肾损伤最为严重,TNF-α作为一种至关重要的前炎性因子发挥了重要作用;免疫紊乱和肾脏再灌注无复流,对肾脏TNF-α表达造成了复杂的影响。笔者将在进一步对AAC术后序贯发生脓毒症时,全身多脏器功能损伤及其损伤机制进行系统研究的基础上,展开治疗干预实验,探寻有效的防治途径。
[1] 曲度,曲强,张弦,等. 腹主动脉阻断术临床原理及其上中下段安全时限探讨-兼述缺血再灌注损伤机制与对策及“二叉树耐受法则”[J]. 海南医学,2009,20(1):1-13
[2] Doi K,Leelahavanichkul A,Yuen PS,Star RA. Animal models of sepsis and sepsis-induced kidney injury[J]. Clin Invest,2009,119:2868-2878
[3] Bagshaw SM,Bennett M,Haase M,et al. Plasma and urine neutrophil gelatinase-associated lipocalin in septic versus non-septic acute kidney injury in critical illness[J]. Intensive Care Med,2010,36:452-461
[4] 黎毅敏,何国清.2008年的SSC指南中有关机械通气方面的探讨[J].中国呼吸与危重监护杂志,2009,8(2):101-103
[5] Jiang T,Han SQ,Hu M,et al. The change of endotoxin, TNF-α, IL-6 and IL-8 in rats With open abdominal wound and seawater immersion[J]. Bullet Acad Milit Med Sci,2009,33(5):438-439
[6] Kelly KJ. Distant effects of experimental renal ischemia/reperfusion injury[J]. J Am Soc Nephrol,2003,14(6):1549-1558
[7] Park SW,Chen SW,Kim M,et al. Cytokines induce small intestine and liver injury after renal ischemia or nephrectomy[J]. Lab Invest,2011,91(1):63-84
[8] Ko GJ,Boo CS,Jo SK,et al. Macrophages contribute to the development of renal fibrosis following ischaemia/reperfusion-induced acute kidney injury[J]. Nephrol Dial Transplant,2008,23(3):842-852
[9] Kim M,Park SW,Chen SW,et al. Selective renal overexpression of human heat shock protein 27 reduces renal ischemia-reperfusion injury in mice[J]. Am J Physiol Ren Physiol,2010,299(2):F347-358
[10] Ferenbach DA,Ramdas V,Spencer N,et al. Macrophages expressing heme oxygenase-1 improve renal function in ischemia/reperfusion injury. Mol Ther,2010,18(9):1706-1713
[11] Versteilen AMG,Blaauw N,Maggio FD,et al. Rho-kinase inhibition reduces early microvascular leukocyte accumulation in the rat kidney following ischemia-reperfusion injury: Roles of Nitric Oxide and Blood Flow[J]. Nephron Exp Nephrol,2011,118:e79-e86
[12] Legrand M,Bezemer R,Kandil A,et al. The role of renal hypoperfusion in development of renal microcirculatory dysfunction in endotoxemic rats[J]. IntensiveCare Med,2011,37:1534-1542
Changes of TNF-α in rats underwent kidney injury complicated with metastasizing septicemia infection after abdominal aorta clamping
Zhu Ruiyao1, Yin Shuzhou2, Zhang Di1, Xia Wenfang1, Zou Handong1, Zhou Qingshan1
(1.The People’s Hospital of Wuhan University, Wuhan 430060, Hubei, China; 2.Suzhou Jiulong Hospital of Shanghai Jiaotong University School of Medicine, Suzhou 215021, Jiangsu, China)
Objective It is to observe the pathmorphological changes of kidney tissues and the expression of TNF-α in kidney tissues of rats with ischemic reperfusion injury complicated with sepsis after abdominal aorta champing (AAC). Methods Thirty-two Wistar rats of SPF were randomly divided into four groups: control group (group A), abdominal aorta champing group (group B), sepsis group (group C), and abdominal aorta champing complicated with sepsis group (group D). All animals were killed 8 hours after the reperfusion. The pathomorphological changes in Kidney tissues were observed with HE method, and the TNF-α expression was detection by immunohistochemistty methods. Results There was no obviously pathological changes in group A, and was slight pathological changes in group B, the pathological changes in group C was more serious than group B, the pathological changes was most serious in group D. The expression area of TNF- α was increased from group A to D, the amount of group A was least among the four groups (allP<0.05), but there was no significant differences between group B and C (P>0.05); the average integral optical density of TNF- α was increased from group A to D, there were significant differences among the four groups (allP<0.05). Conclusion The kidney injury is worst in AAC complicated with sepsis, TNF- α play an important role as a vital pro-inflammatory cytokines; the expression of TNF- α is affected by the immunologic derangement and reperfusion.
abdominal aorta clamping; sepsis; kidney injury; tumor necrosis factor - α
朱睿瑶,女,住院医师,主要从事危重病脏器保护研究。
江苏省自然科学基金资助项目(BK2009139)
10.3969/j.issn.1008-8849.2014.15.004
R-332
A
1008-8849(2014)15-1606-04
2014-03-01

