球孢白僵菌SJ-05几丁质酶基因的克隆与序列分析
杨 帆, 刘春来, 段立清
(1.黑龙江省农业科学院植物保护研究所,哈尔滨 150086; 2.内蒙古农业大学农学院,呼和浩特 010019)
球孢白僵菌SJ-05几丁质酶基因的克隆与序列分析
杨 帆1, 刘春来1, 段立清2*
(1.黑龙江省农业科学院植物保护研究所,哈尔滨 150086; 2.内蒙古农业大学农学院,呼和浩特 010019)
几丁质酶在昆虫真菌侵染寄主过程中起着重要的作用。本文对采自内蒙古准格尔旗沙棘木蠹蛾的球孢白僵菌菌株SJ-05进行了几丁质酶的基因分析,从中克隆了几丁质酶Bbchit基因,得到了重组质粒pMD19-T/chit。测序结果表明,Bbchit基因核苷酸序列阅读框架全长为1047 bp,编码348个氨基酸,推测分子量为36.924 ku,等电点为5.94。氨基酸序列比对结果表明,与球孢白僵菌Bb0062菌株(AAN41259.1)的氨基酸序列相似性最高,为99.71%。
球孢白僵菌; 几丁质酶基因; 基因克隆; 序列分析
沙棘是我国黄土丘陵区的水土保持树种之一,也是当地主要薪炭材,整株植株均含有丰富的营养和生物活性物质,具有较高的综合开发利用价值。但是,近年来,沙棘木蠹蛾(HolcocerushippophaecolusHua,Chou,FangetChen)时有发生,为害严重,造成沙棘林大面积死亡。内蒙古鄂尔多斯市沙棘木蠹蛾发生面积大,约1.8万hm2,平均有虫株率高达42%[1]。调查发现白僵菌是沙棘木蠹蛾幼虫、蛹的主要病原物,是值得开发利用的病原物之一。
球孢白僵菌[Beauveriabassiana(Balsamo) Vuillemin]是常见的昆虫病原真菌之一,寄主范围广,致病力强,对人、畜、天敌无毒害,不污染环境,广泛应用于农林害虫的生物防治。昆虫病原菌在入侵寄主体壁的过程中会产生相关的酶类,其中主要是蛋白酶、几丁质酶及脂酶等水解酶类[2]。当这些酶类作用于昆虫表皮时,协同运作[3],可降解由蛋白质、几丁质和脂类等物质组成的昆虫体壁[4],使孢子更容易吸附在寄主昆虫体表上,利于芽管侵入体表,同时也为菌丝的生长提供了营养物质,使菌丝成功侵入昆虫体腔[5]。这些酶类在球孢白僵菌侵入寄主过程中起重要作用[6]。
几丁质酶由于其有效降解几丁质,在害虫防治中得到了广泛的研究,它是由N-乙酰-D-氨基葡糖残基以β-1,4糖苷键连接而成的不分枝链状多糖。几丁质酶存在于昆虫、线虫、真菌、一些藻类[7]和酵母中。在昆虫中,几丁质酶主要作用时间有限,如蜕皮前。几丁质酶是一种诱导酶,以几丁质为作用底物的水解酶,在以昆虫体壁为唯一碳氮源的培养基中和穿透寄主体壁时都能表达[8]。在环境不太适合期间过度降解几丁质会引起昆虫生理紊乱,导致昆虫死亡[9]。在植物体内,为增强其防御机制,几丁质酶基因也可以表达。从烟草天蛾中获得的几丁质酶基因,通过转基因烟草植物表达后,显著降低了烟草夜蛾幼虫的生长。为研究害虫防治,同来自许多生物体的几丁质酶基因被克隆一样,从致病性真菌中也克隆到了几丁质酶基因[3,10,15,17]。几丁质酶是昆虫病原真菌的一个重要毒力因子。本研究克隆球孢白僵菌SJ-05几丁质酶基因,并分析该基因编码的氨基酸序列,为进一步研究几丁质酶在昆虫体壁水解过程中的重要作用以及构建高毒力基因工程菌株提供分子水平上的依据。
1 材料与方法
1.1 菌株来源
球孢白僵菌SJ-05分离自内蒙古准格尔旗沙棘木蠹蛾幼虫体。
1.2 主要试剂
植物基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒小样快速抽提试剂盒均购自TIANGEN公司,pMDTM19-T Simple vector、rTaq聚合酶、限制性内切酶Hind Ⅲ及EcoRⅠ均购自TaKaRa公司,X-gal、氨苄青霉素(Ampr)等购自北京鼎国昌胜生物技术有限责任公司,其他常用试剂为国产分析纯。
1.3 SJ-05 DNA的提取
将新鲜PSA斜面培养好的球孢白僵菌SJ-05分生孢子接种于液体培养基中,180r/min,26℃,振荡培养3d,将菌液转移至50mL无菌离心管中,10000r/min,离心10min,收集菌体,依据植物基因组DNA提取试剂盒说明书提取菌体DNA。
1.4 PCR扩增及目的片段回收
上游引物Bb-chi-F:5′-AAGCTTATGGCTCCTTTTCTTCAAAC-3′,引入了Hind Ⅲ酶切位点;下游引物Bb-chi-R:5′-GAATTCTTACGCAGTCCCCA-AAGTCC-3′,引入了EcoRⅠ酶切位点。引物由上海生工北京合成部合成。
PCR扩增体系20μL:10×Buffer 2 μL,2.5 mmol/L dNTP 1μL,10μmol/L上游和下游引物各1μL,0.5U/mL rTaqDNA聚合酶0.3μL,10ng/μL DNA 5 μL,无菌超纯水补足至20μL。反应条件:94 ℃ 5 min; 95℃ 30s; 55℃ 30s; 72℃ 1.5 min, 35个循环;72 ℃ 10min;4 ℃保存。
检测PCR产物,回收1100bp左右的目的片段。纯化产物-20℃保存备用。
1.5 纯化产物的连接及转化
将纯化产物与载体在16℃连接过夜(约12 h)后,4 ℃保存。大肠杆菌感受态细胞采用CaCl2法制备。转化大肠杆菌JM109,进行蓝白斑筛选。
1.6 质粒提取及重组质粒鉴定
随机挑取阳性单克隆,加入5 mL LB(含0.1%的Amp)液体培养基,37 ℃下200r/min振荡培养约12~16h。取3~5 mL菌液,参照质粒提取试剂盒方法提取,-20℃保存备用。
用Hind Ⅲ、EcoRⅠ双酶切鉴定重组质粒pMD19-T/chit。经酶切鉴定成功的阳性克隆样品送Sangon公司进行DNA序列测定。
1.7 序列及进化分析
用DNAMAN软件及NCBI网站上的BLAST程序完成序列分析。用DNA Star分析软件完成系统进化树分析。
2 结果与分析
2.1 球孢白僵菌SJ-05几丁质酶基因的克隆及序列分析
提取球孢白僵菌SJ-05 DNA,进行PCR扩增,经琼脂糖凝胶电泳,得到1100bp左右的特异性PCR条带,如图1。将目的片段与pMD19-T载体连接,转化到大肠杆菌JM109感受态细胞,在含有Amp的LB平板培养基上筛选阳性重组子,挑选其中5个阳性克隆,用Hind Ⅲ和EcoRⅠ双酶切鉴定重组克隆,结果表明,5个阳性克隆中均插入了目的片段,大小1100bp左右。
SJ-05几丁质酶基因序列测定结果表明,该基因含有一个完整的开放阅读框,阅读框架全长为1047 bp,几丁质酶基因编码348个氨基酸残基,起始密码子ATG和终止密码子TAA。SJ-05几丁质酶基因的核苷酸序列及对应的氨基酸序列见图2。

图1 几丁质酶基因PCR扩增电泳结果Fig.1 Agarose gel electrophoresis map for PCR product of chitinase gene
2.2 SJ-05几丁质酶基因编码氨基酸序列分析
利用http:∥www.expasy.org/tools/#translate网站提供的蛋白分析软件对菌株SJ-05几丁质酶基因编码氨基酸序列的基本特征进行分析,结果显示,该基因预测的蛋白质分子量为36.924 ku,等电点为5.94。氨基酸组成中带正电荷氨基酸(Arg、Lys)23个,占6.6%,带负电荷氨基酸(Asp、Glu)26个,占7.4%,疏水性氨基酸167个,占47.9%,亲水性氨基酸118个,占33.7%,见表1。
MotifScan软件分析该基因编码的蛋白位点和序列模式表明,其编码蛋白可能含有1个N-糖基化位点,2个酪蛋白激酶Ⅱ磷酸化位点,11个N-端十四烷基化位点,1个蛋白激酶C磷酸化位点,1个几丁质酶-18位点,3个糖基水解酶-18位点,其具体位置如表2和图3所示。

图2 SJ-05几丁质酶基因的核苷酸序列及其推导的氨基酸序列Fig.2 The nucleotide sequence and deduced amino acid sequence of chitinase gene from SJ-05

表1 几丁质酶的氨基酸含量1)Table 1 Amino acid content of chitinase
1) *疏水氨基酸,# 亲水氨基酸。 *Hydrophobic amino acid,# Hydrophilic amino acid.
表2几丁质酶氨基酸序列模块分析结果
Table2Motifanalysisoftheaminoacidsequenceofthepredictedchitinase
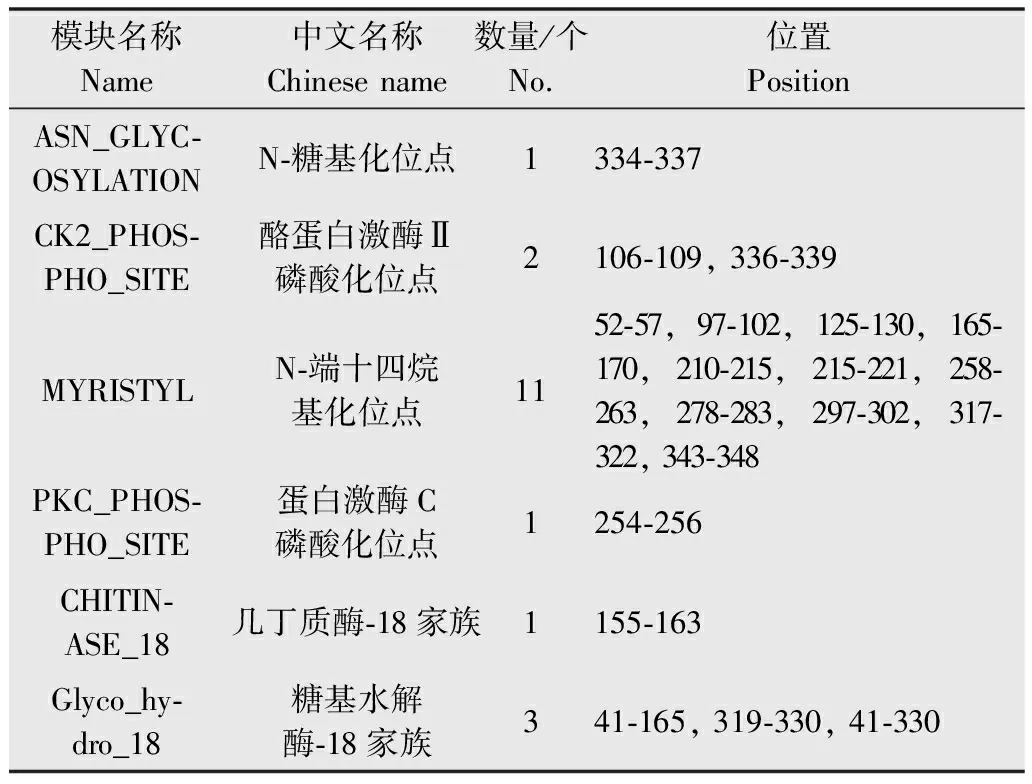
模块名称Name中文名称Chinesename数量/个No.位置PositionASN_GLYC⁃OSYLATIONN⁃糖基化位点1334⁃337CK2_PHOS⁃PHO_SITE酪蛋白激酶Ⅱ磷酸化位点2106⁃109,336⁃339MYRISTYLN⁃端十四烷基化位点1152⁃57,97⁃102,125⁃130,165⁃170,210⁃215,215⁃221,258⁃263,278⁃283,297⁃302,317⁃322,343⁃348PKC_PHOS⁃PHO_SITE蛋白激酶C磷酸化位点1254⁃256CHITIN⁃ASE_18几丁质酶⁃18家族1155⁃163Glyco_hy⁃dro_18糖基水解酶⁃18家族341⁃165,319⁃330,41⁃330

图3 几丁质酶模块位置Fig.3 Motif pattern of the predicted chitinase
运用SOPMA软件http:∥www.expasy.org/tools/#translate预测SJ-05几丁质酶蛋白的二级结构,表明该蛋白含约30.66%的α-螺旋,8.60%的β-折叠,18.62%的延伸链,42.12%的不规则卷曲。该基因编码的蛋白主要由α-螺旋和不规则卷曲构成,而β-折叠和延伸链则散布于整个蛋白质中。在SWISS-MODEL数据库中进行蛋白质三维结构分析,得到该蛋白的三维结构图,见图4。
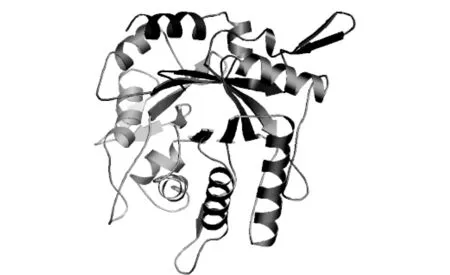
图4 球孢白僵菌SJ-05几丁质酶蛋白三级结构同源建模Fig.4 The 3D structure of the chitinase predicted by Swiss-model
2.3 SJ-05几丁质酶相似性及分子进化
将球孢白僵菌SJ-05几丁质酶基因推导的氨基酸序列进行同源比对,SJ-05与已报道的4株白僵菌属菌株、2株绿僵菌属菌株、1株木霉属菌株、1株链霉菌属菌株和2株苏云金杆菌的几丁质酶氨基酸序列相似性为99.7%~25.9%,相似性最高的菌株为Bb0062(AAN41259.1)。SJ-05与4株白僵菌属菌株的相似性为99.7%~98.3%,与2株绿僵菌属菌株的相似性为80.3%和79.1%,与1株木霉属04-001菌株的相似性为77.1%,与1株链霉菌属e14菌株的相似性为76.1%,与2株苏云金杆菌菌株的相似性最低,分别为26.4%和25.9%。相似性比对见图5。
利用ClustalX2.0和MEG3.1软件对SJ-05及已选的几丁质酶基因的氨基酸序列建立的系统进化树见图6。
3 结论与讨论
彭仁旺等从球孢白僵菌中纯化的几丁质酶分子量分别为32.39 ku和52 ku[11-12];方卫国等克隆了球孢白僵菌的两个几丁质酶基因Bbchit1和Bbchit2,推测分子量分别为33ku左右和46.3ku[13-14],王定锋等从茶卷叶蛾球孢白僵菌菌株中克隆的几丁质酶基因,分子量约为36.78 ku[15]。采自内蒙古准格尔旗地区沙棘木蠹蛾白僵菌中克隆及推测的几丁质酶基因分子量为36.924 ku,可见,白僵菌菌株间几丁质酶基因的分子量有一定的差异,控制的酶也有一定差异。哪些酶活性更高有待进一步分析研究。

图5 几丁质酶基因所推导的氨基酸序列与其他几丁质酶氨基酸序列的相似性比较Fig.5 Multiple alignment of the deduced amino acid sequences of chitinase gene and its homologues
球孢白僵菌中存在多种几丁质酶,在穿透寄主体壁过程中的作用可能也各不相同,因此有必要从昆虫病原真菌中克隆更多的几丁质酶基因,用遗传转化等手段验证它们在侵染寄主过程中各自的作用[16]。除此之外,有研究表明,利用基因工程在昆虫病原真菌中超量表达几丁质酶基因,构建高毒力菌株,可以有效地增强菌株的毒力[17];但也有证据表明单一过量表达几丁质酶基因并不会增强昆虫病原真菌的毒力[18],因此,对白僵菌其他酶类的克隆研究也非常重要,应用多种酶活力来评价白僵菌菌株对寄主昆虫的侵染力。从本研究获得的球孢白僵菌几丁质酶基因与已发表的几丁质酶基因的相似性比较来看,与球孢白僵菌菌株JYBb201-11的核苷酸序列相似性高达99%,与球孢白僵菌菌株Bb0062(AAN41259.1)的氨基酸序列相似性最高,为99.71%。研究几丁质酶基因有助于揭示几丁质酶在侵染寄主过程中的重要作用,推测其与杀虫毒力存在的相关性[19]。

图6 几丁质酶基因推导的氨基酸序列与其他几丁质酶基因的氨基酸序列的进化树比较Fig.6 Phylogenetic relationships of the deduced amino acid sequences of chitinase gene and its homologues
[1] 杨奋勇,许胜利,王瑛凯,等.狗獾控制沙棘木蠹蛾的初步调查[J].中国森林病虫,2007,26(1): 42-43.
[2] 吕丁丁,李增智,王成树.虫生真菌分子致病机理及基因工程改造研究进展[J].微生物学通报,2008,35(3): 443-449.
[3] Rajasekhar Pinnamaneni,Kalidas P,Sambasiva Rao K R S.Cloning and expression ofBbchit1gene ofBeauveriabassiana[J].The Open Entomology Journal,2010,4: 30-35.
[4] Askary H,Benhamou N,Brodeur J.Ultrastructural and cytochemical characterization of aphid invasion by the hyphomyceteVerticilliumlecanii[J].Journal of Invertebrate Pathology,1999,74: 1-13.
[5] Roberta A C,Walquria A.Boophilusmicroplusinfection byBeauveriaamorphaandBeauveriabassianaof subtilisin-like proteases and chitinases[J].Current Microbiology,2005,50: 257-261.
[6] Sohail S Q,George G K.Addition of exogenous carbon and nitrogen sources to aphid exuviae modulates synthesis of proteases and chitinase by germinating conidia ofBeauveriabassiana[J].Archives of Microbiology,2008,189: 589-596.
[7] Kramer K J,Muthukrishnana S.Insect chitinases: molecular biology and potential use as biopesticide[J].Insect Biochemistry Molecular Biology,1997,27: 887-900.
[8] St Leger R J,Joshi L,Bidochka M J,et al.Characterization and ultrastructural localization of chitinases fromMetarhiziumanisopliae,M.flavoviride,andBeauveriabassianaduring fungal invasion of host (Manducasexta) cuticle[J].Applied and Environmental Microbiology,1996,162: 907-912.
[9] Ding X F,Gopalakrishnana B,Johnson L B,et al.Insect resistant of transgenic tobacco expressing an insect chitinase gene[J].Transgenic Research,1998,7: 77-84.
[10]Khemika Songjang,Tawee Donchai,Paranya Chaiyawat,et al.Cloning and expression of chitinase gene isolated from insect pathogenic fungi,BeauveriabassianainEscherichiacoli[J].Chiang Mai Journal of Science[J].2006,33(3): 347 - 355.
[11]彭仁旺,黄秀梨.球孢白僵菌胞内几丁质酶的分离纯化与性质[J].微生物学报,1995,35(6): 472-432.
[12]彭仁旺,管考梅,黄秀梨.球孢白僵菌两种胞外几丁质酶的诱导和纯化[J].微生物学报,1996,36(2): 103-108.
[13]方卫国,肖月华,冷波,等.一种新的球孢白僵菌几丁质酶Bbchit的纯化和基因克隆[C]∥首届中国青年学者微生物遗传学学术研讨会论文摘要集,北京: 2002.
[14]方卫国.昆虫病原真菌降解寄主体壁酶基因的克隆及球孢白僵菌高毒力重组菌株的获得[D].重庆: 西南农业大学,2003.
[15]王定锋,曾明森,王庆森,等.茶卷叶蛾寄生真菌球孢白僵菌几丁质酶基因的克隆与序列分析[J].福建农业学报,2011,26(4): 507-512.
[16]甄伟,杜立新,曹伟平,等.球孢白僵菌HFW-05几丁质酶基因的克隆与序列分析[J].华北农学报,2010,25(1): 36-39.
[17]Fang W,Leng B,Xiao Y,et al.Cloning ofBeauveriabassianachitinase gene Bbchit1and its application to improve fungal strain virulence[J].Applied and Environmental Microbiology,2005,71(1): 363-370.
[18]Screen S E,Hu Gang,St leger R J.Transformants ofMetarhiziumanisopliaesf.anisopliaeoverexpressing chitinase fromMetarhiziumanisopliaesf.acridumshow early induction of native chitinase but are not altered in pathogenicity toManducasexta[J].Journal of Invertebrate Pathology,2001,78(4): 260-266.
[19]王艳君,杨谦.来源于Chaetomiumcupreum的几丁质酶chi58基因克隆及特性分析[J].东北林业大学学报,2008,36(6): 43-47.
CloningandsequenceanalysisofchitinasegenefromBeauveriabassianaSJ-05
Yang Fan1, Liu Chunlai1, Duan Liqing2
(1.InstituteofPlantProtection,HeilongjiangAcademyofAgriculturalSciences,Harbin150086,China;2.CollegeofAgronomy,InnerMongoliaAgriculturalUniversity,Hohhot010019,China)
The chitinase plays an important role in the infection of entomogenous fungus to its host insects.Chitinase gene was amplified and cloned fromBeauveriabassianaSJ-05 isolated from cadaver ofHolcocerushippophaecoluslarvae in the Jungar Banner,Inner Mongolia,and recombinant plasmid pMD19-T/chit was constructed.The results showed thatBbchitgene was 1047 bp in size and encoded 348 amino acids.The molecular weight and theoretical isoelectric point were 36.924 ku and 5.94,respectively.The deduced amino acid ofB.bassianaSJ-05 chitinase gene shared 99.71% homology with that ofB.bassianaBb0062.
Beauveriabassiana; chitinase gene; gene cloning; sequence analysis
2013-02-21
:2013-12-12
国家林业局“948”项目(2006-04-29)
S 476.12
:ADOI:10.3969/j.issn.0529-1542.2014.02.013
* 通信作者 E-mail: duanlq2013@163.com

