绿豆立枯丝核菌研究初报
王 彦,曹志敏,张志肖,苏秋竹,范保杰,刘长友,田 静
(河北省农林科学院粮油作物研究所,河北省作物遗传育种重点实验室,石家庄 050035)
绿豆立枯丝核菌研究初报
王 彦,曹志敏,张志肖,苏秋竹,范保杰,刘长友,田 静*
(河北省农林科学院粮油作物研究所,河北省作物遗传育种重点实验室,石家庄 050035)
本研究通过形态学、菌丝融合群和致病力测定研究,对从河北省石家庄地区绿豆种植区分离的90个立枯丝核菌进行鉴定。在90个分离物中有71个属于AG4,占供试分离物的78.89%,2个属于AG2-2,占供试分离物的2.22%,另外17个分离物与标准菌株不融合,占供试分离物的18.89%;属于AG4的71个分离物中,55个与AG4完全融合(占77.46%),16个与AG4不完全融合(占22.54%)。在温室条件下采用人工接菌法对40个代表性分离物的致病力进行测定,发现不同分离物对同一品种的致病力存在差异,其中分离物R3、R6、R9、R35致病力最强,分离物R23、R31-1致病力最弱。属于AG-4的分离物R3、R6、R9、R35与其他供试分离物致病力差异极显著;属于未知群体的分离物R20、R29和R24之间致病力差异极显著;属于AG2-2的分离物R21、R31-1致病力较弱,且差异不显著。
绿豆; 立枯丝核菌; 菌丝融合群; 致病力
绿豆是豇豆属中的一个栽培种,具有较高的营养价值和药用价值[1],近年来,国内外需求量逐年上升,绿豆种植面积也逐年扩大[2]。由于绿豆的连年种植,绿豆病害发生也随之加重,导致绿豆产量和质量严重下降。在绿豆病害中,由丝核菌引起的苗期立枯病是最重要的病害之一。立枯丝核菌(RhizoctoniasolaniKühn)是一种在自然界中广泛存在的土传植物病原真菌,世界各地的耕作和非耕作土壤均有分布,且寄主范围极广。立枯丝核菌属于多核丝核菌,主要引起植物的烂种、根腐、苗期猝倒和立枯病,导致作物缺苗断垅,被认为是最具破坏力的土传植物病原物之一[3]。本文从形态鉴定、核相测定、菌丝融合群判定和致病力测定等方面对从石家庄地区分离的绿豆立枯病菌分离物进行研究,旨在明确引起该地区绿豆立枯病的病原菌种内分化情况,为绿豆抗病育种及病害防治提供依据。
1 材料与方法
1.1 立枯丝核菌融合群标准菌株
立枯丝核菌融合群标准菌株AG-4、AG2-1、AG2-2、AG-5、AG1-IC和AG1-2B由河北省农林科学院植物保护研究所植物病害生物防治实验室惠赠。
1.2 绿豆立枯病病原菌分离
采用组织分离法[4]对所采集的123株绿豆病样进行病原菌分离,经形态学鉴定,初步确定为丝核菌的分离物在PDA培养基25 ℃恒温培养2~4 d后,挑取单枝菌丝尖端于PDA斜面培养基上培养,以获得单细胞培养物的纯分离物。
1.3 形态学鉴定及核相测定
取0.6cm待测分离物菌饼接于涂有2%琼脂层的载玻片中央,将接菌的载玻片置于保湿的培养皿中,25 ℃培养24~36h,取出,加盖玻片,滴上番红O-KOH染液,镜检。
取0.6cm待测菌饼接于水琼脂培养基平板上,每菌两皿,在菌块周围成45°斜插入4个盖玻片,25 ℃恒温培养,待菌丝长至盖玻片1/2时,取出盖玻片,滴上番红O-KOH(0.5%的番红6mL,3%的KOH 6mL,甘油3mL和蒸馏水85 mL)染液[5],镜检各分离物细胞核数目。
1.4 菌丝融合群判别
参照Parmeter等[6]及陈延熙等改进的玻片配对法[7],将待测丝核菌分离物分别与各标准菌株配对培养,待两菌落前缘交叠约0.5 cm后,取出载玻片,在两菌落交叠处滴加0.001%苯胺兰的稀释乳酚油溶液,加盖玻片,镜检[8-9],按下列鉴定标准判别分离物与标准菌株的融合类型。完全融合:接触细胞间的细胞壁溶解,原生质融合,并有互诱现象。不完全融合或接触融合:菌丝接触后,细胞壁溶解,一细胞内细胞质流入另一细胞内,且有杀死反应。不融合:有或无引诱现象,菌丝接触后,细胞壁不溶解,菌丝自由生长,互不干扰。
1.5 致病力测定
(1)接种方法
取1/4皿菌与700g灭菌土(121℃间歇灭菌2 h)充分混匀后,装入花盆(直径15 cm,高13cm)中,将长至2片三出复叶的幼苗(品种:‘冀绿7号’)移入花盆中,以不接菌灭菌土为空白对照。每处理12棵苗,3次重复,随机排列,定期加水调节土壤湿度,25 ℃恒温培养(12 h光照,12 h黑暗),接菌7 d后,根据病情分级标准,调查发病情况[10]。
(2)调查标准
绿豆立枯病病情分级标准参照Lipps[11]0~5级分级标准:0级无病(无症状);1级为茎秆上有褐斑,不足茎周1/2;2级为病斑达茎周的1/2;3级为病斑达茎周的1/2~3/4;4级为病斑超过茎周3/4,直至全株死亡。
按Lipps & Herr的方法[11]计算平均病情指数,即:

利用 DPS软件对调查结果进行统计分析,并采用 Duncan 新复极差检验对立枯丝核菌的致病力进行多重比较。
2 结果与分析
2.1 绿豆立枯病病原菌分离
从采集的绿豆立枯病苗上分离到90个立枯丝核菌,占分离物的91%。其中30个分离自河北省鹿泉市,占33.33%,60个分离自河北省藁城市,占66.67%,其形态特征符合Parmeter[12]对立枯丝核菌的描述。
2.2 病原菌分离物形态学鉴定及核相测定
显微镜观察结果表明,待测分离物的主要形态如下:菌丝近直角分枝、分枝处缢缩、细胞多核、有明显隔膜、产生菌核,属于立枯丝核菌(如图1)。

图1 绿豆立枯病病原菌菌丝形态Fig.1 Mycelia morphology of the pathogen causing mung bean seedling blight
核相测定结果表明,立枯丝核菌营养菌丝细胞为多核,细胞核数为3~16个,平均数为5个。
2.3 菌丝融合群鉴定
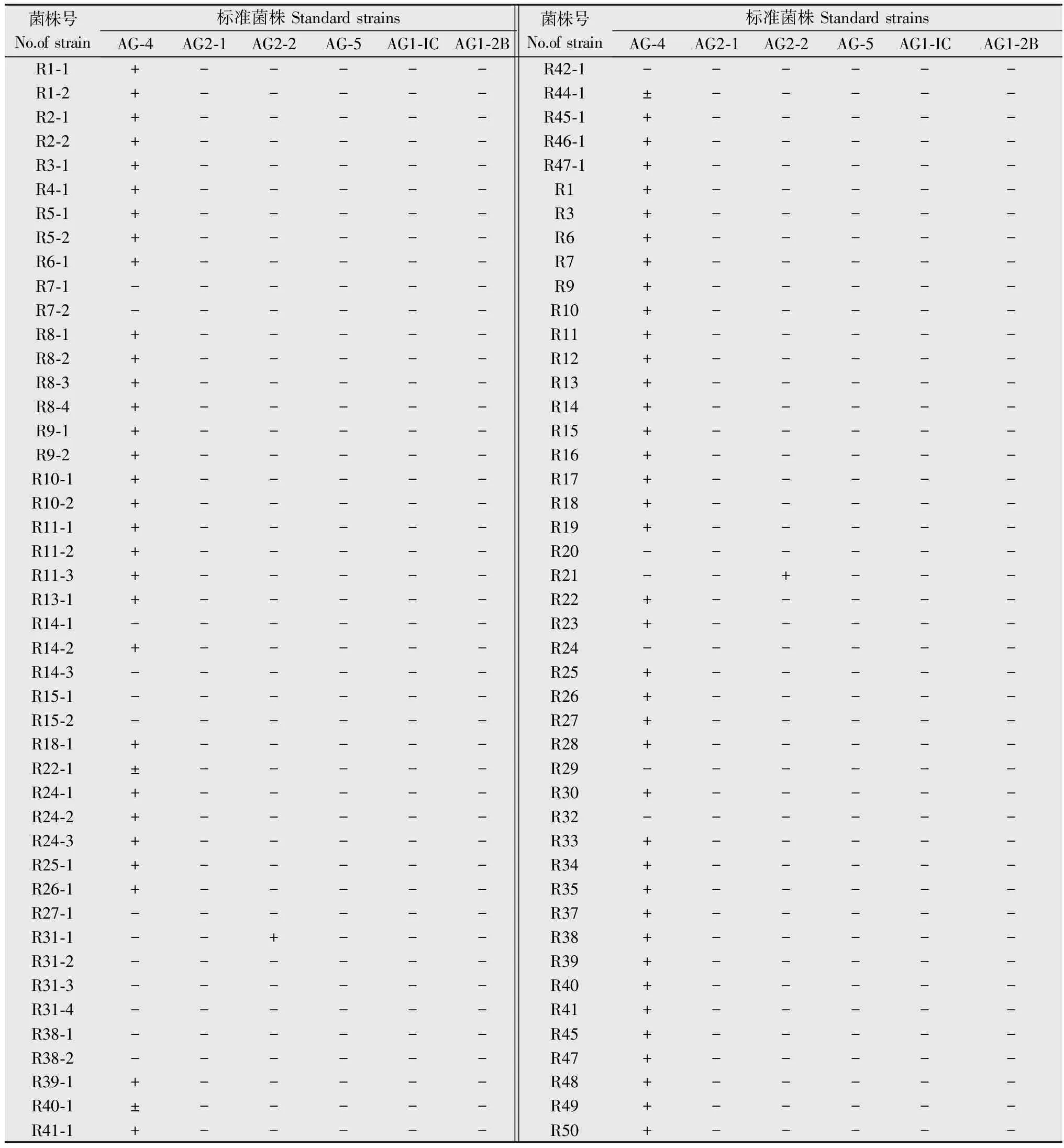
对经形态学鉴定为立枯丝核菌的90个分离物进行菌丝融合群鉴定(表1),结果表明, 71个属于AG4,占供试分离物的78.89%,2个属于AG2-2,占供试分离物的2.22%,另有17个分离物与标准菌株不融合,占供试分离物的18.89%,暂定为未知群体。属于AG4的71个分离物中,55个 与AG4完全融合(占77.46%),16个与AG4不完全融合(占22.54%)(图2)。
表1供试分离物与标准菌株的菌丝融合群判别结果1)
Table1ThehyphaefusionresultsoftestedRhizoctoniasolanistrainsandstandardstrains
菌株号No.ofstrain标准菌株StandardstrainsAG⁃4AG2⁃1AG2⁃2AG⁃5AG1⁃ICAG1⁃2B菌株号No.ofstrain标准菌株StandardstrainsAG⁃4AG2⁃1AG2⁃2AG⁃5AG1⁃ICAG1⁃2BR1⁃1+-----R1⁃2+-----R2⁃1+-----R2⁃2+-----R3⁃1+-----R4⁃1+-----R5⁃1+-----R5⁃2+-----R6⁃1+-----R7⁃1------R7⁃2------R8⁃1+-----R8⁃2+-----R8⁃3+-----R8⁃4+-----R9⁃1+-----R9⁃2+-----R10⁃1+-----R10⁃2+-----R11⁃1+-----R11⁃2+-----R11⁃3+-----R13⁃1+-----R14⁃1------R14⁃2+-----R14⁃3------R15⁃1------R15⁃2------R18⁃1+-----R22⁃1±-----R24⁃1+-----R24⁃2+-----R24⁃3+-----R25⁃1+-----R26⁃1+-----R27⁃1------R31⁃1--+---R31⁃2------R31⁃3------R31⁃4------R38⁃1------R38⁃2------R39⁃1+-----R40⁃1±-----R41⁃1+-----R42⁃1------R44⁃1±-----R45⁃1+-----R46⁃1+-----R47⁃1+-----R1+-----R3+-----R6+-----R7+-----R9+-----R10+-----R11+-----R12+-----R13+-----R14+-----R15+-----R16+-----R17+-----R18+-----R19+-----R20------R21--+---R22+-----R23+-----R24------R25+-----R26+-----R27+-----R28+-----R29------R30+-----R32------R33+-----R34+-----R35+-----R37+-----R38+-----R39+-----R40+-----R41+-----R45+-----R47+-----R48+-----R49+-----R50+-----
1)“+”为完全融合;“±”为不完全融合;“-”为不融合。 “+”: Complete fusion; “±”: Incomplete fusion of two mycelia; “-”: Non-fusion.
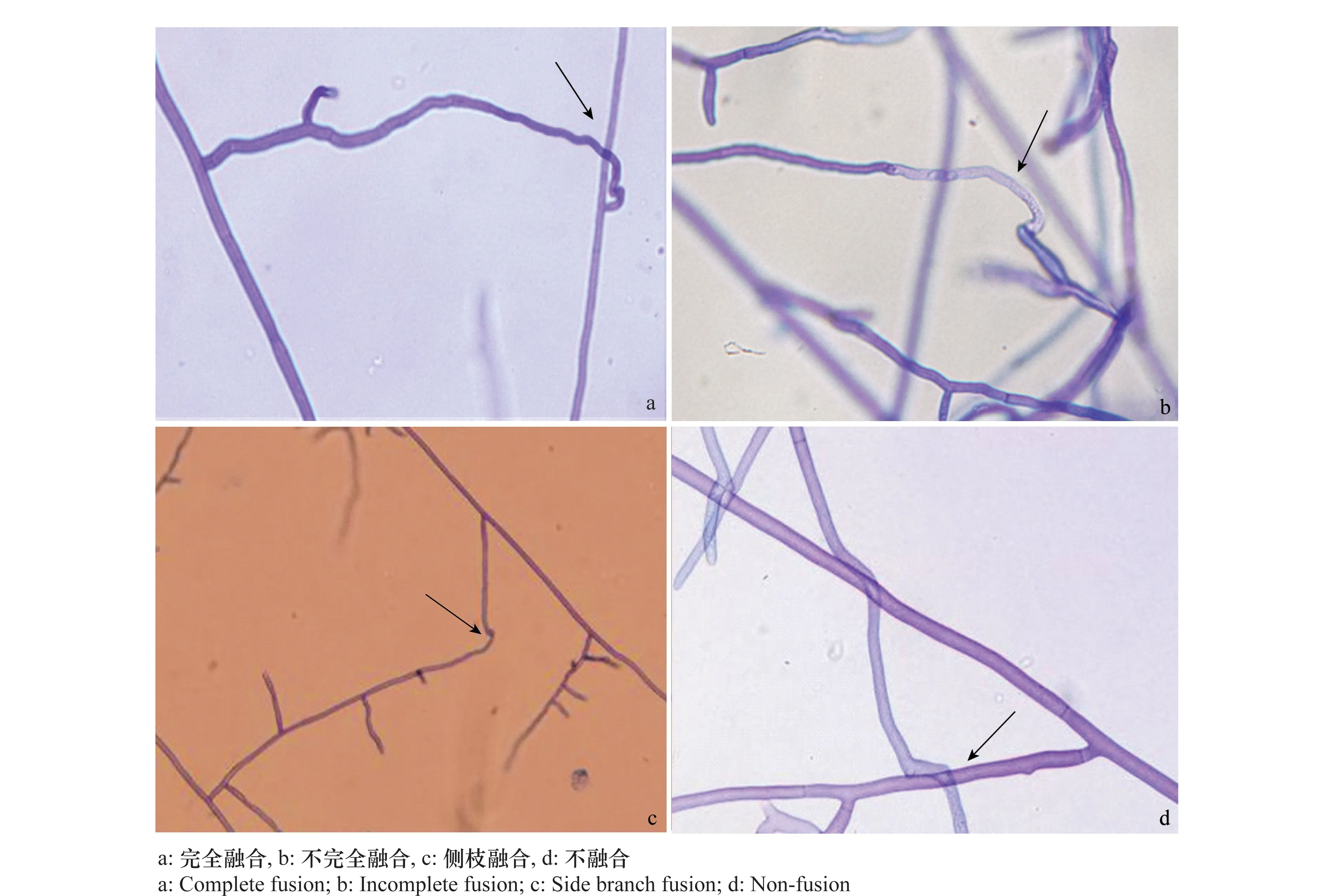
图2 菌丝融合类型Fig.2 The type of hyphal fusion
2.4 病原菌菌株致病力测定
通过人工接菌方法对40个供试分离物进行致病力测定,结果表明,接菌7 d后,供试植株均表现典型的立枯病症状,对照无症状,但不同融合群之间和同一融合群不同分离物之间的致病力存在差异,其中分离物R3、R6、R9、R35致病力最强,分离物R23、R31-1致病力最弱。属于AG-4的35个分离物中,分离物R3、R6、R9、R35与其他供试分离物致病力差异极显著;属于未知群体的3个分离物R20、R29和R24之间致病力差异极显著;属于AG2-2的2个分离物R21和R31-1致病力较弱,且差异不显著[13](表2)。另外,研究发现AG2-2侵染植株后,植株茎秆褐斑不足茎周的1/2,并不致死苗[14]。
表2部分绿豆立枯丝核菌致病力测定
Table2VirulencetestofR.solanistrains
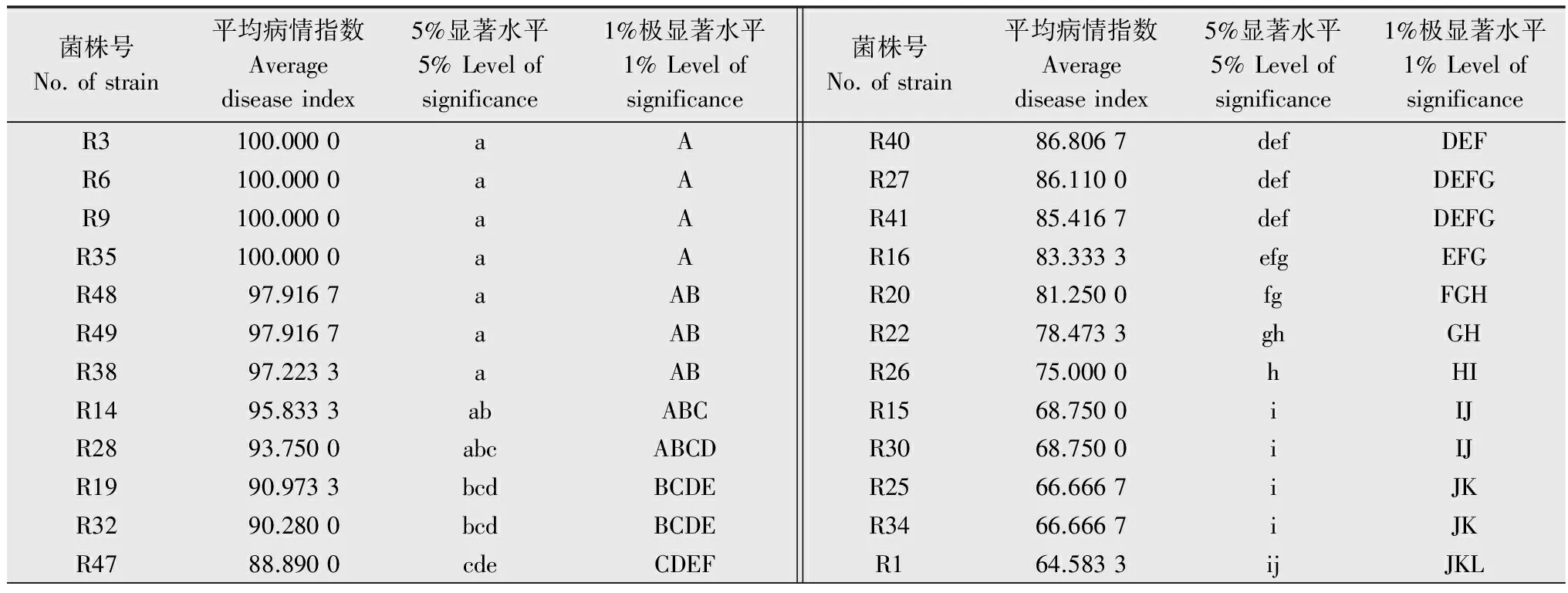
菌株号No.ofstrain平均病情指数Averagediseaseindex5%显著水平5%Levelofsignificance1%极显著水平1%Levelofsignificance菌株号No.ofstrain平均病情指数Averagediseaseindex5%显著水平5%Levelofsignificance1%极显著水平1%LevelofsignificanceR3100.0000aAR6100.0000aAR9100.0000aAR35100.0000aAR4897.9167aABR4997.9167aABR3897.2233aABR1495.8333abABCR2893.7500abcABCDR1990.9733bcdBCDER3290.2800bcdBCDER4788.8900cdeCDEFR4086.8067defDEFR2786.1100defDEFGR4185.4167defDEFGR1683.3333efgEFGR2081.2500fgFGHR2278.4733ghGHR2675.0000hHIR1568.7500iIJR3068.7500iIJR2566.6667iJKR3466.6667iJKR164.5833ijJKL
续表2Table2(Continued)
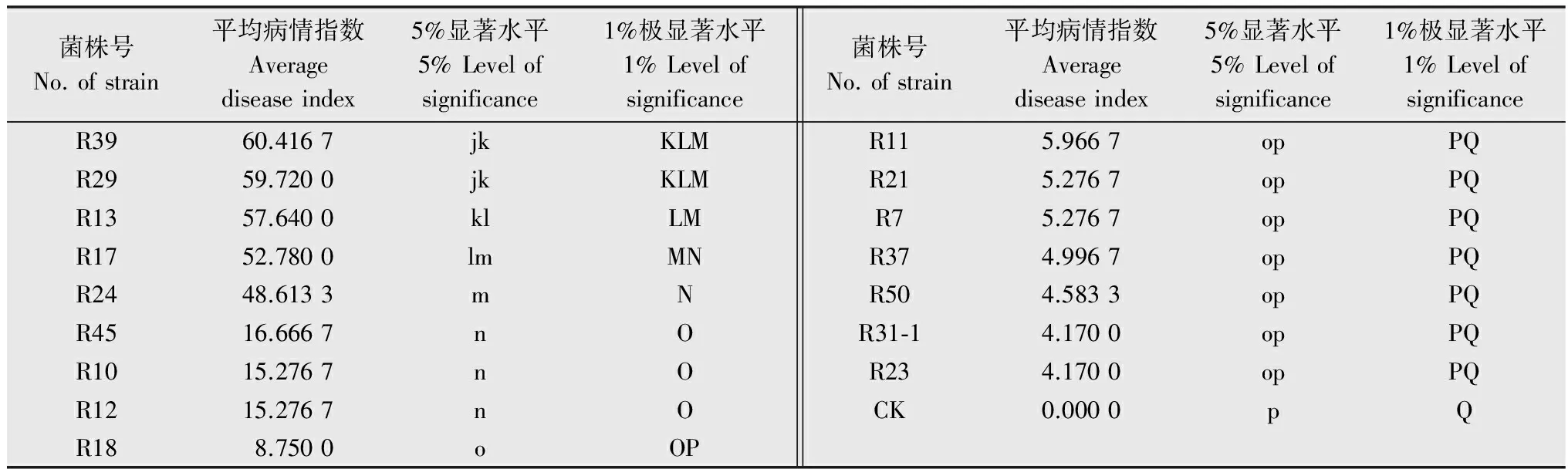
菌株号No.ofstrain平均病情指数Averagediseaseindex5%显著水平5%Levelofsignificance1%极显著水平1%Levelofsignificance菌株号No.ofstrain平均病情指数Averagediseaseindex5%显著水平5%Levelofsignificance1%极显著水平1%LevelofsignificanceR3960.4167jkKLMR2959.7200jkKLMR1357.6400klLMR1752.7800lmMNR2448.6133mNR4516.6667nOR1015.2767nOR1215.2767nOR188.7500oOPR115.9667opPQR215.2767opPQR75.2767opPQR374.9967opPQR504.5833opPQR31⁃14.1700opPQR234.1700opPQCK0.0000pQ
3 讨论
3.1 绿豆立枯丝核菌菌丝融合群研究
国内学者已对多种作物上的立枯丝核菌融合群进行了研究[15-21]。2005年杨金红等[22]对新疆地区6种豆科植物立枯丝核菌融合群类型的研究表明,该地区侵染豌豆、豇豆和花生的优势融合群是AG-2,蚕豆的是AG-4,鹰嘴豆的是AG-1,大豆的是AG-1和AG-2。2009年杨金红[23]又对新疆地区11种豆科植物立枯丝核菌的融合群类型及营养亲和群进行了研究,结果共测定出5个融合群,其中4个融合群下各有2个营养亲和群,说明新疆豆科作物立枯丝核菌各主要菌丝融合群内均有不同程度的分化。
本研究初步明确绿豆立枯丝核菌菌丝融合群组成有AG-4和AG-2-2,其中AG-4出现频率最高,分布最广,是石家庄绿豆立枯病菌的优势融合群,由此可见,绿豆立枯丝核菌也存在菌丝融合群的分化。
3.2 绿豆立枯丝核菌致病力分化研究
目前关于立枯丝核菌致病力等级没有统一的划分标准。李宝栋等[24]关于棉花立枯菌对不同棉花品种的致病力测定研究中,按病情指数的高低将棉花品种划分为高感(病情指数>75)、中感(75≥病情指数≥55)和轻感(病情指数<55)3级。参考棉花分类标准,我们试将立枯丝核菌菌株按病情指数的高低划分为强致病力(病情指数>75)、中等致病力(75≥病情指数≥55)和弱致病力(病情指数<55)3级,本文中属于AG4和未知群体的分离物有强、中、弱之分,属于AG2-2的2个分离物均为弱致病力菌株。由此可见,分离物所属菌丝融合群与分离物的致病力强弱无相关性。
利用致病力测定方法对菌株进行鉴定较分子方法(AFLP等)直观,且能直接反映病菌的致病力强弱及品种抗病性差异。通过致病力测定,确定各种植区的优势菌株,以筛选到适合不同种植区的抗病品种,进行品种的合理布局。
本文仅对采集自石家庄鹿泉市和藁城市的绿豆病苗进行了菌株的分离,并对分离到的菌株进行了菌丝融合群及致病力研究,为进一步明确河北省绿豆种植区立枯病病原菌的分布及其分化情况,需要从河北省各绿豆种植区采集病样,扩大试验样本量,并进行致病力及分子生物学研究,为绿豆立枯病病原菌预警监测体系提供技术支持,同时也为绿豆立枯病病原菌防治提供理论依据,以期减少绿豆立枯病对绿豆生产造成巨大危害。
[1] 王明海,徐宁,包淑英,等.绿豆的营养成分及药用价值[J].农业科技,2012(6): 341-342.
[2] 刘慧.我国绿豆生产现状和发展前景[J].农业展望,2012(6): 36-39.
[3] 刘力,葛起新.华东地区立枯丝核菌融合群鉴定[J].浙江农业大学学报,1987,13(3): 227-233.
[4] 方中达.植病研究方法[M].第3版.北京: 中国农业出版社,1997.
[5] 周而勋,杨媚.从植物病组织中分离丝核菌的快速、简便技术[J].华南农业大学学报,1998,19(1): 125-126.
[6] Parmeter J R,Sherwood R T,Platt W D.Anastomosis grouping among isolates ofThanatephoruscucumeris[J].Phytopathology,1969,59(1): 1270-1278.
[7] 陈延熙,张敦华,段霞渝,等.关于Rhizoctoniasolani菌丝融合分类和有性世代的研究[J].植物病理学报,1985,15(8): 139-143.
[8] 吴秋欣.亲和性实验与高等担子菌的系统学[J].真菌学报,1992,11(4): 249-257.
[9] 喻大昭,杨小军,杨立军.湖北省小麦纹枯病病原菌菌丝融合群研究[J].湖北农业科学,2000(3): 39-42.
[10]肖炎农,李建生,郑用链,等.湖北省玉米纹枯病病原丝核菌的种类和致病性[J].菌物系统,2002,21(3): 419-424.
[11]Lipps P E,Herr L J.Etiology ofRhizoctoniacerealisin sharp eyespot of wheat[J].Phytopathology,1982,72:1574-1577.
[12]Parmeter J R.Rhizoctoniasolani,biology and pathology[M].Berkeley: University of California Press,1970.
[13]肖勇,刘明伟,李刚,等.四川省水稻立枯丝核菌Rhizoctoniasolani的遗传分化与致病力[J].中国水稻科学,2008,22(1): 87-92.
[14]邓振山,张宝成,孙志宏,等.新疆北疆棉田立枯丝核菌不同菌丝融合群致病力的研究[J].植物保护,2006,32(4),36-39.
[15]黄江华,杨媚,周而勋,等.广州地区10种作物立枯丝核菌菌丝融合群测定[J].仲恺农业技术学院学报,2002,15(1): 14-18.
[16]伍恩宇,夏海波,于金凤.茄科蔬菜立枯丝核菌的融合群鉴定[J].植物病理学报,2008,38(4): 429-432.
[17]李克梅,郭庆元,赵莉,等.新疆苜蓿立枯丝核菌菌丝融合群及其致病性研究[J].草业科学,2009(5): 151-154.
[18]杨金红,白丽艳,郭庆元,等.新疆奶花芸豆立枯丝核菌菌丝融合群及其致病性研究[J].新疆农业科学,2006,43(4): 302-305.
[19]井岩,李晓妮,金凤.中国北方棉花主产区立枯丝核菌的融合群鉴定[J].菌物学报,2012,31(4): 540-547.
[20]曹守峰.中国与中亚五国棉花生产与贸易竞争力比较分析[J].中国棉花,2011,38(5): 11-13.
[21]Kuramae E E,Buzeto A L,Ciampi M B,et al.Identification ofRhizoctoniasolaniAG-1-IB in lettuce,AG-4-HG-Ⅰin tomato and melon,and AG-4-HG-Ⅲ in broccoli and spinach,in Brazil[J].European Journal of Plant Pathology,2003,109: 391-395.
[22]杨金红,郭庆元,季良.新疆6种豆科作物立枯丝核菌菌丝融合群研究[J].新疆农业科学,2005,42(6): 382-385.
[23]杨金红.11种豆科作物立枯丝核菌菌丝融合群及营养亲和群研究[J].植物保护,2009,35(6): 83-86.
[24]李宝栋,朱颖初.棉立枯菌对不同棉花品种致病力的测定[J].植物保护,1985,11(6): 31-32.
PreliminaryidentificationofRhizoctoniasolanicausingmungbeanseedlingblight
Wang Yan,Cao Zhimin,Zhang Zhixiao,Su Qiuzhu,Fan Baojie,Liu Changyou,Tian Jing
(InstituteofCerealandOilCrops,HebeiAcademyofAgriculturalandForestrySciences/LaboratoryofCropGeneticandBreedingofHebeiProvince,Shijiazhuang050035,China)
Ninety isolates ofRhizoctoniasolani,collected from the mung bean field in Shijiazhuang region were characterized by morphology,anastomosis group and pathogenicity test.The results showed that all isolates were multinucleate.Seventy-one isolates belonged to the AG4,accounting for 78.89% of the tested isolates,55 isolates were completely fused with AG4 (77.46%),16strains were incompletely fused with AG4 (22.54%).Two isolates belonged to the AG2-2,accounting for 2.22% There were 17 strains that could not fuse with any standard strains,accounting for 18.89%.Virulence test in greenhouse demonstrated that the isolates R3,R6,R9 and R35 were highly virulent,but isolates R23and R31-1were weakly virulent.There were extremely significant difference between the isolates R3,R6,R9,R35 and the others belonging to AG-4,also between the isolates R20,R29 and R24 belonging to unknown group.The isolates R21and R31-1belonging to AG2-2 were weakly virulent and had no significant difference in virulence.
mung bean;Rhizoctoniasolani; anastomosis group; pathogenicity
2013-07-04
:2013-12-03
国家食用豆产业技术体系(CARS-09);河北省科技支撑计划课题(11220108D)
S 435.22
:ADOI:10.3969/j.issn.0529-1542.2014.02.009
* 通信作者 Tel: 0311-87670655; E-mail: nkytianjing@163.com

