烟草青枯病生防细菌的筛选与生防效果研究
王 超, 申成美, 郑 丽, 薛庆云, 郭坚华
(南京农业大学植物保护学院植物病理学系,江苏省生物源农药工程中心,农作物生物灾害综合 治理教育部重点实验室,南京 210095)
烟草青枯病生防细菌的筛选与生防效果研究
王 超, 申成美, 郑 丽, 薛庆云, 郭坚华*
(南京农业大学植物保护学院植物病理学系,江苏省生物源农药工程中心,农作物生物灾害综合 治理教育部重点实验室,南京 210095)
从云南文山烟草种植田烟草植株根围土壤及植株根内生境中分离纯化获得195株细菌,以细菌菌株对青枯雷尔氏菌(Ralstoniasolanacearum)YN10的拮抗作用及其产蛋白酶、几丁质酶、纤维素酶和产嗜铁素的活性作为评价指标对其生防潜力进行赋值,对总赋值得分较高的84株菌株做了聚类分析,选择25株拮抗细菌进行了烟草青枯病温室防效试验。结果表明,聚类分析ARDRA图谱中位于不同组的25株拮抗细菌对烟草青枯病都有不同程度的防治效果,菌株K-1-8、R-3-16、R-3-18的温室防效分别为86.66%、84.94%、87.57%;拮抗细菌的生防效果与总赋值存在正相关,相关系数达0.86。
生防细菌; 烟草青枯病; 酶活性; 赋值评估; 聚类分析
烟草(NicotianatabacumL.)是双子叶植物纲(Dicotyledoneae) 茄科(Solanaceae) 一年生草本植物,具有极高的经济价值,是烟草栽培地区农民收入、地方财政和国家税收的重要来源之一[1]。烟草青枯病是由茄青枯雷尔氏菌(RalstoniasolanacearumE.F.Smith)引起的维管束病害,是一种毁灭性的土传细菌性病害[2],严重影响烟草的产量与品质。
随着烟草种植期延长、病菌致病力发生变化,我国主栽品种‘K326’的抗性逐渐退化,加之栽培管理很难控制,目前烟草青枯病的防治主要依靠化学药剂来控制和减轻危害[3]。化学药剂对青枯病虽能起到一定的控制作用,但由于抗药性和农药残留等问题,青枯病的生物防治因其对环境、生态和人畜的安全性引起国内外学者越来越多的重视[4]。Wang等研究发现拮抗菌株K1、K2 对烟草青枯病有明显的抑制作用,且适当浓度的K1、K2 能改变和破坏青枯菌的形态[5];曾维爱等的研究表明,苗期接种菌根真菌结合生防制剂不仅能够有效地防治烟草青枯病,还能改善烟株的农艺性状,改善烟叶品质[6];刘伟等在烟草根际土壤筛选出一株对烟草青枯菌有较明显抑制作用的甲基营养型芽胞杆菌LW-6[7]。李红丽等认为在病害的原位土壤中分离筛选对病原菌具有拮抗效果的微生物并制成微生物有机肥来防治土传病害,防病的同时可以改善和修复土壤生态环境[8]。
本研究在云南文山烟草种植田烟草植株根围土壤及植株根内生境中分离纯化获得了195株细菌,并以拮抗作用、胞外酶活性以及分泌嗜铁素为指标,结合ARDRA聚类分析选取了25株细菌进行了温室防治试验,为土传病害生防细菌的筛选及烟草青枯病的生物防治提供了方法参考和试验依据。
1 材料与方法
1.1 供试植物及试验材料
供试烟草品种为三生烟(Nicotianatobacum‘Samsun’)。青枯雷尔氏菌(R.solanacearum)YN10由本实验室分离保存。培养基为LB培养基、YGPA培养基[9]和R2A培养基[10]。细菌基因组DNA提取试剂盒购自上海赛百盛基因技术有限公司,引物由上海赛百盛基因技术有限公司合成,PCR扩增反应试剂、限制酶等均购自 TaKaRa 公司。
1.2 样品采集和细菌分离
分离样品取自收获季节的云南省文山市西畴镇石门坎烟草地,田间采用五点取样法,每点取健康植株3株和病株2株,采集部位为烟草植株的根系及根围土(轻拍根系去除根表浮土,用刷子刷下紧附于根表的土即为根围土),病健株分开取样。
取3g根围土壤样品,于无菌三角瓶中加27 mL无菌的0.85% NaCl溶液和3g灭菌玻璃珠120r/min 振荡培养30min,静置5 min后梯度稀释,分别取10-4、10-5、10-6稀释液100μL 涂布在R2A培养基上,每个梯度3个重复,30℃培养48 h。
分别取烟草根系样品若干,用1%次氯酸钠浸泡5 min,70%乙醇浸泡1~2 min,无菌水清洗3次后,取3g样品加27 mL无菌0.85% NaCl溶液研磨,梯度稀释后取100μL 10-1、10-2、10-3稀释液涂于R2A培养基上,每个梯度3个重复,30℃培养48 h。
选菌落数在30~300个的平板,计数,挑取不同大小、形态的菌落分离、纯化,40%甘油保存于-70℃超低温冰箱中,备用。
1.3 细菌对YN10平板抑制活性检测
采用平板对峙法检测分离所得细菌的拮抗活性,病原指示菌为YN10,培养平板使用YGPA培养基,具体操作参考谢永丽等[11]的方法,进行3次独立重复试验,每株参试细菌设置3个重复。
1.4 细菌水解酶活性的测定
1.4.1 蛋白酶活性测定
在蛋白酶平板上(A:脱脂奶粉8 g,溶于300mL水中,115 ℃灭菌10min;B:琼脂8 g,定容至300mL,121℃灭菌20min,A与B分别灭菌后混合)接菌,30℃培养3d后观察透明圈有无,并记录大小[10]。
1.4.2 几丁质酶活性测定
将细菌在以胶体状几丁质[12]为唯一碳源的培养基(Chi-Ayers)上培养(磷酸二氢铵1.0g,氯化钾0.2 g,水合硫酸镁0.2 g,胶体状几丁质1%(W/V)100mL,琼脂20g,pH=7.0),接菌后30℃培养3d,观察透明圈有无,并记录大小[13]。
1.4.3 纤维素酶活性测定
参照Ghose 的方法[14],把准备好的菌株接到纤维素酶活性测定平板上(蛋白胨10g,酵母粉10g,羧甲基纤维素钠10g,氯化钠5 g,磷酸二氢钾1g,琼脂18 g,pH=7.0),30℃培养3d后,用1g/L的刚果红染1h后,倒掉染液,再用1mol/L NaCl溶液浸泡1h,观察透明圈有无,并记录大小。
1.5 产嗜铁素活性测定
参照Shin等的方法[15]。A:① 60.5 mg铬天青S溶于50mL去离子水;② 10mL三价铁溶液(1mmol/L FeCl3·6H2O,10mmol/L盐酸为溶剂);③ 72.9 mg CTAB 溶于40mL去离子水。上述3个溶液混合定容至100mL,pH调至中性,121℃灭菌20min。B:30.24 g Pipes加入 900mL WA培养基,pH=6.8,121℃灭菌20min。A、B液混合倒平板,接菌后30℃培养3d,观察、记录结果。
1.6 细菌的赋值评估
根据Faltin等的方法[16],对拮抗细菌的生防潜力进行赋值评估,评分如下:平板拮抗YN10活性、产蛋白酶、几丁质酶活性和产嗜铁素各3分,其中抑菌圈或透明圈半径0~3mm为1分,3~6mm赋2分,> 6mm的赋3分;产纤维素酶1分,总分为13分。
1.7 细菌聚类分析
利用基因组DNA试剂盒提取细菌的基因组DNA。采用引物U8-27(F)5′-AGAGTTTGA TC(AC)TGGCTCAG-3′和L1494-1514(R) 5′-CTACGG(AG)TACCTTGTTACGAC-3′扩增细菌基因组DNA中的16S rDNA片段[10]。反应体系为25 μL体系,包括10×PCR Buffer 2.5 μL,Mg2+3.75 μL,dNTP 2 μL,引物P1/P2 0.6μL,模板DNA 1μL,rTaq酶0.5 μL和H2O。反应程序为94 ℃ 5 min,94 ℃ 1min,56℃ 1min,72 ℃ 2 min,30个循环,72 ℃ 10min,12 ℃恒定保温。
取10μL 16S rDNA扩增产物用MspI酶切(37 ℃,3h)后于混合凝胶检测(1.5%琼脂糖+1.5% Synergel,1.0× TAE,80V,1.5 h),用GelCompar®Ⅱversion 4.5进行图谱的聚类分析。
1.8 温室防效试验
1.8.1 供试菌株菌悬液及病原菌菌悬液的制备
取保存于-70℃超低温冰箱中的供试细菌菌株及病原菌YN10画线培养于LB及YGPA平板培养基上。在28 ℃下培养24 h后转接于相应培养液中,28 ℃,200r/min,培养24 h成种子液。以1∶100的比率在相应培养液中扩繁。28 ℃,200r/min,扩繁24 h后所得菌液相应培养液稀释,其中供试细菌浓度调至 5×108cfu/mL,YN10浓度调至 5×107cfu/mL,备用。
1.8.2 供试菌株对烟草青枯病的温室防治试验
烟草种子经塑料穴盘育苗后,将生长一致的三叶期烟草幼苗移栽至容积约为355 cm3的一次性塑料杯子中继续培养(温度26~28 ℃,L∥D=14 h∥10h)。待烟草植株生长至6~7叶期时进行处理,生防菌处理组每株苗浇灌20mL供试菌株菌液,对照组浇灌等体积清水。每个处理组24株烟草苗,每个处理3个重复。供试菌株处理7 d后浇灌YN10菌液,每株20mL。病原菌处理后每天观察其生长状况和发病情况,26d后统计最终结果。按照Kempe等[17]提出的病级标准统计病情。病害严重度和防效的计算公式如下:
病害严重度(%)=
生防效果(%)=

1.9 数据分析
在Microsoft Excel中对平板酶活圈、生防效果等数据进行简单处理和相关性分析,显著水平(P<0.05)由DPS v 7.05获得。
2 结果与分析
2.1 烟草不同生境细菌分离结果
从烟草不同生境中共分离到195株细菌,其中健株根围样品分离到80株,病株根围分离到20株,健株根内分离得到53株,病株根内分离得到42株。在不同生境中,细菌种群密度差异明显,烟草根围细菌密度明显高于根内细菌密度,根围生境及根内生境的细菌密度分别约为5.20×105cfu/g rs(rhizosphere soil,根围土),8.90×103cfu/g fw(fresh weight,根鲜重)。
2.2 烟草不同生境细菌对青枯病生防能力评估
对从不同生境分离到的195株细菌进行了离体拮抗试验,共有28株细菌具有拮抗作用。各种酶活性的测定结果表明,产蛋白酶细菌所占的比例最高,为75%;而产几丁质酶的细菌所占的比例最低,为6%;产纤维素酶、嗜铁素的细菌所占的比例分别为19%和66%。
对上述细菌菌株生物防治烟草青枯病的潜力进行了赋值评估,菌株的总得分在1~8分之间。
2.3 聚类分析结果
为了揭示所获得的烟草生境细菌的种群结构,利用ARDRA图谱分析方法对总赋值得分3分以上的84个生防潜力菌株进行了聚类分析(图 1),在70%的相似系数下,84个潜力菌株可划分为12个组(G1~G12)。在这12个组中,只有G1中包含了较多的菌株为36株,G6和G8各含有1株菌株,G9有10株菌株,其他组中包含的菌株数目差别不大,分别为4、6、4、3、5、7、2和5株菌株。
2.4 供试菌株对烟草青枯病的温室防效
根据赋值评估及聚类分析结果,选择了8个组(G1、G2、G3、G4、G7、G9、G10和G11)中的25株细菌作为生防潜力菌株进行烟草青枯病温室防效试验(表1)。接种YN10后第7天对照组烟草植株即开始发病,底部叶片开始萎蔫,而供试菌株处理组均不同程度推迟了植株的感病时间,病原菌接种后第26天进行了病害严重度的统计分析,结果表明25株供试细菌对烟草青枯病均具有一定的防治效果(表1),供试菌株的温室防效达87.57%(图1)。
表125株供试细菌生防潜力的评估及对烟草青枯病的温室防治效果1)
Table1Assessmentsof25testedstrainsfortheirbiocontrolabilitiesandtheirbiocontrolefficiencyontobaccobacterialwiltingreenhouse

供试菌株Testedstrains生防潜力评估Assessmentforbiocontrolability拮抗活性Antagonism蛋白酶Proteases几丁质酶Chitinases纤维素酶Cellulases嗜铁素Siderophores赋值Assessmentpoints温室试验Greenhouseexperiments病害严重度/%Diseaseseverity生防效果/%BiocontrolefficiencyR⁃3⁃1833--28(7.73±0.44)h87.57K⁃1⁃823-128(8.30±0.06)g86.66R⁃3⁃1623--27(9.36±0.32)g84.94R⁃5⁃17-3--36(15.29±0.07)f75.41J⁃3⁃833--17(16.59±0.33)f73.33R⁃2⁃1723-117(18.42±0.09)ef70.37J⁃4⁃233--17(19.26±0.15)e69.03K⁃1⁃723--16(19.45±0.01)e68.72R⁃4⁃1633---6(19.54±0.10)e68.58R⁃1⁃73-1-26(20.58±0.25)e66.91J⁃3⁃323--16(23.42±0.04)e62.34R⁃4⁃202-2-15(26.17±0.26)d57.92K⁃1⁃9-221-5(26.41±0.03)d57.54R⁃2⁃8211-15(26.42±0.08)d57.52K⁃1⁃5-3--25(27.78±0.01)cd55.33R⁃3⁃1413---4(27.78±0.09)cd55.33R⁃1⁃1723---5(29.34±0.10)cd52.82R⁃4⁃11311-6(29.45±0.39)cd52.64R⁃4⁃1223-1-6(30.27±0.05)c51.32R⁃5⁃2023--16(31.59±2.40)c49.21R⁃3⁃1123-1-6(33.38±0.43)c46.33R⁃2⁃1113---4(36.50±0.18)bc41.31K⁃1⁃612-1-4(37.55±0.22)bc39.61J⁃3⁃21---23(41.23±1.42)b33.69R⁃5⁃183---14(41.37±1.46)b33.47对照Control------(62.19±1.01)a-
1) 数值为平均值±标准差,不同字母表示处理间在P<0.05的显著水平差异显著(LSD test)。 The values are mean ± SD.Different small letters within a column indicate significant difference by the LSD test (P<0.05).

图1 供试细菌R-3-18对烟草青枯病的温室防效Fig.1 Effects of the tested strain R-3-18 against tobacco bacterial wilt in greenhouse
2.5 相关性分析
对25株供试细菌的温室防效和生防潜力总赋值进行了相关系数分析,以确定我们所采用的赋值系统的可行性。结果显示(图 2),温室防效与总赋值之间存在正相关,相关系数为0.86。
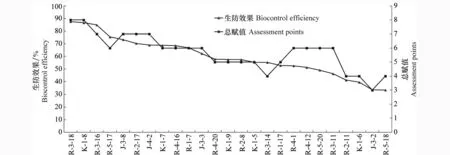
图2 生防潜力菌株总赋值与温室防效的相关性Fig.2 Correlation analysis between assessment points of potential biocontrol agents and their biocontrol efficiency in greenhouse
3 讨论
在植物根际和土壤中存在着大量的细菌,其中包括很多对病原菌具有抑制作用的拮抗细菌,可以利用特定的方法分离培养获得[18]。针对青枯病的土传性、维管束发病特点,我们从烟草根围和根内生境分离细菌,通过平板拮抗活性、产酶活性及嗜铁素分泌等一系列离体试验对所得菌株进行赋值,结合ARDRA聚类分析建立了一个快速、高效的生防菌筛选体系,从云南文山烟草种植田烟草生境分离纯化获得195株细菌中筛选出11株温室防治青枯病效果在60%以上的生防细菌。因此,对于植物土传病害来说,根际土壤和根组织是生防细菌的良好来源。
一个恰当的体外评价系统对生防菌的高效筛选来说意义重大,Berg等针对马铃薯真菌病害的生物防治建立了筛选内生细菌的评价系统[19],对于烟草青枯病生防细菌的筛选,本研究以拮抗活性以及蛋白酶、几丁质酶、纤维素酶和嗜铁素等抗细菌物质作为体外评估指标,筛选出的供试细菌生防潜力总赋值与温室防效的相关系数达0.86,验证了该筛选体系的可靠性,同时表明拮抗作用和抗菌物质是25株生防细菌防治烟草青枯病的主要作用机制。生防细菌的作用机理包括产生抗菌物质、种群竞争和诱导抗病性等许多方面[20]。因此,要构建一个全面准确的生防细菌高效筛选体系,我们还需要综合更多的作用机制来全面评估供试菌株的生防潜力。
本研究中发现了3株细菌R-3-18、K-3-16和R-5-17在温室试验中表现了良好的生防潜力,经16S rDNA序列比对鉴定为微杆菌属(Microbacteriumspp.)和微小杆菌属(Exiguobacteriumspp.)细菌,作为首次发现这两个属细菌在烟草青枯病生物防治方面的效果,我们已对其生防机理进行了深入探究(另文发表)。
受烟草生长环境影响,青枯病的田间生物防治相对困难,常规生物防治中单一菌剂在复杂的环境中适应性较差,从而导致防治效果偏低[21-23]。本研究筛选得到了11株温室防效较好的菌株,其田间防效需进一步验证,两株细菌及多株细菌复配使用也值得深入探究。
[1] 朱贤朝,王彦亭,王智发.中国烟草病害[M].北京: 中国农业出版社,2002: 152-162.
[2] Seo S,Gomi K,Kaku H,et al.Identification of natural diterpenes that inhibit bacterial wilt disease in tobacco,tomato and Arabidopsis[J].Plant and Cell Physiology,2012,53(8):1432-44.
[3] 周训军,王静,杨玉文,等.烟草青枯病研究进展[J].微生物学通报,2012,39(10): 1479-1486.
[4] 陈程,黎定军,陈 武.烟草青枯病生物防治研究进展[J].作物研究,2011,25(6): 639-642.
[5] Wang A A,Zhao Z F,Liu Z Z,et al.Effect of K1,K2 anti-bacterial agents on tobaccoRalstoniasolanacearum[J].Engineering,2010,2: 930-934.
[6] 曾维爱,龙世平,李宏光,等.苗期接种不同丛枝菌根真菌对烟草青枯病防治效果的影响[J].南方农业学报,2011,42(6): 612-615.
[7] 刘伟,沈小英,段军娜,等.抗烟草青枯病菌的芽胞杆菌筛选和鉴定[J].植物保护学报,2013,40(1): 95-96.
[8] 李红丽,郭夏丽,李清飞.抑制烟草青枯病生物有机肥的研制及其生防效果研究[J].土壤学报,2010,47(4): 798-801.
[9] 方中达.植病研究方法[M].第3版.北京: 中国农业出版社,1998.
[10]Yang J H,Liu H X,Zhu G M,et al.Diversity analysis of antagonists from rice-associated bacteria and their application in biocontrol of rice diseases[J].Journal of Applied Microbiology,2008,104:91-104.
[11]谢永丽,高学文.高寒草甸根围拮抗芽胞杆菌筛选鉴定及脂肽化合物分析[J].中国生物防治学报,2012,28(3): 367-374.
[12]Roberts W K,Selitrennikoff C P.Plant and bacterial chitinases differ in antifungal activity[J].Journal of General Microbiology,1988,134: 169-176.
[13]郑颖.利用根围促生细菌防治香蕉枯萎病的筛选策略研究及大田防效验证[D].南京: 南京农业大学,2010.
[14]Ghose T K.Measurement of cellulase activities[J].Pure and Applied Chemistry,1987,59: 257-268.
[15]Shin S H,Lim Y,Lee S E,et al.CAS agar diffusion assay for the measurement of siderophores in biological fluids[J].Journal of Microbiological Methods,2001,44: 89-95.
[16]Faltin F,Lottmann J,Grosch R,et al.Strategy to select and assess antagonistic bacteria for biological control ofRhizoctoniasolaniKühn[J].Canadian Journal of Microbiology,2004,50: 811-820.
[17]Kempe J,Sequeira L.Biological control of bacterial wilt of potatoes: Attempts to induce resistance by treating tubes with bacteria[J].Plant Disease,1983,67(5): 499-501.
[18]程亮,游春平,肖爱萍.拮抗细菌的研究进展[J].江西农业大学学报,2003,25(5): 732-737.
[19]Berg G,Krechel A,Ditz M,et al.Endophytic and ectophytic potato associated bacterial communities differ in structure and antagonistic function against plant pathogenic fungi[J].FEMS Microbiology Ecology,2005,51:215-229.
[20]刘邮洲,陈志谊,梁雪杰,等.番茄枯萎病和青枯病拮抗细菌的筛选、评价与鉴定[J].中国生物防治学报,2012,28(1):101-108.
[21]黄世群,丁佶,石万成.防治青枯病(姜瘟病)的生物农药——青枯停[J].四川农业科技,2008(3): 53.
[22]柳辉林,张剑,徐隆根,等.荧光假单胞3000亿个/g粉剂防治烟草青枯病田间药效试验[J].农药科学与管理,2008,29(6):24-26.
[23]魏鸿刚,李淑兰.防治作物青枯病和枯萎病的微生物农药——0.1亿 CFU/g多粘类芽胞杆菌细粒剂[J].世界农药,2008,30(1): 51-52.
Isolationandscreeningofantagonisticbacterialstrainsandtheirbiocontrolefficiencyagainstbacterialwilt
Wang Chao, Shen Chengmei, Zheng Li, Xue Qingyun, Guo Jianhua
(DepartmentofPlantPathology,CollegeofPlantProtection,NanjingAgriculturalUniversity;EngineeringCenterofBioresourcePesticideinJiangsuProvince;KeyLaboratoryofIntegratedManagementofCropDiseasesandPests,MinistryofEducation,Nanjing210095,China)
In order to screen antagonistic bacteria for controlling tobacco bacterial wilt,195 bacterial strains were isolated and purified from rhizosphere soil and endorhiza of tobacco plants in Wenshan,Yunnan Province.Assessment was made according to their antagonistic activity againstRalstoniasolanacearumYN10and the ability to secrete hydrolytic enzymes and siderophoresinvitro.Eighty-four strains with higher assessment points were selected for cluster analysis.Finally,the antagonistic activity of 25 potential biocontrol agents(BCA)againstR.solanacearumwere investigated to in greenhouse.Three BCA isolated,K-1-8,R-3-16and R-3-18 were demonstrated to have good control efficiency on tobacco bacterial wilt,with the efficiency of 86.66%,84.94% and 87.57%,respectively.The results of the assessment system were positively correlated (r=0.86) with those obtained from the greenhouse experiment.
biocontrol agents; tobacco bacterial wilt; enzyme activity; assessment; cluster analysis
2013-06-26
:2013-08-31
国家自然科学基金项目(31177809)
S 476
:ADOI:10.3969/j.issn.0529-1542.2014.02.008
* 通信作者 E-mail: jhguo@njau.edu.cn

