索拉非尼治疗中晚期肝细胞癌疗效及血清甲胎蛋白水平变化意义分析
唐大平,林如景,王学健
肿瘤化疗
索拉非尼治疗中晚期肝细胞癌疗效及血清甲胎蛋白水平变化意义分析
唐大平,林如景,王学健
目的探讨索拉非尼治疗中晚期肝细胞癌(HCC)的疗效,并考察应用索拉菲尼后血清甲胎蛋白(AFP)水平变化以及AFP应答对于HCC患者预后影响,为索拉非尼治疗HCC效果评价提供临床依据。方法经病理证实或临床确诊的中晚期HCC患者61例,连续口服索拉非尼,根据实体肿瘤的疗效评价标准(RECIST)进行疗效评价,并在第6周检测患者血清AFP水平,并进行影像学检查,应用Cox比例风险模型检测HCC患者风险比。结果61例患者中位无进展生存期(PFS)为7个月(95%CI 2.1~14.3个月),中位总生存时间(OS)为11个月(95%CI 7.2~23.6个月)。RECIST 评定,CR 2例(3.3%),PR 6例(9.8%),SD 37例(60.7%),PD 16例(26.2%),疾病控制率为73.8%。AFP应答组与非应答组PFS与OS差异有统计学意义(P<0.05);而影像学肿瘤控制组与影像学肿瘤进展组PFS与OS差异均无统计学意义(P>0.05)。AFP应答组PFS与OS的风险比分别为0.58(95%CI 0.26~0.97)和0.68(95%CI 0.31~0.89),而影像学肿瘤控制组PFS与OS的风险比分别为0.96(95%CI 0.35~1.57)和0.98(95%CI 0.71~2.46)。在多因素Cox回归分析中,CLIP评分和AFP应答这两个因素均具有显著性。服用索拉非尼主要不良反应为手足皮肤反应和白细胞、血小板减少,经对症处理或减小剂量后均可明显缓解。结论索拉非尼治疗中晚期肝细胞癌疗效显著, AFP应答可以作为监测索拉非尼治疗中晚期肝细胞癌疗效的检测标志物。
索拉非尼;肝细胞癌,中晚期;甲胎蛋白;疾病无进展时间;总生存时间
索拉非尼(Sorafenib)作为一种新型分子靶向抗癌药物,目前临床上已应用于治疗晚期肝细胞癌(HCC), 可显著延长晚期HCC患者的疾病无进展生存期和总生存期,并且患者耐受性良好[1]。其抗肿瘤的作用位点为生长因子受体和酪氨酸激酶,包括血管内皮生长因子受体-1(vascular endothelial growth factor receptor-1,VEGFR-1)、血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)、干细胞因子受体 (KIT)、类Fms样酪氨酸激酶-3(FLT3)[2]。肝细胞癌占原发性肝癌的70%~85%,而且35%~45%的肝细胞癌患者发现时已经发展为中晚期。对于发现时已不能行手术治疗的中晚期肝细胞癌患者,索拉非尼是一种新的选择,相关研究显示[3~5],应用索拉非尼可以显著延长中晚期HCC 患者生存时间。然而最近研究发现,由于索拉菲尼并不像常规化疗药物那样具有细胞毒性而是直接作用于肿瘤细胞,所以Chan等[6]和Vora[7]等认为以影像学肿瘤应答作为评价HCC疗效标准并不完整,并认为HCC患者血清甲胎蛋白(AFP)水平变化与预后显著相关。本研究总结我院服用索拉非尼治疗的61例晚期HCC患者的资料, 探讨索拉非尼治疗中晚期 HCC的疗效和安全性以及患者血清AFP应答对患者预后的影响。
1 资料与方法
1.1 临床资料 收集2009年3月—2011年3月61例中晚期肝细胞癌患者,中位年龄58(37~75)岁,其中男44例(72.1%),女17例(27.9%);总胆红素中位水平173.8(24.1~374.6)μmol/L;HBV 52例,HCV 6例,混合感染3例;BCLC分期,B期19例,C期42例;Child-Pugh分级,A级52例,B级9例;ECOG评分,1分55例,2分6例。入选标准: 61例患者均经过CT和MR检查,其中27例患者根据病理明确诊断为HCC,36例患者符合临床诊断标准:AFP≥400 μg/L,存在1种影像学肝内占位病变,或AFP<400 μg/L,存在2种影像学肝内占位病变。所有病例均经外科评估不适合手术治疗。所有患者肝肾功能未严重受损,PLT≥60×109/L,INR≤2.3,ALT≤正常值上限的5倍,SCr≤正常值上限1.5倍,患者至少具有1个可以检测的靶病灶,用于实体肿瘤疗效评估标准(RECIST)评估。本研究经过我院伦理委员会批准,全部患者家属均签署知情同意书。
1.2 治疗方法 采取连续服药方案,400 mg/次,每天2次,直至出现疾病进展、患者死亡,或者出现需要减量或停药的III级或IV级不良反应。如患者出现III级或IV级药物不良反应则将索拉非尼减至200 mg/次,每天2次,或停药等待药物不良反应减轻至I级或II级后再恢复至400 mg/次,每天2次。
1.3 疗效评估 每治疗1个周期,通过CT检查肿瘤病灶,按照RECIST评价治疗效果,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD,确认已稳定4~6周)和疾病进展(PD)。将CR+PR+SD定义为影像学肿瘤控制(DCR)。无进展生存期(progression free survival,PFS)为患者接受治疗至肿瘤出现进展或治疗中患者死亡的时间。总生存时间(overall survival,OS)为患者接受治疗至患者死亡的时间。
1.4 AFP测定 本研究应用电化学发光法检测AFP水平,采用瑞士罗氏Cobas e411全自动分析仪及其配套AFP检测试剂,仪器及试剂操作和使用均按照说明书进行。
1.5 生存分析 为了考察HCC患者生存时间与AFP水平相关性,应用Kaplan-Meier法和时序检验(Log-rank)检测生存概率,将患者根据AFP水平分为2个组,在治疗第6周时,AFP水平下降>50%定义为AFP应答,AFP水平下降≤50%定义为AFP非应答[7]。
1.6 药物不良反应评价 依美国国立癌症研究所不良事件通用标准 3.0版评估,将毒性分为I~V级,对61例中晚期HCC患者不良反应的严重度进行评价,I级不良反应是指轻微的,通常无症状,且不需要对机体进行干预治疗的不良反应;II级不良反应是指通常有临床症状,需要再进行药物干预,但不影响日常生活;III级不良反应是指可能造成不良后果,通常症状复杂,需要住院治疗等积极干预;IV级不良反应是指可能对生命构成潜在威胁的不良反应,导致器官损害或器官功能的丧失;V级不良反应是指患者死亡。
1.7 统计学方法 采用SPSS 16.0软件处理数据。以χ2检验分析各项临床指标与治疗效果的相关性,非正态分布计量数据采用Mann-Whitney U检验,生存分析采用Kaplan-Meier法并进行Log-rank时序检验,用Cox比例风险模型进行多因素分析,所有统计结果以P<0.05为差异有统计学意义。
2 结 果
2.1 治疗效果 61例患者基础AFP水平为30.8~58 014.5 μg/L,患者经过6周索拉非尼治疗后,平均AFP水平下降18.3%,中位PFS为7个月(95%CI 2.1~14.3个月),中位OS为11个月(95%CI 7.2~23.6个月),见图1。根据RECIST标准进行疗效评价,CR 2例(3.3%),PR 6例(9.8%),SD 37例(60.7%),PD 16例(26.2%),疾病控制率为73.8%。
2.2 血清AFP变化与PFS及OS关系 61例HCC患者中,AFP应答组27例AFP非应答组34例。AFP应答组和非应答组PFS分别为13个月(95%CI 5.3~20.4个月)和6个月(95%CI 2.3~13.3个月),两者比较差异有统计学意义(P=0.038);AFP应答组和AFP非应答组中位OS分别为19个月(95%CI 12.5~27.3个月)和9个月(95%CI 7.3~18.2个月),差异亦有统计学意义(P=0.032)。见图2。2组患者Child-Pugh分级和CLIP评分均无显著差异(P>0.05),AFP应答组年龄和ALT水平均高于AFP非应答组(P<0.05)。见表1。
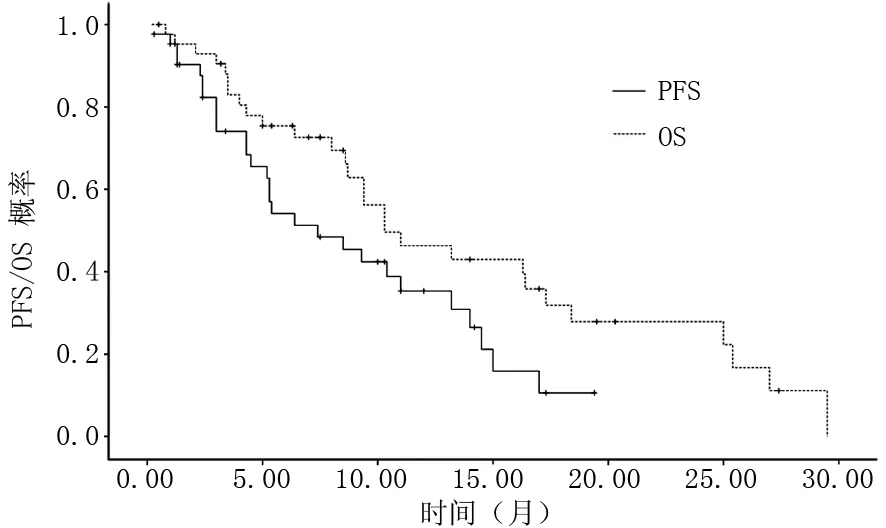
图1 索拉非尼治疗HCC总PFS和OS曲线
表1 AFP应答组与非应答组临床特征比较
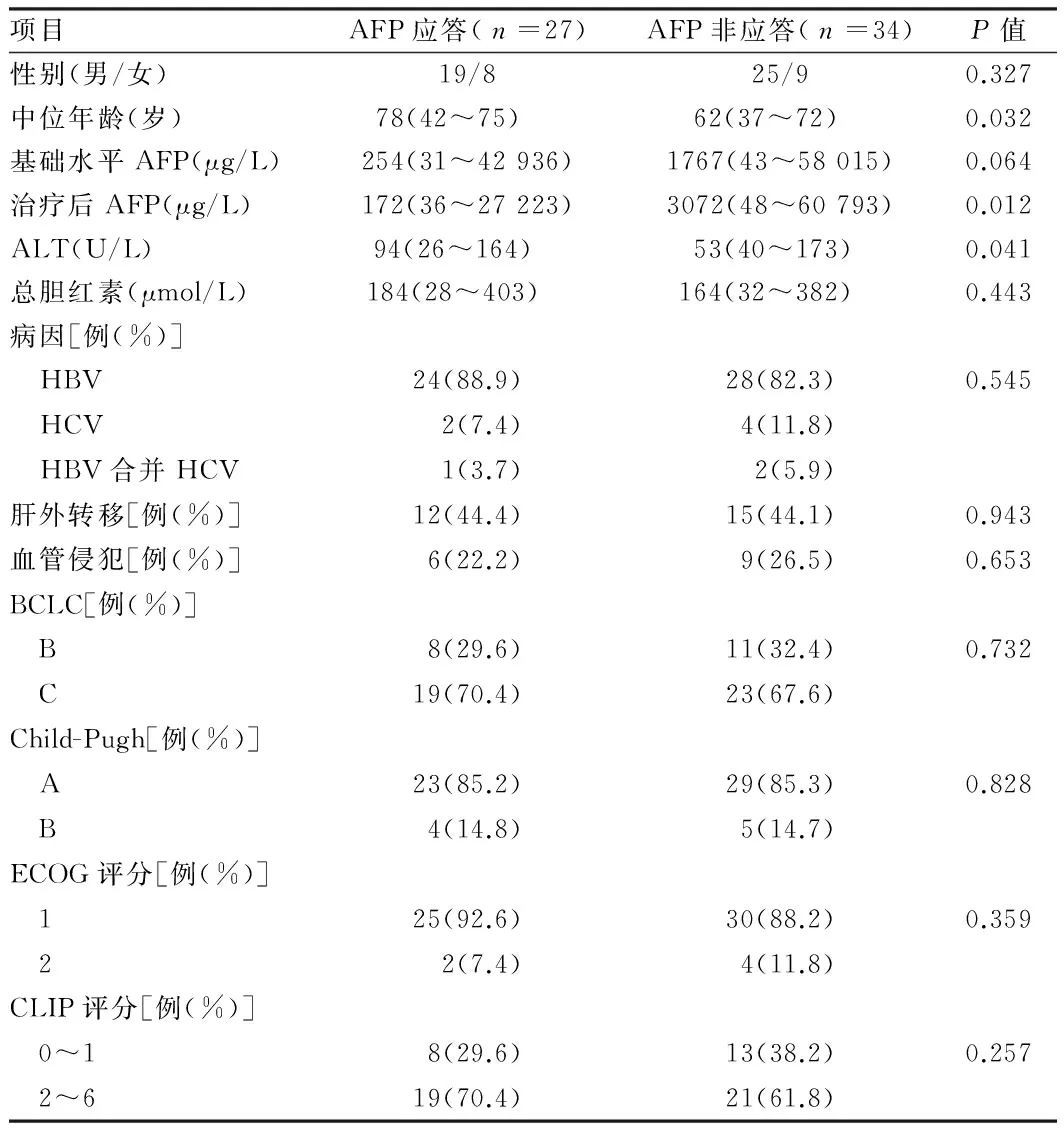
项目AFP应答(n=27)AFP非应答(n=34)P值性别(男/女)19/825/90.327中位年龄(岁)78(42~75) 62(37~72) 0.032基础水平AFP(μg/L)254(31~42936)1767(43~58015)0.064治疗后AFP(μg/L)172(36~27223)3072(48~60793)0.012ALT(U/L)94(26~164) 53(40~173) 0.041总胆红素(μmol/L)184(28~403) 164(32~382) 0.443病因[例(%)] HBV24(88.9)28(82.3)0.545 HCV2(7.4)4(11.8) HBV合并HCV1(3.7)2(5.9)肝外转移[例(%)]12(44.4)15(44.1)0.943血管侵犯[例(%)]6(22.2)9(26.5)0.653BCLC[例(%)] B8(29.6)11(32.4)0.732 C19(70.4)23(67.6)Child-Pugh[例(%)] A23(85.2)29(85.3)0.828 B4(14.8)5(14.7)ECOG评分[例(%)] 125(92.6)30(88.2)0.359 22(7.4)4(11.8)CLIP评分[例(%)] 0~18(29.6)13(38.2)0.257 2~619(70.4)21(61.8)
2.3 影像学肿瘤控制与PFS及OS关系 61例HCC患者应用CT检测,分为影像学肿瘤控制组(n=45)和影像学肿瘤进展组(n=16)。影像学肿瘤控制组和影像学肿瘤进展组中位PFS分别为7个月(95%CI 3.0~13.6个月)和6个月(95%CI 2.8~14.5个月)(P=0.147)。影像学肿瘤控制组和影像学肿瘤进展组中位OS分别为12个月(95%CI 8.7~22.6个月)和7个月(95%CI 2.5~11.9个月)(P=0.724)。2组患者中位PFS和中位OS均无统计学差异,见图3。
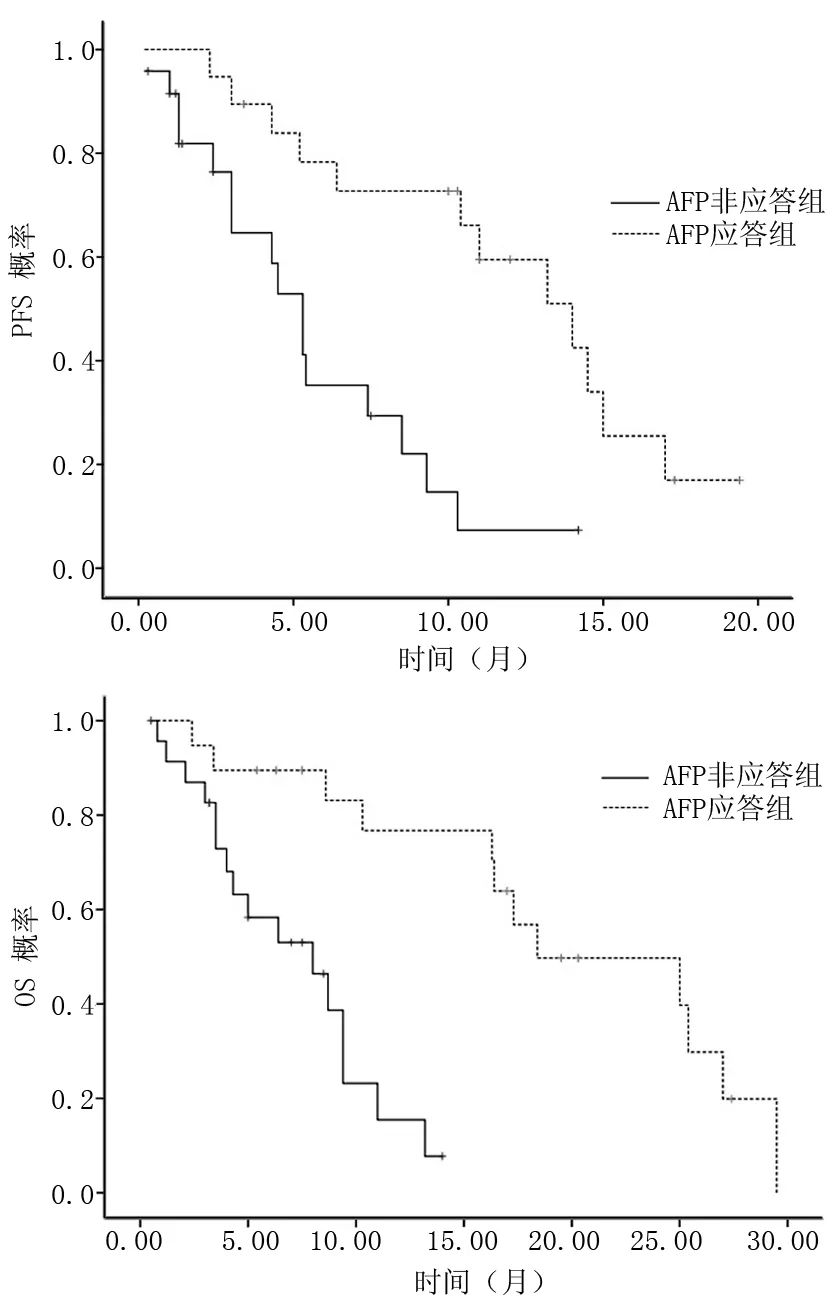
图2 索拉非尼治疗HCC AFP应答组与AFP非应答组PFS和OS曲线
2.4 AFP应答和影像学肿瘤控制对于PFS及OS风险比(HR)分析 为了考察AFP应答作为一种索拉非尼治疗HCC标志物,本研究分别考察了2种应答对于PFS和OS的风险比。AFP应答组的PFS和OS的风险比别为0.58(95%CI 0.26~0.97)和0.68(95%CI 0.31~0.89),说明AFP水平下降≥50%的患者具有更长的PFS和OS。而影像学肿瘤控制组PFS和OS的风险比分别为0.96(95%CI 0.35~1.57)和0.98(95%CI 0.71~2.46),说明影像学肿瘤控制并不是很好的预测患者预后的参数。见表2。

表2 AFP应答组与影像学肿瘤控制组PFS和OS比较
2.5 HCC患者预后多因素分析 应用多因素Cox回归分析,发现只有AFP应答和CLIP评分系统这2个因素具有统计学意义(P<0.05),见表3。说明除了对HCC患者具有良好预测能力的CLIP评分系统外,AFP应答也可以作为HCC监测有效指标,可以作为预测索拉非尼治疗HCC患者预后的参数。

图3 索拉非尼治疗HCC影像学肿瘤控制组与影像学肿瘤进展组PFS和OS曲线
表3 Cox比例风险模型风险比分析

指标HR95%CIP值性别(男/女)1.760.97~2.730.141年龄1.200.87~1.220.147病因(HBV/其他)1.340.45~2.630.344ALT水平0.850.82~1.100.096AFP应答0.570.43~0.820.012肝外转移1.210.61~1.590.719血管侵犯1.720.97~2.410.084CLIP评分(2~6/0~1)2.411.56~4.380.007Child-Pugh评分1.650.68~1.870.767ECOG评分1.320.75~1.820.340
2.6 药物不良反应发生率及剂量调整 HCC患者出现I、II级不良反应42例,主要为手足皮肤反应、乏力、白细胞和血小板降低等。III级不良反应4例,主要为手足综合征、贫血、腹泻、呕吐、口腔黏膜炎、水肿、甲状腺功能减低。对于III级不良反应的白细胞、血小板降低和呕吐患者将索拉非尼从400 mg/次,每天2次,减至200 mg/次,每天2次,之后患者不良反应均减轻至II级。对于贫血患者,应用铁剂补充治疗,手足综合征的患者应用中药类洗剂、佩戴手套等方法保护手足皮肤,甲状腺功能减低的患者口服甲状腺素片,腹泻患者口服止泻药,上述5种不良反应均可得到有效控制而且不需要索拉非尼减量。 I、II级不良反应经过对症治疗,患者基本可以耐受。
3 讨 论
索拉非尼作为一种新型多激酶抑制剂, 在体外试验中, 索拉非尼表现出显著的抗肿瘤作用[8]。相关研究显示, 索拉非尼是通过抑制丝氨酸—苏氨酸激酶(c-RAF和突变型及野生型BRAF)和VEGFR-2、血小板衍生生长因子受体(PDGFR)、FLT 3、Ret和 c-Kit的受体酪氨酸激酶而起作用[9],从而阻断肿瘤细胞增殖。在临床研究中,索拉非尼具有抑制肿瘤细胞生长和抑制肿瘤血管形成的双重作用。SHARP大样本试验显示[10], 索拉非尼对BCLC评分C期HCC患者的OS较对照组延长2.8个月,PFS延长2.7个月。
本研究结果显示,应用索拉非尼治疗61例中晚期HCC患者,总中位PFS为7个月,总中位OS为11个月。根据RECIST标准进行疗效评价,疾病控制率为73.8%,与国内其他研究结论一致。而AFP应答组中位PFS和中位OS显著高于AFP非应答组患者(P<0.05)。但AFP应答组与AFP非应答组各项临床指标基础水平基本无显著差异,而且2组AFP的基础水平也未发现显著差异(P>0.05)。多因素Cox回归分析显示,AFP应答和CLIP评分对中晚期HCC患者预后具有显著性。CLIP评分具有良好预测患者预后能力[11],其原因可能为,CLIP评分既考察肿瘤形态特征,也考察基础AFP水平、门静脉癌栓和肝功能Child-Pugh分级,兼顾了肿瘤及肝功能两方面因素,因此在预测预后方面显示出明显优势[12,13]。
索拉非尼是一种新型分子靶向药物,作用机制并不是直接减少肿瘤体积,传统的影像学检测标准并不能完全反映索拉非尼疗效,所以当前亟需一种检测索拉非尼治疗效果的检测标志物,本试验定义AFP应答为血清AFP水平下降>50%[14~16],而Chan等[6]和Shao等[17]研究将血清AFP水平下降>20%定义为AFP应答,所以本研究对HCC患者预后的预测能力特异性更强。Chan等[6]应用化疗药物,相比AFP未应答患者,AFP应答患者具有更好的总生存时间,而且AFP应答患者中疾病稳定患者更多。王燕等[1]将中晚期HCC患者根据AFP水平分为不同亚组,低AFP水平患者口服索拉非尼的中位肿瘤进展时间显著长于高AFP水平患者。Kao等[18]认为,AFP应答患者的复发率显著低于 AFP未应答患者,AFP应答对于复发预测的HR=4.22(95%CI 1.941~9.176,P<0.01)。Tsai等[19]研究显示AFP 应答组的OS显著优于 AFP 未应答组,且完全缓解率显著高于AFP未应答组。本研究探讨显示HCC患者血清AFP变化(AFP应答)与HCC预后显著相关,可以作为预测HCC患者预后的一种指标,并发现与影像学肿瘤应答相比,AFP应答HCC患者具有良好的预后,本研究应用Cox比例风险模型进行多因素分析,有效地控制了混杂因素和处理结尾数据,而且定量分析了观察指标的作用强度,结果更加可信,为判断预后提供可靠依据。在本研究中,61例患者接受RECIST 评价, 45例肿瘤稳定, 16例肿瘤进展,其结果表明,服用索拉非尼后肝肿瘤病灶很少能达到部分缓解及完全缓解,绝大多数患者肝肿瘤病灶为稳定,进一步考察索拉非尼治疗效果,分析AFP应答组与影像学肿瘤控制组的中位PFS和中位OS,结果表明,影像学肿瘤控制组与进展组在中位PFS和中位OS无显著差异,从而说明索拉非尼并不是以肿瘤体积控制作为疗效评价标准, 其疗效主要体现在延长中晚期HCC患者的生存时间。
本研究观察到的药物不良反应主要为:手足皮肤反应、乏力、白细胞和血小板降低、贫血、腹泻和呕吐等相关肠道反应,但未出现血压升高患者,这与国外相关研究不一致[20]。原因可能与人种、地域及肝病背景等因素有关。索拉非尼治疗HCC患者的不良反应多为I、II级, 少数为III级的严重不良反应。通过对不良反应的对症治疗和减小索拉非尼剂量, 不良反应多数可以缓解甚至消失, 大多数患者都能耐受不良反应。
综上,索拉非尼治疗中晚期肝细胞癌疗效显著,常见不良反应在医疗干预下均可耐受,AFP应答具有良好的预测患者预后作用,可以作为监测索拉非尼治疗中晚期肝细胞癌疗效的检测标志物。
1 王燕, 王茂强, 刘凤永,等. 索拉非尼联合经导管肝动脉化疗栓塞治疗中晚期肝癌不同血清甲胎蛋白亚组的疗效观察[J]. 中华临床医师杂志,2012, 4(6):1729-1732.
2 田学禄. 肝癌治疗药物的研究新进展[J]. 中国药业, 2009, 18(24):64-66.
3 闫东, 刘德忠, 曾辉英,等. TACE联合索拉非尼治疗肝细胞癌的临床观察[J]. 临床肿瘤学杂志, 2010, 4(5):359-361.
4 李勇, 黄建文, 陆骊工,等. 肝动脉化疗栓塞联合索拉非尼治疗中晚期肝细胞癌的临床分析[J]. 中华医学杂志, 2010, 90(31):2187-2192.
5 Kusuda Y, Miyake H, Behnsawy HM, et al. Prognostic prediction in patients with metastatic renal cell carcinoma treated with sorafenib based on expression levels of potential molecular markers in radical nephrectomy specimens[J]. Urol Oncol, 2013, 31(1):42-50.
6 Chan SL,Mo FK,Johnson PJ,et al.New utility of an old marker: serial alpha-fetoprotein measurement in predicting radiologic response and survival of patients with hepatocellular carcinoma undergoing systemic chemotherapy[J]. J Clin Oncol, 2009, 27(3):446-452.
7 Vora SR, Zheng H, Stadler ZK, et al. Serum alpha-fetoprotein response as a surrogate for clinical outcome in patients receiving systemic therapy for advanced hepatocellular carcinoma[J]. Oncologist, 2009, 14(7):717-725.
8 Wilhelm SM, Carter C, Tang L, et al. BAY 43-9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J]. Cancer Res, 2004, 64(19):7099-7109.
9 Carlomagno F, Anaganti S, Guida T, et al. BAY 43-9006 inhibition of oncogenic RET mutants[J]. J Natl Cancer Inst, 2006, 98(5):326-334.
10 Abou-Alfa GK. Treatment of hepatocellular carcinoma: considerations regarding etiology and molecular biology[J]. Gastrointest Cancer Res, 2007, 1(4 Suppl 2):S85-89.
11 赵文和,马志敏,周杏仁,等.CLIP评分系统对评价手术切除肝癌预后的意义[J].中华外科杂志,2002, 40(5):321-325.
12 邓应彬,朱烈烈.肝细胞癌中血管内皮生长因子的表达与肿瘤进展的关系研究[J].中国全科医学,2010,13(12):4083.
13 张子东,贾广志.表柔比星肝动脉栓塞化疗对晚期原发性肝癌患者3年生存率及影响因素分析[J].疑难病杂志,2013,12(3):197.
14 Chen LT, Liu TW, Chao Y, et al.Alpha-fetoprotein response predicts survival benefits of thalidomide in advanced hepatocellular carcinoma[J]. Aliment Pharmacol Ther, 2005, 22(3):217-226.
15 Riaz A, Ryu RK, Kulik LM, et al. Alpha-fetoprotein response after locoregional therapy for hepatocellular carcinoma: oncologic marker of radiologic response, progression, and survival[J]. J Clin Oncol, 2009, 27(34):5734-5742.
16 安丽敏,陈浩,张桂珍,等.亲和离心管法检测甲胎蛋白异质体诊断肝癌的应用价值[J].河北医药,2010,32(16):2343.
17 Shao YY, Lin ZZ, Hsu C, et al. Early alpha-fetoprotein response predicts treatment efficacy of antiangiogenic systemic therapy in patients with advanced hepatocellular carcinoma[J]. Cancer, 2010, 116(19):4590-4596.
18 Kao WY,Chiou YY,Hung HH,et al.Serum alpha-fetoprotein response can predict prognosis in hepatocellular carcinoma patients undergoing radiofrequency ablation therapy[J].Clin Radiol,2012,67(5):429-436.
19 Tsai MC,Wang JH,Hung CH,et al. Favorable alpha-fetoprotein decrease as a prognostic surrogate in patients with hepatocellular carcinoma after radiofrequency ablation[J].J Gastroenterol Hepatol,2010,25(3):605-612.
20 Abou-Alfa GK, Schwartz L, Ricci S, et al. Phase II study of sorafenib in patients with advanced hepatocellular carcinoma[J]. J Clin Oncol, 2006, 24(26):4293-4300.
Sorafenibforpatientswithadvancedhepatocellularcarcinomaandtheimpacttoalphafetoproteinvariation
TANGDaping,LINRujing,WANGXuejian.
DepartmentofSurgery,BinyangCountyPeople'sHospital,Guangxi,Binyang530405,China
ObjectiveTo investigate therapeutic effect of sorafenib for advanced hepatocelluar carcinoma (HCC), including progression free survival (PFS), overall survival (OS) and alpha fetoprotein(AFP) variation to identify the prognostic usefulness of AFP response in clinic application.MethodsPathologically confirmed or clinically diagnosed patients with advanced HCC in 61 cases, continuous oral sorafenib efficacy evaluation based on Response Evaluation Criteria in Solid Tumors (RECIST), and in the first six weeks, detected serum AFP level and did imaging examination, using the Cox proportional hazards model to detect patients with HCC risk ratio.Results61 patients with median PFS was 7 months (95% CI 2.1-14.3 months), and median OS was 11 months (95% CI 7.2-23.6 months). RECIST assessment, CR in 2 cases (3.3%), PR in 6 cases (9.8%), SD in 37 cases (60.7%), PD in 16 cases (26.2%); disease control rate was 73.8%. AFP responders and non-responders PFS with OS difference was statistically significant (P<0.05); while the control group and radiographic imaging of tumor progression and OS,PFS group differences were not statistically significant (P>0.05) AFP response group risk ratio of PFS and OS was 0.58 (95% CI 0.26-0.97) and 0.68 (95% CI 0.31-0.89), while the risk of radiological controls PFS with OS ratios were 0.96 (95% CI 0.35-1.57) and 0.98 (95% CI 0.71-2.46). In multivariate Cox regression analysis, CLIP score and AFP responses of these two factors was significant. Taking sorafenib main adverse reactions were hand-foot skin reaction and white blood cells, thrombocytopenia, after symptomatic treatment or reduce the dose can be significantly alleviated.ConclusionThe sorafenib was efficient in the treatment of advanced HCC. AFP response may be considered as a novel method to capture sorafenib activity in advanced HCC.
Sorafenib; Hepatocellular carcinoma,advanced; Alpha fetoprotein; Progression free survival; Overall survival
530405 广西宾阳县人民医院外科
10.3969 / j.issn.1671-6450.2014.05.004
2014-01-24)

