造影剂肾病发病机制中炎症反应的探讨*
王金艳, 陈 红, 丁文飞, 钟爱民
(江西省人民医院肾内科,江西 南昌 330006)
虽然临床上使用的造影剂不断改良,但随着医学影像学和介入诊疗技术的发展,因诊疗需要造影剂的使用日益增多,造影剂肾病(contrast-induced nephropathy,CIN)已成为临床工作中不可忽视的问题,尤其有心脑血管疾患的高龄患者或有慢性肾脏病(chronic kidney disease,CKD)基础的患者,CIN的发生率更高,除了延长患者住院时间、增加医疗费用外,部分患者会出现不可逆的肾功能丢失,致使患者进入透析期和死亡风险显著增加[1]。近年来大多数研究主要是针对造影剂导致肾脏内局灶缺血为主的血流动力学改变、氧自由基清除、造影剂本身对肾小管细胞的毒性作用等方面进行了机制方面的研究。CIN的发病中是否存在炎症反应机制,国内尚无报导,国外这方面的研究新近才见少量报道[2]。本研究着眼于炎症反应的启动因子肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)与核因子κB(nuclear factor-kappa B, NF-κB)在CIN模型动物肾组织中的表达,观察TNF-α、NF-κB与肾损伤分子1(kidney injury molecule-1,KIM-1)之间的关系,旨在探讨CIN发病中是否存在炎症反应。
材 料 和 方 法
1 动物
SD雄性大鼠96只,体重约为250~350 g,由南昌大学医学院医学动物实验中心提供。
2 主要试剂
兔抗大鼠NF-κB抗体、KIM-1抗体和TNF-α抗体(武汉博士德生物工程有限公司),免疫组化SP系列试剂盒(北京中杉金桥生物技术有限公司):RT-PCR试剂盒(北京全式金生物技术有限公司),76%复方泛影葡胺注射液(上海旭东海普药业有限公司)。
3 主要方法
3.1实验动物分组 96只雄性SD大鼠,适应性喂养1周后随机分成2组:对照组(n=48)和模型组(n=48),分别从尾静脉注射76%复方泛影葡胺注射液(模型组)和生理盐水(对照组)10 mL/kg,注射前12 h禁水、禁食。
3.2标本采集 造膜前尾静脉采血2 mL,分别于造模后6 h、12 h、24 h、48 h、72 h、5 d、10 d和15 d予10%的水合氯醛麻醉大鼠各6只,打开腹腔,留取腹主动脉血液5 mL做生化检测,后取下双肾,一侧肾脏纵行切开,置于10%甲醛液浸泡固定,待用于病理和免疫组化检测,另一侧肾组织在剪碎以后置于样本保存液中,置于-80 ℃冰箱中冷冻保存,留做RT-PCR用。
3.3肾小管间质损伤病理评分(HE染色) 取肾组织行常规脱水和石蜡包埋,制作成3 μm切片,常规HE染色,观察肾间质充血、出血,肾小管肿胀、变性、坏死、萎缩,间质炎症细胞的情况,进行肾脏病理评分。评分标准:肾小管:0分为无肾小管损伤;1分为肾小管损伤范围<25%;2分为肾小管损伤范围25%~50%;3分为肾小管损伤范围51%~75%;4分为肾小管损伤范围>76%;肾间质:0分为无间质充血、炎症细胞浸润;1分为有间质充血;1分为有炎症细胞浸润;1分为有纤维化形成。取其均值作为该标本的统计数值。
3.4免疫组化染色 取肾组织行常规脱水和石蜡包埋,制作成3 μm切片,免疫组化SP法检测KIM-1、TNF-α和NF-κB的表达,严格按免疫组化SP系列试剂盒说明书操作,光镜下(×400)观察组织的阳性表达;并采用Image-Pro Plus 6.0病理图像分析软件分析阳性目标平均光密度进行半定量分析,取均值做统计比较。
3.5RT-PCR检测 KIM-1、NF-κB、TNF-α以及内参照引物合成见表1。(1)采用Trizol一步法提取肾脏组织的RNA;(2)RT-PCR反应:按照RT试剂盒说明书操作,所得的cDNA置于-20 ℃冰箱中保存备用;(3)PCR反应按照试剂盒说明书操作,以所得的cDNA产物2 μL为模板进行聚合酶链式反应。反应条件:94 ℃预变性5 min,94 ℃ 变性30 s,55 ℃ (KIM-1)、58 ℃(NF-κB)或53 ℃ (TNF-α)退火30 s,72 ℃延伸30 s(35、35或30个循环),最后72 ℃ 10 min;(4)反应结束后,取5 μL的PCR产物经2%琼脂糖凝胶电泳,用凝胶成像分析系统及Quantity One凝胶分析系统进行半定量分析,通过计算目的基因PCR产物积分吸光度与β-actin积分吸光度的比值来反映该目的基因mRNA的相对表达量,取均值做统计比较。
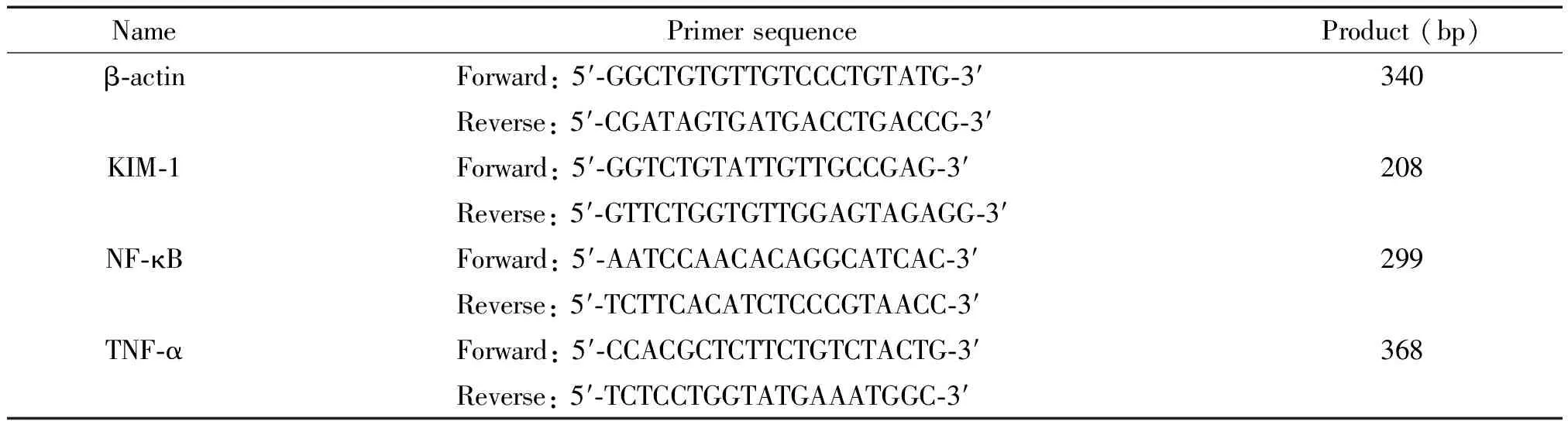
表1 引物序列
4 统计学处理
数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析和LSD-t检验,相关关系采用Pearson相关分析,应用统计软件SPSS 17.0分析,以P<0.05为差异有统计学意义。
结 果
1 血清肌酐(serum creatinine,SCr)和血尿素氮(blood urea nitrogen,BUN)检测
对照组SCr和BUN各时点变化不大(P> 0.05);CIN模型组SCr和BUN水平造膜后12 h逐渐升高,峰值出现在72 h,显示造膜成功。除15 d外,模型组SCr和BUN水平明显高于对照组(P<0.05),见表2。
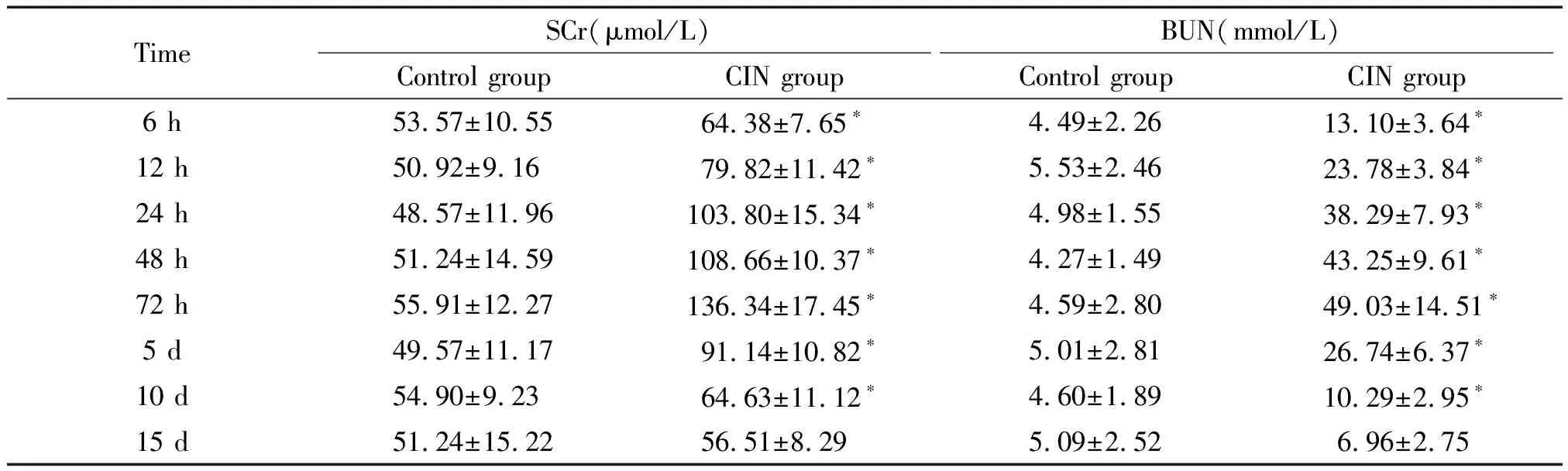
表2 两组大鼠各时点SCr和BUN的比较
2 肾小管损伤评分
对照组各时点大鼠肾脏的肾小管未见明显损伤,病理评分无显著差异(P> 0.05)。CIN模型组6 h即见肾小管损伤,24 h和48 h见肾小管上皮细胞刷状缘脱落、细胞变性坏死及再生,部分肾小管结构受损,髓质区受损最严重,部分肾间质还可见少量炎症细胞浸润及纤维化形成,72 h以后肾小管开始逐渐出现修复,15 d基本恢复正常。CIN模型组的肾小管损伤评分显著高于同一时点的对照组(P<0.05),见图1、表3。

Figure 1. Comparison of histopathologic examination in different groups(HE staining, ×400).A:control; B:CIN.
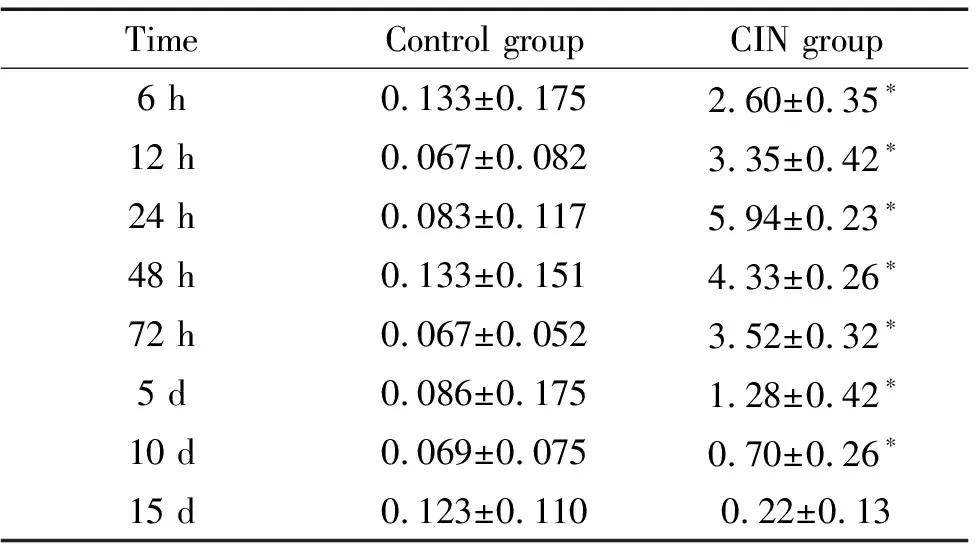
表3 两组大鼠各时点肾小管间质损伤评分的比较
3 免疫组化染色
KIM-1在造膜后6 h后就开始大量表达,24 h达高峰。NF-κB及TNF-α亦在造膜后6 h后就开始表达,48 h达高峰。除15 d外,模型组KIM-1、NF-κB和TNF-α的表达与对照组对应时点比较均有显著差异(P<0.05),见图2。
4 RT-PCR结果
建模后肾脏组织各时点KIM-1、NF-κB和TNF-α mRNA表达较对照组显著升高(P<0.05),分别在24 h、48 h和48 h达到高峰(P<0.05),之后又逐渐下降恢复正常水平,见图3。
5 Pearson相关分析
模型组肾小管损伤评分与肾组织NF-κB、TNF-α蛋白及NF-κB mRNA、TNF-α mRNA表达呈正相关(r=0.843、0.758、0.743和0.707,均P<0.05);模型组肾组织KIM-1蛋白表达与NF-κB、TNF-α蛋白表达呈正相关(r=0.863和0.807,均P<0.05);模型组肾组织KIM-1 mRNA表达与NF-κB mRNA、TNF-α mRNA表达呈正相关(r=0.839和0.855,均P<0.05)。
讨 论
造影剂肾病是临床不容忽视的问题,但CIN的发病机制尚未完全明了。目前认为CIN的可能发病机制主要有:(1)血流动力学改变导致肾脏缺氧性损伤;(2)造影剂的直接细胞毒性效应,包括造影剂能使尿酸、草酸盐、Tamm-Horsfll 蛋白等排泄增加,加上脱水导致了肾小管的阻塞[3];(3)促进细胞凋亡并增加氧自由基损伤等[4]。而对CIN是否存在炎症机制的研究尚少。

Figure 2. Expression of KIM-1, NF-κB and TNF-α at different time points (immunohistochemical staining, ×200).

Figure 3. Expression of KIM-1, NF-κB and TNF-α mRNA at different time points.Mean±SD.n=6.*P<0.05 vs 0 h.
1 造影剂对肾脏的损伤
本研究结果显示,在静脉注射造影剂后,肾脏病理评分和KIM-1的表达在24 h时为最高峰,而SCr和BUN水平的峰值迟后于肾脏损伤最严重时,且KIM-1的表达与肾脏损伤程度同步,考虑SCr和BUN并非肾脏损伤的早期敏感指标,与Vaidya等[5]、Huo等[6]的实验结果相一致。正常情况下,在人及动物肾组织中几乎不表达KIM-1,但在肾缺血及肾毒性损伤后的近端小管上皮细胞顶膜高表达[7],而在肾小球、肾小管周间质细胞或内髓细胞呈低表达[8]。在CIN中,随着造影剂在肾小管内浓度逐渐增加,造影剂逐渐对肾小管上皮细胞产生直接毒性作用,导致肾小管肿胀、变性、坏死,甚至出现颗粒和空泡变性,特别是肾髓质的髓袢和集合管尤为严重,KIM-1大量分泌[9-10]。CIN模型组KIM-1在建模6h后肾小管就开始显著表达,表达部位位于胞浆,髓质区表达最强烈,在24 h达最高峰,之后逐渐降低恢复正常。实验结果与上述文献报告相一致。本研究没有检测大鼠尿中的KIM-1,实验的主要目的在于探讨CIN的发病机制,实验中主要利用KIM-1这一较成熟的生物学标志来观察和证实肾脏损伤程度,避免肾脏病理评分对肾损伤程度评价的偏差。
2 NF-κB 和TNF-α在CIN肾脏中的表达
NF-κB 广泛存在于机体各种组织细胞中,参与多种细胞因子和炎症介质的基因转录和级联放大过程,是公认的启动炎症反应瀑布的关键因子[11]。通常情况下,在静止细胞中,组成NF-κB的p50/p65二聚体通常与其抑制因子(IκBα)结合而稳定存在于胞质中。潜伏形式的NF-κB可被多种诱导物如脂多糖、TNF-α等激活,诱导NF-κB活化并迅速进入细胞核,与具有相同序列的各种基因的启动子/增强子结合,发挥其转录调节作用[12]。TNF-α为体内细胞因子调节网络的启动因子,是启动炎症反应的关键细胞因子,TNF-α可以诱导NF-κB激活,NF-κB活化后可增强TNF-α基因的转录,使TNF-α产生和释放增多,进而再次激活NF-κB产生级联瀑布效应[13]。张方等[14]的研究也表明NF-κB可正向调控TNF-α的分泌。
我们用免疫组化和RT-PCR实验方法检测了对照组和模型组NF-κB和TNF-α蛋白和mRNA的表达水平,提示模型组在造膜12 h后NF-κB和TNF-α表达就显著增高,与对照组相比有显著差异。免疫组化还提示在前期NF-κB的表达主要表达在胞浆中,之后逐渐由胞浆转入细胞核,在48 h表达最强烈,提示NF-κB诱导特异性基因序列转录的能力增强。CIN可诱导IκBα磷酸化,促使NF-κB活化并进入细胞核。TNF-α在建膜12 h后皮质区就开始显著表达,表达部位位于胞浆,之后阳性区域逐渐向髓质扩大,表达强度也逐渐增强,在48 h达高峰,而之后表达又逐渐降低,15 d少量表达。实验结果表明,在CIN的发生、发展中,肾脏NF-κB、TNF-α蛋白和mRNA表达均上调。
3 CIN中炎症反应机制探讨
我们的实验结果显示,病理评分、KIM-1的表达与肾NF-κB、TNF-α的表达呈正相关,NF-κB、TNF-α的表达水平与肾损伤程度相一致。它们表达上调意味着炎症反应的发生和存在。在实验中,我们还观察到造膜后24 h、48 h,肾脏病理可见少量的炎症细胞浸润及少量纤维化形成,也说明CIN发生与炎症反应相关。Machado等[2]利用免疫印迹法在CIN大鼠模型中检测到大量的NF-κB表达,并提出造影剂能诱导IκBα磷酸化作用增强,可加速NF-κB激活并迅速进入细胞核,其研究结果表明降低NF-κB的活性可以减轻CIN炎症反应和氧化应激损伤。NF-κB和TNF-α在许多肾脏疾病,如狼疮性肾炎[15]、IgA肾病[16]、 糖尿病肾病[17]、缺血-再灌注性肾损伤[18]、急性肾损伤[19]等的发生、发展过程中起着重要作用。也有研究[20-21]表明抑制TNF-α表达或调控NF-κB通路可以减轻局部或相应疾病的炎症反应作用。本研究示NF-κB和TNF-α在CIN肾组织中表达上调,说明CIN发病中存在炎症反应。
造影剂影响肾血流动力学和直接肾小管毒性是CIN的主要发病机制,氧化应激和ROS起了重要的链接作用。但炎症反应在CIN发病中是如氧化应激和ROS一样起链接作用?还是炎症反应本身就是导致CIN发生的因素?炎症反应在CIN发病中的作用如何?有效抑制炎症反应能否阻止CIN的发生和发展?这些问题目前尚不明确,有待进一步研究。
[参 考 文 献]
[1] Acikel S, Muderrisoglu H, Yildirir A, et al. Prevention of contrast-induced impairment of renal function by short-term or long-term statin therapy in patients undergoing elective coronary angiography[J]. Blood Coagul Fibrinolysis, 2010,21(8):750-757.
[2] Machado RA, Constantino Lde S, Tomasi CD, et al. Sodium butyrate decreases the activation of NF-kappaB reducing inflammation and oxidative damage in the kidney of rats subjected to contrast-induced nephropathy[J]. Nephrol Dial Transplant, 2012,27(8):3136-3140.
[3] Heyman SN, Rosen S, Khamaisi M, et al. Reactive oxygen species and the pathogenesis of radiocontrast-induced nephropathy[J]. Invest Radiol, 2010,45(4):188-195.
[4] 邹文博,苏津自,许昌声,等. 阿托伐他汀对碘普罗胺引起的糖尿病大鼠肾小管上皮细胞凋亡的影响[J]. 中国病理生理杂志, 2013,29(8):1393-1399.
[5] Vaidya VS, Ozer JS, Dieterle F, et al. Kidney injury molecule-1 outperforms traditional biomarkers of kidney injury in preclinical biomarker qualification studies[J]. Nat Biotechnol, 2010,28(5):478-485.
[6] Huo W, Zhang K, Nie Z, et al. Kidney injury molecule-1 (KIM-1): a novel kidney-specific injury molecule playing potential double-edged functions in kidney injury[J]. Transplant Rev (Orlando), 2010,24(3):143-146.
[7] Mishra J, Mori K, Ma Q, et al. Amelioration of ischemic acute renal injury by neutrophil gelatinase-associated lipocalin[J]. J Am Soc Nephrol, 2004,15(12):3073-3082.
[8] Vaidya VS, Ramirez V, Ichimura T, et al. Urinary kidney injury molecule-1: a sensitive quantitative biomarker for early detection of kidney tubular injury[J]. Am J Physiol Renal Physiol, 2006,290(2):F517-F529.
[9] Wu CT, Sheu ML, Tsai KS, et al. The role of endoplasmic reticulum stress-related unfolded protein response in the radiocontrast medium-induced renal tubular cell injury[J]. Toxicol Sci, 2010,114(2):295-301.
[10] McCullough PA. Radiocontrast-induced acute kidney injury[J]. Nephron Physiol, 2008,109(4):p61-p72.
[11] Van der Heiden K, Cuhlmann S, Luong Le A, et al. Role of nuclear factor kappaB in cardiovascular health and disease[J]. Clin Sci (Lond), 2010,118(10):593-605.
[12] Fuseler JW, Merrill DM, Rogers JA, et al. Analysis and quantitation of NF-kappaB nuclear translocation in tumor necrosis factor alpha (TNF-alpha) activated vascular endothelial cells[J]. Microsc Microanal, 2006,12(3):269-276.
[13] Wu Y, Zhou BP. TNF-alpha/NF-kappaB/Snail pathway in cancer cell migration and invasion[J]. Br J Cancer, 2010,102(4):639-644.
[14] 张 方,李子玲,施 毅,等. LPS致大鼠肺泡巨噬细胞NF-κB促进TNF-α分泌[J].中国病理生理杂志,2007,23(7):1412-1414.
[15] Tang Y, Xie H, Chen J, et al. Activated NF-kappaB in bone marrow mesenchymal stem cells from systemic lupus erythematosus patients inhibits osteogenic differentiation through downregulating Smad signaling[J]. Stem Cells Dev, 2013,22(4): 668-678.
[16] Silva GE, Costa RS, Ravinal RC, et al. NF-κB expression in IgA nephropathy outcome[J]. Dis Markers, 2011,31(1): 9-15.
[17] Lin M, Yiu WH, Wu HJ, et al. Toll-like receptor 4 promotes tubular inflammation in diabetic nephropathy[J]. J Am Soc Nephrol, 2012,23(1):86-102.
[18] Ma JF, Xuan LZ, Wu W, et al. Effect of Xuebijing injection on rabbits ischemia/reperfusion injury induced by femoral arterial disease[J]. Zhongguo Wei Zhong Bing Ji Jiu Yi Xue, 2012,24(4):233-236.
[19] Zhang D, Li Y, Liu Y, et al. Paclitaxel ameliorates lipopolysaccharide-induced kidney injury by binding myeloid differentiation protein-2 to block Toll-like receptor 4-mediated nuclear factor-kappaB activation and cytokine production[J]. J Pharmacol Exp Ther, 2013,345(1):69-75.
[20] 范琰琰,叶光华,林刻智,等. α7nAChR的激活通过抑制TNF-α表达促进糖尿病小鼠伤口愈合[J].中国病理生理杂志,2013,29(6):1053-1058.
[21] 徐文明,郭润民,陈景福,等.硫化氢通过调控NF-κB通路抑制阿霉素引起的心肌细胞炎症与细胞毒性[J].中国病理生理杂志,2013,29(9):1561-1566.

