4-羟基他莫昔芬通过雌激素受体GPR30激活ezrin蛋白促进人乳腺癌MCF-7细胞迁移*
游昕超, 王庭槐
(中山大学中山医学院,广东 广州 510080)
乳腺癌是女性常见恶性肿瘤,发病率呈逐年上升趋势[1]。大部分乳腺癌细胞表达雌激素受体(estrogen receptor, ER),其生长增殖呈明显的激素依赖性。他莫昔芬(tamoxifen, TAM)是一种选择性雌激素受体调节剂(selective estrogen receptor molecular, SERM),是激素依赖性乳腺癌的内分泌治疗中的一种常用药物。TAM能通过与ER结合形成稳定的复合物,阻断雌激素与受体结合,从而阻断雌激素的生物学效应,但约50%长期使用TAM的乳腺癌患者产生TAM耐药性[2]。G蛋白偶联受体30(G-protein-coupled receptor 30,GPR30)是较晚被发现的一种新型雌激素受体,在多种乳腺癌细胞中均有表达。值得注意的是,TAM作为一种运用广泛的SERM能够抑制ER的活性,阻断传统的雌二醇(estradiol,E2)-ER经典通路,但它同时是GPR30的激动剂[3]。这提示TAM可能通过激活GPR30调节乳腺癌细胞的生存和状态。本实验拟用TAM在体内的活性代谢产物4-羟基他莫昔芬(4-hydroxytamoxifen, OHT)给药作用,观察研究OHT对ER+乳腺癌细胞株MCF-7迁移的影响,确认其作用的时间/浓度效应,并探索GPR30、非受体型酪氨酸激酶蛋白(Src蛋白)和膜-骨架连接蛋白ezrin在其中起到的作用。
材 料 和 方 法
1 材料
1.1细胞株 人乳腺癌MCF-7细胞株、SK-BR-3细胞株和MDA-MB-231细胞株均购于中国科学院上海细胞生物所。
1.2试剂 DMEM培养液购于HyClone;胎牛血清、0.25%胰酶购于Gibco;E2、OHT、GPR30激动剂G1、GPR30阻断剂G15和Src阻断剂PP2购于Sigma;SDS配胶剂购于北京鼎国昌盛生物技术有限责任公司;Western blotting发光剂购于普莱利生物技术有限公司。
1.3抗体 兔抗人ezrin、p-ezrin、Src、p-Src和ERα单抗购于Cell Signal Technology;兔抗人ERβ和GPR30单抗购于Abcam。
2 方法
2.1MCF-7细胞培养 用含10%胎牛血清的DMEM培养液在37 ℃、5% CO2饱和培养箱中培养MCF-7细胞;0.25%胰蛋白酶消化传代;每次实验取对数生长期的细胞。
2.2细胞划痕愈合实验 6孔板板背做好水平标记线,将MCF-7细胞种入,待细胞密度达到90%换无血清培养液处理24 h,用以同步细胞周期并排除细胞增殖影响。在无菌条件下用200 μL枪头和直尺在每孔中央垂直划线,形成单层细胞无细胞区,PBS冲洗3次。倒置显微镜下拍照,CellSens Entry软件测量划痕区宽度为初始划痕宽度。各孔给2 mL无血清培养液后给予溶剂对照或药物干预(阻断剂提前30 min处理)。定时拍照测量,各组n小时迁移距离=n小时划痕宽度乙醇-初始划痕宽度,每次实验将对照组24 h迁移距离标准化为100。
2.3Western blotting 细胞密度培养达到80%以上时换无血清培养液8~12 h。给予溶剂对照或药物干预(阻断剂提前30 min预处理)。30 min后加入细胞裂解液(10% Tris,pH 6.8,4% SDS,20% glycerol,10% cocktail蛋白酶抑制剂)在冰上裂解细胞。收集细胞于沸水煮18 min。之后4 ℃、13 500 r/min离心7 min,取上清液。各组样品定量后加入10 μL loading-buffer和2 μL β-巯基乙醇在沸水中煮1 min制得蛋白样品,进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。电泳完后将蛋白转到PVDF膜上(100V 60 min),5% BSA封闭30 min,按浓度1∶1 000孵育Ⅰ抗4 ℃过夜。洗膜3次(各10 min)后室温孵育辣根过氧化物酶标记的Ⅱ抗1 h。洗膜3次(各10 min)后在Bio-Rad凝胶成像系统中曝光。用Image Lab软件分析条带灰度,每次实验将对照组蛋白灰度值标准化为100。
3 统计学处理
采用SPSS 19.0软件分析,数据用均数±标准差(mean±SD)表示。实验重复3次,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。SigmaPlot软件作图。
结 果
1 乳腺癌细胞株受体检测
MCF-7人乳腺癌细胞系有较高的ERα、ERβ和GPR30表达。雌激素受体阴性人乳腺癌SK-BR-3细胞系和MDA-MB-231细胞系不表达ERα,少量表达ERβ和GPR30,见图1。
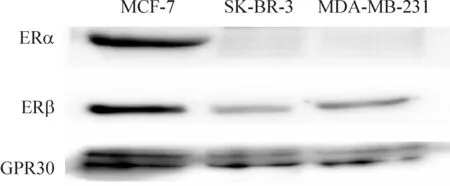
Figure 1. The expression of ERα,ERβ and GPR30 in different hunman breast cancer cell lines.
2 E2和OHT都能促进MCF-7细胞迁移
相比对照组(0.1% DMSO),E2(10 nmol/L)能明显增加MCF-7细胞24 h迁移距离(129.3±5.04,P<0.05);同时给予OHT(1 μmol/L)和E2(10 nmol/L),不能明显改变E2的促迁移效应(123.80±6.10)。单独给予OHT(1 μmol/L)也能显著促进MCF-7细胞株迁移(128.90±7.53,P<0.05),见图2。
3 OHT促进MCF-7迁移时间浓度效应
分别给予MCF-7细胞DMSO(0.1%)及0.1、1、5、10和15 μmol/L OHT,24 h后测量计算各组迁移距离。结果显示,相比对照组,0.1 μmol/L(103.9±10.3)OHT不能明显改变MCF-7迁移距离(P>0.05)。1 μmol/L(126.6±8.9)、5 μmol/L(132.0±8.8)和10 μmol/L(121.7±8.7)的OHT都能促进MCF-7细胞迁移(P<0.05)。15 μmol/L(103.0±8.9)的OHT对MCF-7细胞迁移作用不明显(P>0.05),并出现贴壁细胞脱落和细胞形态改变。给予MCF-7细胞1 μmol/L OHT后,结果显示,在给药6 h就已经体现出促进MCF-7细胞迁移的作用,见图3。

Figure 2. OHT(1 μmol/L) and E2(10 nmol/L) promoted the migration of MCF-7 cells in scratch healing model (×200). CON: control.Mean±SD.n=3.*P<0.05 vs CON.

Figure 3. The concentration and time effects of OHT on migration of MCF-7 cells (×200). CON: contrrol.Mean±SD.n=3.*P<0.05 vs CON.
4 OHT激活ezrin蛋白磷酸化
分别用DMSO(0.1%)及0.1、1、5、10和15 μmol/L OHT处理MCF-7细胞30 min,检测其是否能快速磷酸化激活MCF-7中的膜-细胞骨架蛋白ezrin。 Westren blotting结果显示1、5和10 μmol/L OHT能显著增加p-ezrin蛋白的表达,其最大效应浓度约为5 μmol/L。用OHT(1 μmol/L)分别处理MCF-7细胞5、10、20、30和60 min后p-ezrin的表达在20 min时达到最大,20 min后p-ezrin表达逐渐降低,见图4。

Figure 4. The concentration (A) and time (B) effects of OHT on ezrin phosphorylation in MCF-7 cells. CON: control.Mean±SD. n=3.*P<0.05 vs CON.
5 阻断GPR30和Src后,OHT不能磷酸化激活ezrin
OHT(1 μmol/L)和G1(0.1 μmol/L)分别作用30 min后,MCF-7细胞中p-ezrin和p-Src蛋白表达较对照组明显增加;G15(0.1 μmol/L)预处理细胞30 min后,能明显降低OHT和G1引起的p-ezrin和p-Src表达增高。另外用Src蛋白阻断剂PP2预处理30 min后,能明显抑制OHT作用后p-ezrin表达增加,见图5。
讨 论
TAM是雌激素依赖性乳腺癌的一线治疗药物,也是ER阳性原发性乳腺癌术后辅助内分泌治疗首选药物,同时还用于预防绝经前(绝经后)妇女乳腺癌,具有很好临床疗效[2]。TAM作为一种选择性雌激素受体调节剂可以竞争性抑制E2与ER结合,从而阻断经典的E2-ER通路,阻止激素依赖性乳腺癌细胞增殖。但几乎所有长期(5年或更长时间以上)使用TAM的患者都会出现耐药性,表现为长期用药后原发性肿瘤不能得到有效控制,出现复发或者发生癌细胞远处转移[4]。TAM对乳腺癌细胞迁移能力的影响尚不明确。TAM通常用药剂量为 20 mg/d,2月后的血浆稳定浓度约为1 μmol/L[5]。本实验旨在观察TAM有效代谢产物OHT在此浓度时对乳腺癌细胞迁移能力的影响和其时间/浓度效应,并探讨其作用机制。细胞划痕愈合实验结果显示,经OHT(1 μmol/L)给药处理后的MCF-7细胞较溶剂对照组(0.1% DMSO)迁移能力明显增强(P<0.05);在E2存在条件下,OHT也不能有效抑制MCF-7的迁移(图2)。浓度效应实验结果显示,低浓度的OHT(0.1 μmol/L)对MCF-7 迁移几乎无作用,其促迁移作用最大效应浓度约为5和10 μmol/L时促进效应反而降低,15 μmol/L时促迁移效果不明显并出现少量细胞凋亡(图3)。这表明乳腺癌患者在长时间服用TAM后,体内正常血浆浓度(1 μmol/L)的药物不能有效抑制MCF-7 迁移;而高浓度的药物具有抑制细胞迁移和促进凋亡的作用,但过高剂量的TAM容易诱发子宫内膜癌[6],因此也不主张在乳腺癌治疗时盲目加大TAM剂量。时间效应结果显示,OHT给药后6 h时迁移距离较对照组就已有显著差异(图3)。
细胞迁移是一个受多因素影响,多步骤的复杂过程,细胞肌动蛋白骨架重构是其中重要的一步。有研究表明,细胞肌动蛋白骨架重构受ezrin蛋白调控,ezrin在处于失活状态时羧基端和氨基端结合,首尾相连折叠,当蛋白激酶激活其酪氨酸Tyr477[7]或苏氨酸Thr567[8]位点,p-ezrin构型改变暴露出肌动蛋白的结合位点,激活的p-ezrin蛋白作为桥梁分子连接膜-骨架蛋白,在细胞迁移、有丝分裂等方面发挥重要作用[9]。因此我们推测并观察MCF-7经OHT处理后ezrin/p-ezrin是否发生明显变化,借此细胞骨架重构而引起细胞迁移。Western blotting结果显示,OHT能使MCF-7细胞中p-ezrin表达增加,其最大效应浓度(5 μmol/L)与促细胞迁移最大效应浓度一致(图4A),这说明OHT促进MCF-7细胞迁移可能是通过磷酸化激活ezrin蛋白并促进细胞骨架重构这一机制实现;时间效应显示,OHT给药后10 min就能明显引起p-ezrin表达的增加,30 min后表达则逐渐减少(图4B)。这提示这一效应不可能是通过调节有关的表达基因(耗时数小时至数天)而发挥作用的,而是由快速的非基因效应介导。
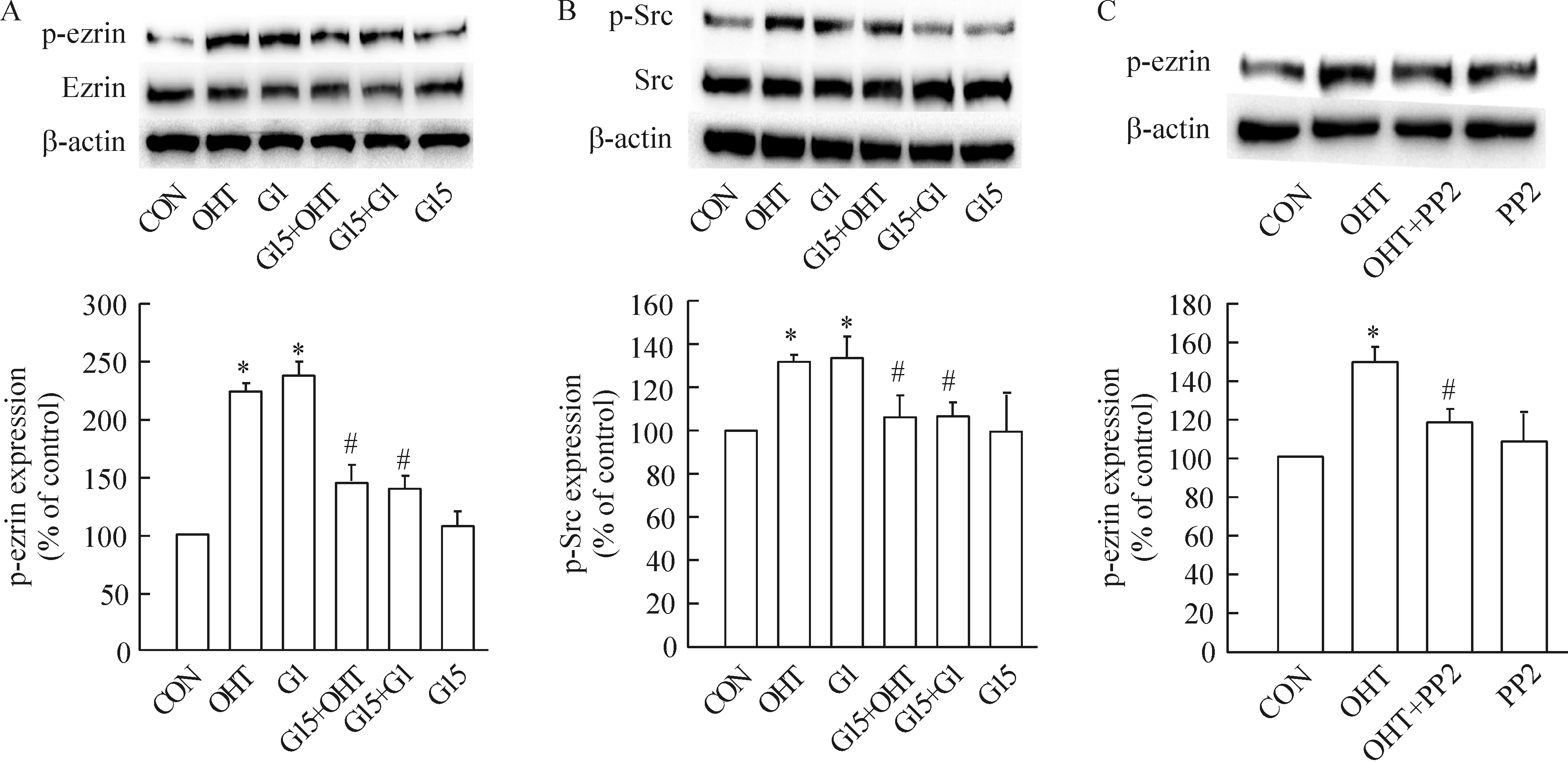
Figure 5. OHT-induced ezrin phosphorylation was inhibited by G15 and PP2.CON: control.Mean±SD.n=3.*P<0.05 vs CON; #P<0.05 vs OHT or G1.
TAM及其代谢产物通常是作为传统雌激素受体ER抑制剂发挥其药理作用,但它对一种新型的雌激素膜受体GPR30有激动效应。E2或OHT能通过激动GPR30受体,促进乳腺癌成纤维细胞[10],三阴性乳腺癌细胞MDA-MB-231[11],子宫内膜癌细胞[12]等迁移、侵袭、黏附。GPR30激活后可产生多种信号联级反应,如非受体型酪氨酸激酶Src和第二信使cAMP可分别由GPR30激活后的G蛋白βγ和α亚基所激活[13-14],而磷酸化的p-Src又可进一步激活ezrin酪氨酸位点Tyr477,促进细胞骨架重构和迁移[7]。由此推测GPR30受体和Src可能介导了OHT快速磷酸化激活ezrin的效应,从而介导细胞骨架重构和细胞迁移。本实验Western blotting结果显示, GPR30激动剂G1和OHT引起的p-ezrin和p-Src表达增加都可以被GPR30阻断剂G15阻断,单纯的G15对p-ezrin表达并无明显影响(图5A、B);PP2阻断Src蛋白以后,同样可以阻断OHT促进p-ezrin表达增加(图5C)。因此,可以推断OHT可能是通过作用GPR30,释放G蛋白βγ亚基激活c-Src,进而磷酸化激活ezrin蛋白这一信号通路影响细胞迁移。不过另有报道称OHT(10 μmol/L)能够通过激活GPR30受体诱导cyclin E的裂解,从而促进MCF-7迁移[15]。所以OHT促进MCF-7细胞迁移可能是由多种信号通路、多种机制共同作用结果。
TAM用于治疗和预防乳腺癌有超过40年的使用历史,但其易出现耐药性且耐药机制至今仍未阐明,有研究发现GPR30的表达增高或者亚细胞定位的改变与乳腺癌不良预后或TAM耐药相关[16-18]。本实验结果表明,TAM通过作用于GPR30对ER+乳腺癌细胞迁移有促进作用,提示在临床上可能需要根据患者具体情况权衡其疗效与不良反应而决定用药。而GPR30有可能成为今后临床治疗乳腺癌的一个检测指标和治疗靶点。
[参 考 文 献]
[1] Youlden DR, Cramb SM, Dunn NA, et al. The descriptive epidemiology of female breast cancer: an international comparison of screening, incidence, survival and mortality [J]. Cancer Epidemiol, 2012, 36(3):237-248.
[2] Lonning PE. Adjuvant endocrine treatment of early breast cancer[J]. Hematol Oncol Clin North Am, 2007, 21(2):223-238.
[3] Bologa CG, Revankar CM, Young SM, et al. Virtual and biomolecular screening converge on a selective agonist for GPR30[J]. Nat Chem Biol, 2006,2(4):207-212.
[4] Williams N, Harris LN. The renaissance of endocrine therapy in breast cancer[J]. Curr Opin Obstet Gynecol, 2014, 26(1):41-47.
[5] Morello KC, Wurz GT, DeGregorio MW. Pharmacokinetics of selective estrogen receptor modulators[J]. Clin Pharmacokinet, 2003,42(4):361-372.
[6] Dhull AK, Kaushal V, Singh S, et al. Tamoxifen-induced endometrial carcinoma after a lag of 14 years[J]. South Asian J Cancer, 2013, 2(1): 6.
[7] Mak H, Naba A, Varma S, et al. Ezrin phosphorylation on tyrosine 477 regulates invasion and metastasis of breast cancer cells[J]. BMC Cancer, 2012,12:82.
[8] Zheng S, Huang J, Zhou K, et al. 17β-Estradiol enhances breast cancer cell motility and invasion via extra-nuclear activation of actin-binding protein ezrin[J]. PLoS One, 2011,6 (7) :e22439.
[9] Bretscher A, Edwards K, Fehon RG. ERM proteins and merlin: integrators at the cell cortex[J]. Nat Rev Mol Cell Biol, 2002, 3(8): 586-599.
[10] Madeo A, Maggiolini M. Nuclear alternate estrogen receptor GPR30 mediates 17β-estradiol-induced gene expression and migration in breast cancer-associated fibroblasts[J]. Cancer Res, 2010, 70(14):6036-6046.
[11] Fraser SP, Ozerlat-Gunduz I, Onkal R, et al. Estrogen and non-genomic upregulation of voltage-gated Na+channel activity in MDA-MB-231 human breast cancer cells: role in adhesion[J]. Cell Physiol, 2010, 224(2):527-539.
[12] He YY, Du GQ, Cai B, et al. Estrogenic transmembrane receptor of GPR30 mediates invasion and carcinogenesis by endometrial cancer cell line RL95-2[J]. Cancer Res Clin Oncol, 2012,138(5):775-783.
[13] Filardo EJ, Quinn JA, Bland KI, et al. Estrogen-induced activation of Erk-1 and Erk-2 requires the G protein-coupled receptor homolog, GPR30, and occurs viatrans-activation of the epidermal growth factor receptor through release of HB-EGF[J]. Mol Endocrinol, 2000,14(10):1649-1660.
[14] Filardo EJ, Quinn JA, Frackelton AR Jr, et al. Estrogen action via the G protein-coupled receptor, GPR30: stimulation of adenylyl cyclase and cAMP-mediated attenuation of the epidermal growth factor receptor-to-MAPK signaling axis[J]. Mol Endocrinol, 2002,16(1):70-84.
[15] Li Y, Chen Y, Zhu ZX, et al. 4-Hydroxytamoxifen-stimulated processing of cyclin E is mediated via G protein-coupled receptor 30 (GPR30) and accompanied by enhanced migration in MCF-7 breast cancer cells[J]. Toxicology, 2013, 5(309):61-65.
[16] Filardo EJ, Graeber CT, Quinn JA, et al. Distribution of GPR30, a seven membrane-spanning estrogen receptor, in primary breast cancer and its association with clinicopathologic determinants of tumor progression[J]. Clin Cancer Res, 2006,12(21):6359-6366.
[17] Ignatov A, Ignatov T, Weissenborn C, et al. G-protein-coupled estrogen receptor GPR30 and tamoxifen resistance in breast cancer[J]. Breast Cancer Res Treat, 2011, 128(2):457-466.
[18] Mo Z, Liu M, Yang F, et al. GPR30 as an initiator of tamoxifen resistance in hormone-dependent breast cancer[J]. Breast Cancer Res, 2013, 15(6):R114.

