卡维地洛抑制大鼠起搏心肌细胞钙库超载诱导的钙释放*
赵瑞富, 李成鹏, 娄蓉蓉, 张存泰, 解翠红, 王 琳, 马业新, 周 强△
(华中科技大学同济医学院附属同济医院 1心内科, 2综合科, 3急诊内科,湖北 武汉 430030)
卡维地洛是具有α1、β受体阻滞及抗氧化等多重作用的第3代β受体阻滞剂。大量临床研究显示[1-3],卡维地洛对多种原因引起的心律失常尤其是各种室早、室速等具有明显的抑制作用。既往研究认为其机制可能与其α1、β受体阻断作用,以及抗氧化作用和L型钙通道的阻滞作用等有关[4-5]。最新研究显示[6],卡维地洛可直接结合心肌细胞肌浆网兰尼碱受体2(ryanodine receptor 2, RyR2),显著缩短通道的单次开放时间从而抑制钙波的形成。RyR2是心肌细胞电机械偶联的重要调控因子,RyR2功能障碍造成Ca2+渗漏是心力衰竭和致死性心律失常的重要原因之一[7-8]。当肌浆网内Ca2+过度超载激活RyR2舒张期开放诱发自发性钙释放,表现为由细胞一端传导至另一端的钙波,具有明显的致心律失常性[9]。我们用钙库超载诱导的钙释放(store overload-induced calcium release, SOICR)来命名这样的自发性钙释放事件。SOICR不同于钙诱导的钙释放(calcium-induced Ca2+release, CICR),后者是经L型钙通道内流的小量钙诱发RyR2收缩期开放致大量钙自钙库流出,形成细胞收缩的基础。在前期研究中,我们对静止的心肌细胞利用高钙溶液灌流诱导SOICR,而卡维地洛可以明显抑制这种自发性钙释放[6]。但是这种SOICR模型不是生理性的,其细胞的钙操纵方式与规律跳动的心肌细胞完全不同。生理状态收缩/舒张的心肌细胞钙负载主要是通过L型钙通道,钙操纵的方式主要是电机械偶联。再者,卡维地洛对于RyR2通道的门控调节除了能阻滞SOICR以外尚需关注同时对CICR的不利影响。因此本研究的目的,一是探索建立一个接近生理状态的心肌细胞SOICR模型,二是在这个细胞模型上研究非选择性β受体阻滞剂卡维地洛对SOICR和CICR的作用及其可能作用机制。
材 料 和 方 法
1 大鼠单个心肌细胞的制备
成年健康SD大鼠,雌雄不拘,体重200~250 g,由华中科技大学同济医学院动物实验中心提供。大鼠腹腔注射乌来糖充分麻醉后,开胸取心脏,悬挂于Langendorff装置行主动脉逆行灌流,酶解液循环灌流8~10 min直至心脏变柔软并松弛,将心室剪成约1 mm×1 mm×1 mm大小的心肌块置于酶解液中轻柔吹打分散,镜下观察呈单个静止杆状心肌细胞即可,过滤后1 000 r/min离心1 min,弃去上清液,将心肌细胞依次加入50、100、250、500 μmol/L及1 mmol/L的复钙液中各10 min进行逐步复钙,静置1 h后即可进行实验。
2 溶液与试剂
卡维地洛、2,3-butanedione monexime和蛋白酶(protease)均购自Sigma;试剂 F-127和Ⅱ型胶原酶(collagenase Ⅱ)购于Worthington;Fluo-4购于Introvengen;其它试剂均为国产分析纯。 KRH液(mmol/L):NaCl 125、KCl 5.0、MgCl21.2、HEPES 15、glucose 11,用NaOH滴定pH至7.37;灌流液:将taurine 1.8 mL(0.5 mol/L)和BDM 2.25 mL (0.5 mol/L)加入150 mL KRH液中;酶解液:取上述灌流液30 mL加入30 mg collagenase和4 mg protease及7.5 μL CaCl2(0.1 mol/L);复钙液:将BSA 250 mg加入60 mL灌流液中,配制50 μmol/L、100 μmol/L、250 μmol/L和500 μmol/L的复钙液各10 mL及1 mmol/L的复钙液20 mL。
3 实验分组
实验分为空白对照(DMSO)组、α受体阻滞剂酚妥拉明(0.2 μmol/L)组β受体阻滞剂美托洛尔(0.2 μmol/L)组、L型钙通道阻滞剂硝苯地平(0.2 μmol/L)组和卡维地洛(0.1 μmol/L)组。
4 胞内钙实时测定及SOICR的诱发实验
钙离子探针配制:将Fluo-4用DMSO配制成母液(5 mmol/L),加入含1 mmol/L钙的KRH液稀释至5 μmol/L,同时加入F-127(终浓度为0.02%)。取适量细胞与Fluo-4孵育20 min以载入钙染料。应用倒置荧光显微镜(Nikon Ti-S)及Simple PCI软件记录细胞内荧光强度,激发波长495 nm,发射波长518 nm,CCD以10帧/秒速度记录Ca2+图像,输入计算机系统,经软件处理得到清晰的图像,并可进行量化分析换算出某一选定区域内Ca2+荧光强度随时间变化的曲线。将心肌细胞放置到带有起搏电极的灌流槽中,整个过程用含实验药物及1 mmol/L Ca2+的KRH液灌流。刺激程序:以1.5倍阈电压场刺激起搏心肌细胞,起搏频率1、2、3和4 Hz依次各刺激15次,频率增加时间歇10 s;换用含0.1 mmol/L异丙肾上腺素和0.3 μmol/L咖啡因的灌流液持续灌流5 min同时以0.3 Hz的基础刺激频率起搏;随后重复1~4 Hz的起搏程序,2次起搏之间以及起搏停止后出现的自发性钙释放认定为SOICR。最后局部快速给予高浓度咖啡因(20 mmol/L)灌流,致肌浆网中Ca2+全部释放至胞浆中,得到咖啡因峰值用于估测钙库的总钙量。
5 统计学处理
SPSS 16.0统计软件分析,计数资料以百分率表示,采用卡方检验,计量资料以均数±标准差(mean±SD)表示,多组间比较时采用单因素方差分析(ANOVA),两两对比时采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 起搏心肌细胞SOICR模型的建立
对照组基线刺激时,1~4 Hz频率心肌细胞SOICR发生率(包括起搏间及起搏停止后的自发性钙释放)分别为0%、2.56%、5.13%和10.26%,随后以0.1 mmol/L异丙肾上腺素和0.3 μmol/L咖啡因灌流同时以0.3 Hz起搏心肌细胞5 min后重复上述起搏刺激程序,发现细胞的SOICR发生率显著增高,且随着刺激频率的增加而增高(分别为43.59%、74.36%、87.18%和89.74%,与基线刺激对比均P<0.01);起搏时钙瞬变振幅较前明显增高(P<0.01),细胞呈钙超载状态。两次起搏之间和(或)起搏停止后出现的自发性钙释放,认定为SOICR,见图1。

Figure 1. The representative Ca2+ imaging traces under the condition of before (A) and after (B) perfusion with isoprenaline and caffeine were shown. Spontaneous Ca2+ release events after the pacing and between pacing beats were defined as SOICR (B, C). The percentage of the cells with SOICR (D) and amplitude of Ca2+ transient (E) in control group before and after perfusion with isoprenaline and caffeine were shown. Mean±SD.n=39.**P<0.01 vs before Ca2+ overload.
2 卡维地洛及其它干预处理对起搏心肌细胞SOICR的影响
图2显示与对照组相比,卡维地洛(0.1 μmol/L)组细胞在1~4 Hz频率起搏时SOICR发生率均显著降低,分别为2.00%、6.00%、10.00%和16.00%(均P<0.01);卡维地洛对心肌细胞SOICR的抑制率[1-(卡维地洛组SOICR发生率-卡维地洛组基线SOICR发生率)/(对照组SOICR发生率-对照组基线SOICR发生率)]在不同起搏频率下无明显差异(P>0.05);酚妥拉明(0.2 μmol/L)、美托洛尔(0.2 μmol/L)和硝苯地平(0.2 μmol/L)处理细胞后均未降低SOICR的发生率(均P>0.05),提示卡维地洛可以显著抑制心肌细胞SOICR的发生,其作用并不是通过对α、β受体和L型钙通道的阻滞实现的。
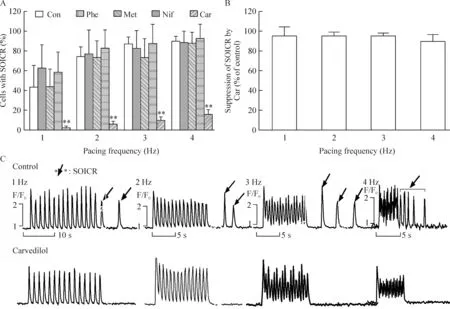
Figure 2. Incidence of SOICR in cardiomyocytes after treated with different drugs and the inhibitory effect of carvedilol. A: the percentage of the cells with SOICR in different groups. Con: control (n=39); Phe: phentolamine (0.2 μmol/L, n=35); Met: metoprolol (0.2 μmol/L, n=34); Nif: nifedipine (0.2 μmol/L, n=41); Car: carvedilol (0.1 μmol/L, n=50). B: the suppression of SOICR with Car at various pacing frequency compared with control. C: representative imaging traces showed spontaneous Ca2+ release event in control group but not in carvedilol group at the pacing frequency from 1 to 4 Hz. Mean±SD.**P<0.01 vs control group.
3 卡维地洛及其它干预处理对起搏心肌细胞CICR的影响
在1~4 Hz刺激频率下,卡维地洛、酚妥拉明、美托洛尔、硝苯地平组心肌细胞起搏时钙瞬变振幅与对照组均无明显差异(均P>0.05);快速给予高浓度咖啡因诱导心肌细胞肌浆网钙库全部释放,测得的咖啡因峰值用于估测钙库钙总量,各组间比较均无明显差异(均P>0.05)。0.1 μmol/L卡维地洛对心肌细胞CICR及肌浆网钙库钙容量无明显影响,但可以抑制SOICR的发生,见图3。
讨 论
近年来研究显示SOICR在儿茶酚胺敏感的多形性室性心动过速(catecholaminergic polymorphic ventricular tachycardia, CPVT)和心力衰竭致死性心律失常的发生中具有重要作用[6, 8]。SOICR的发生涉及2个主要环节:一是钙超载,二是RyR2的过度活化开放,特别是自发性开放的阈值降低时(可由于基因突变或功能位点的过度磷酸化等所致)。阻止SOICR的发生即是要针对这2个关键环节。心肌细胞发生钙超载涉及多种机制和途径,可通过L型钙通道、钠钙交换、细胞膜通透性增加等引起细胞内钙超载[10]。减少钙超载可以减少SOICR的发生,然而心肌在病理状态下钙超载的发生可能难以避免,因而对RyR2的调控就成为一个有希望的减少SOICR发生的治疗靶点。

Figure 3. Amplitudes of Ca2+ transient and sarcoplasmic reticulum Ca2+ content in cardiomyocytes after Ca2+ overload in different groups.A: the amplitudes of Ca2+ transient of cardiomyocytes in different groups at variant pacing frequency were shown; B: sarcoplasmic reticulum Ca2+ content was estimated by the height of Ca2+ transient induced by rapid caffeine (20 mmol/L) application; C: representative Ca2+ oscillations were induced by rapid caffeine (20 mmol/L) application in different groups.Mean±SD. Con,n=39; Phe,n=35; Met,n=34; Nif,n=41; Car,n=50.
起搏心肌细胞SOICR模型的建立不同于静止心肌细胞的研究体系。在后者模型中,细胞钙超载通过灌流高浓度钙液实现,本身不是生理性的,其钙超载可能与高浓度钙离子经非选择性阳离子通道内流有关,而且高钙可能激活钙敏感受体,通过G蛋白-IP3通路引起SR内钙释放[11]。在生理性起搏的心肌细胞,钙超载的实现主要是通过L型钙通道较多的钙流入和钠钙交换体较少的钙外流,SR钙释放通道RyR2是控制收缩期CICR和舒张期自发性钙释放的关键[12]。本研究通过快频率电刺激起搏心肌细胞,激活L型钙通道并灌注异丙肾上腺素及咖啡因诱导钙库钙超载,建立一个接近生理状态的心肌细胞SOICR模型。本研究发现,钙超载前的基础刺激心肌细胞SOICR发生率较低;灌注异丙肾上腺素(激活β1受体诱导钙超载,主要通过: (1) L型钙通道磷酸化,Ca2+内流增加;(2) 增强肌浆网钙泵的功能)和咖啡因(活化RyR2致自发性钙释放阈值降低)后,心肌细胞SOICR发生率显著增加,且随起搏频率增加而增高,呈频率依赖性,钙瞬变振幅增大,提示细胞呈钙超载状态。
与既往在静止心肌细胞研究模型的发现类似[6],卡维地洛在起搏心肌细胞中仍然显示对SOICR具有良好的抑制作用,而酚妥拉明和美托洛尔均未降低SOICR的发生率,说明卡维地洛能抑制起搏心肌细胞SOICR的发生,其作用不依赖于其对α、β受体的阻滞作用。已知卡维地洛能部分阻滞L型钙通道,其效能明显弱于强力的钙通道阻滞剂硝苯地平[4]。卡维地洛对SOICR的抑制作用可能源于其阻滞L型钙通道,减少了心肌细胞的钙内流,从而减轻了钙超载的程度。然而,我们的研究发现,0.1 μmol/L卡维地洛并没有降低起搏钙瞬变的振幅,咖啡因峰值与对照组比较也无显著差异。即使0.2 μmol/L硝苯地平也未显示对心肌细胞CICR和肌浆网钙库钙容量有明显影响。这些都说明0.1 μmol/L卡维地洛抑制SOICR的作用与L型钙通道无关。我们的研究还显示卡维地洛对SOICR的抑制作用在不同起搏频率下并无明显差异,即没有频率依赖性,这也不同于常见的抗心律失常药物的作用特性。我们前期的研究[6]发现,卡维地洛可直接结合RyR2而减少通道单次开放时间。虽然RyR2的开放事件次数增多,但每次短暂的开放不能形成有效的舒张期自发性钙释放(SOICR)和钙波。本研究观察到0.1 μmol/L卡维地洛能明显抑制SOICR,但对CICR无影响。这说明SOICR和CICR是两个不同的过程,为我们选择性干预提供了机会。临床研究发现[1, 5],与美托洛尔相比,卡维地洛可更显著降低心衰患者室性心律失常发生率及死亡率,这可能与其独特的药理作用(例如对RyR2通道的调控)有关。
总之,本研究发现卡维地洛可明显抑制起搏心肌细胞SOICR的发生,同时未见对CICR有明显影响,其作用机制可能是直接抑制RyR2的自发性开放而非源于对α1、β1受体和L型钙通道的阻滞。因此,针对RyR2通道的调控,有望成为恶性心律失常防治的一个潜在的靶点。
[参 考 文 献]
[1] Ruwald MH, Ruwald ACH, Jons C, et al. Effect of metoprolol versus carvedilol on outcomes in MADIT-CRT (Multicenter Automatic Defibrillator Implantation Trial With Cardiac Resynchronization Therapy) [J]. J Am Coll Cardiol, 2013, 61(14): 1518-1526.
[2] Oflaz MB, Balli S, Kibar AE, et al. Effects of carvedilol therapy on cardiac autonomic control, QT dispersion, and ventricular arrhythmias in children with dilated cardiomyopathy [J]. Med Sci Monit, 2013, 19:66-72.
[3] Senior R, Muller-Beckmann B, Dasgupta P, et al. Effects of carvedilol on ventricular arrhythmias [J]. J Cardiovasc Pharmacol, 1992, 19 (Suppl 1):S117-S121.
[4] Cheng JH, Niwa R, Kamiya K, et al. Carvedilol blocks the repolarizing K+currents and the L-type Ca2+current in rabbit ventricular myocytes [J]. Eur J Pharmacol, 1999, 376(1-2): 189-201.
[5] Poole-Wilson PA, Swedberg K, Cleland JG, et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial [J]. Lancet, 2003, 362(9377): 7-13.
[6] Zhou Q, Xiao JM, Jiang DW, et al. Carvedilol and its new analogs suppress arrhythmogenic store overload-induced Ca2+release [J]. Nat Med, 2011, 17(8): 1003-1009.
[7] Tateishi H, Yano M, Mochizuki M, et al. Defective domain-domain interactions within the ryanodine receptor as a critical cause of diastolic Ca2+leak in failing hearts [J]. Cardiovasc Res, 2009, 81(3):536-545.
[8] MacLennan DH, Chen SR. Store overload-induced Ca2+release as a triggering mechanism for CPVT and MH episodes caused by mutations inRYRandCASQgenes [J]. J Physiol, 2009, 587(Pt 13):3113-3115.
[9] Xie LH, Weiss JN. Arrhythmogenic consequences of intracellular calcium waves [J]. Am J Physiol Heart Circ Physiol, 2009, 297(3):H997-H1002.
[10] Vassalle M, Lin CI. Calcium overload and cardiac function [J]. J Biomed Sci, 2004, 11(5):542-565.
[11] 徐长庆, 张伟华. 心血管系统钙敏感受体的研究进展[J]. 中国病理生理杂志, 2010, 26(2):409-413.
[12] Venetucci LA, Trafford AW, O’Neill SC, et al. The sarcoplasmic reticulum and arrhythmogenic calcium release [J]. Cardiovasc Res, 2008, 77(2):285-292.

