PSMA对JNK/SAPK通路的激活及对前列腺癌细胞凋亡的调控*
黄 海, 赖义明, 何 旺, 董 文, 朱定军, 张一鸣, 刘 皓, 于 浩, 毕良宽, 林天歆, 黄 健, 郭正辉, 杜 涛
(中山大学孙逸仙纪念医院 1泌尿外科, 2产前诊断中心,广东 广州 510120)
前列腺特异性膜抗原(prostate-specific membrane antigen, PSMA)是一种前列腺上皮细胞Ⅱ型跨膜糖蛋白,由前列腺上皮细胞分泌,其氨基端位于细胞膜内,分子量约为100 kD,共含750个氨基酸,其中胞外段707个,跨膜段24个,胞内段19个。PSMA表达水平与前列腺癌病情的进展有明显相关性,是前列腺癌天然的靶点,在前列腺癌诊治及研究中有重大意义。近年来研究发现,PSMA具有信号转导、细胞迁移、受体效应、营养摄取等功能[1-2]。其中信号转导的机制并非完全清楚。c-Jun氨基末端激酶/应激激活的蛋白激酶(c-Jun N-terminal kinase/stress activated protein kinases, JNK/SAPK)信号通路是细胞内重要信号通路之一,在细胞增殖及凋亡中发挥关键作用,并与人类多种肿瘤的发生发展密切相关[3]。本研究中,我们以阻断或增强PSMA表达的前列腺癌细胞LNCaP细胞株作为研究对象,在一般培养基及JNK/SAPK信号通路抑制剂SP600125作用下,发现在LNCaP细胞PSMA的表达与p-JNK/SAPK水平及细胞增殖、细胞周期具有一定联系,推测PSMA可能通过JNK/SAPK信号通路对前列腺癌的增殖及凋亡起到调控作用。
材 料 和 方 法
1 材料
利用前期研究中建立的高效阻断PSMA表达的shRNA慢病毒载体,阻断前列腺癌细胞中PSMA的表达作为实验的干扰组(shPSMA)[4];同时利用前期构建的PSMA真核表达载体pcDNA3.1-PSMA转染前列腺癌细胞,促进前列腺癌细胞中PSMA的表达作为阳性实验组(pcDNA-PSMA)[5-6];不做任何处理的LNCaP细胞株(购自中山大学实验动物中心)作为空白组(control);加入JNK/SAPK抑制剂SP600125作为阴性对照研究。
RPMI-1640培养基和胎牛血清(HyClone);0.25%胰酶(吉玛公司);Cell Counting Kit-8(Dojindo Laboratories);兔抗人磷酸化JNK多克隆抗体(CST);兔抗人PSMA单克隆抗体(Abcam);3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)内参照抗体(Santa);辣根过氧化物酶(peroxidase horseradish, HRP)标记的羊抗兔抗体(ICL); SP600125 (CST);BCA法蛋白定量试剂盒(上海申能博采);柯达黑白胶片;增强化学发光(enhanced chemiluminescence,ECL)试剂盒(Thermo);超敏ECL试剂盒(Millipore);免疫组化染色试剂盒和浓缩型DAB试剂盒(中杉金桥);Annexin V-FITC细胞凋亡检测试剂盒(Keygen)。
2 方法
2.1细胞培养 各组细胞分别于含100 mL/L FBS、1×105U/L青霉素、100 mg/L链霉素的RPMI-1640培养基中培养,置于37 ℃、5% CO2培养箱培养;细胞每2 d换液,约5~6 d(细胞80%融合后)按1∶4传代,每天观察记录掌握细胞基本生长规律。SP600125溶于DMSO中(25 mmol/L),分装备用。部分细胞冻存,备以下实验用。
2.2细胞内JNK/SAPK蛋白磷酸化水平检测
2.2.1Western blotting 各组细胞按每孔3×106个细胞种于6孔板中,细胞贴壁后予无血清RPMI-1640培养基换液。24 h后,一部分细胞予同样无血清培养基换液,另一部分细胞予含25 μmol/L SP600125的无血清培养基更换,全部细胞再于培养箱中孵育30 min,即用蛋白提取试剂盒提取细胞总蛋白,BCA法蛋白定量,12% SDS-PAGE行3组细胞PSMA和磷酸化JNK蛋白分离,转于PVDF膜上,封闭后,孵PSMA(1∶1 000)Ⅰ抗、p-JNK(1∶1 500)Ⅰ抗和GAPDH (1∶10 000)过夜,次日孵HRP标记Ⅱ抗(1∶1 000)1 h,暗室中加入发光液,其中PSMA使用超敏ECL发光液;p-JNK使用ECL发光液。黑白胶片曝光。
2.2.2细胞免疫化学 每组细胞按照每孔5×104个细胞接种于24孔板中培养1 d。予无血清RPMI-1640培养基换液孵育24 h,再使用一般培养基及含SP600125的培养基,外环境处理同Western blotting,多聚甲醛固定后滴入非免疫山羊血清封闭。滴入1∶1 000稀释兔抗人p-JNK单克隆抗体100 μL;将该24孔板放入自制保湿盒中,4 ℃过夜。次日洗涤后滴入生物素标记羊抗兔IgG 1 滴/孔,室温孵育20 min,洗涤。滴入辣根酶标记链酶卵白素工作液后,加入DAB液,洗脱后滴入苏木素Mayor染核。镜下观察及统计分析:镜下观察各组细胞的染色情况,每孔随机选取5个高倍视野(10×20)。确定细胞阳/阴性染色较为主观,因此选取一个较为浅染的细胞为标准细胞,浓于标准细胞为阳性细胞,浅于标准细胞为阴性细胞,并对3组细胞p-JNK的表达进行统计学分析(SPSS 17.0软件)。
2.3各组细胞增殖、细胞周期、凋亡的检测
2.3.1CCK-8法检测细胞的增殖 取各组细胞,消化分离后分别用含10%FBS的RPMI-1640培养基和加入含25 μmol/L SP600125的上述培养基重悬离心细胞后,通过细胞计数板人工计数,以2 000 cells/well接种于96孔板,每孔体积100 μL,每组设3个复孔,每2 d予相应的培养基换液1次(分别使用一般RPMI-1640培养基及含有SP600125的RPMI-1640培养基)。到检测时点时取出需检测的培养板,往培养孔中每孔加入CCK-8 试剂10 μL,后培养2 h,在酶标仪上测各组细胞的A450值,分别测24 h、48 h、72 h、96 h、120 h、144 h和168 h 7个时点,复孔检测结果取均值并绘制生长曲线。
2.3.2流式细胞仪检测细胞周期 各组细胞实验前分别使用含10% FBS的RPMI-1640培养基及含SP600125的上述培养基培养48 h。消化、重悬后移入流式管,加入2 mL 于-20 ℃预冷的70%乙醇,密封后置于4 ℃冰箱过夜。次日送入流式细胞仪室对各组细胞S期、G0-G1期、G2-M期的百分比作检测。
2.3.3流式细胞仪检测细胞凋亡 将各组细胞制作细胞悬液(5×105个细胞),具体方法同上,后加入1.25 μL Annexin V-FITC,室温(18~24 ℃)避光反应15 min后离心去上清。0.5 mL预冷的1×结合缓冲液轻轻重悬后加入10 μL 溴化丙啶(propidium iodide,PI),冰上避光保存,流式细胞术检测分析。
3 统计学处理
计量资料用均数±标准差(mean±SD)表示,并采用单因素方差分析或者Kruskal-Wallis检验;计数资料采用Pearson2检验。统计分析软件使用SPSS 17.0。以P<0.05为差异有统计学意义。
结 果
1 JNK/SAPK蛋白磷酸化水平检测结果
1.1Western blotting 如图1所示,在PSMA高表达时,p-JNK/SAPK高表达;在PSMA低表达时,p-JNK/SAPK低表达,与空白对照组相比,均存在明显的统计学差异。而在加入SP600125的培养基中,各组细胞中p-JNK/SAPK表达没有显著差异,但较常规培养组低。
1.2细胞免疫化学 图2为用免疫细胞化学的方法观察各组细胞p-JNK/SAPK的表达情况。对阳/阴性细胞的计数和统计表明,在RPMI-1640培养基中,shPSMA组的p-JNK/SAPK表达明显低于control组(P<0.05),而pcDNA-PSMA组的p-JNK/SAPK表达明显高于control组(P<0.05);在含有SP600125的培养基中,3组细胞p-JNK/SAPK的表达接近,无明显差异,见图2。

Figure 1. The expression of PSMA, JNK and p-JNK in different groups tested by Western blotting.Lane 1: shPSMA+SP600125; Lane 2: pcDNA-PSMA+SP600125; Lane 3: control+SP600125; Lane 4: shPSMA; Lane 5: pcDNA-PSMA; Lane 6: control group. Mean±SD. n=3.*P<0.05, **P<0.01 vs control group.
2 细胞增殖、周期、凋亡的检测结果
2.1细胞生长曲线 在RPMI-1640培养基中,shPSMA组的增殖能力明显较control组低(P<0.05),而pcDNA-PSMA组较control组高(P<0.05),并在120 h后有显著差异;在含有SP600125的培养基中,3组细胞增殖能力均处于低水平,但在144 h后比在RPMI-1640培养基中的shPSMA组水平更低,见图3。
2.2流式细胞术检测细胞周期结果 在RPMI-1640培养基中,shPSMA组、pcDNA-PSMA组和control组处于S期细胞的百分比是29.58%、42.36%和36.10%;在含有SP600125的培养基中,shPSMA组、pcDNA-PSMA表达组和control组处于S期细胞的百分比是27.51%、29.21%和28.82%。在一般RPMI-1640培养基中,shPSMA组S期细胞的百分比明显低于control组,而pcDNA-PSMA组则高于control组;而在含SP600125培养基中,3组处于S期细胞的百分比均在较低水平,3组间无明显差异,见图4。
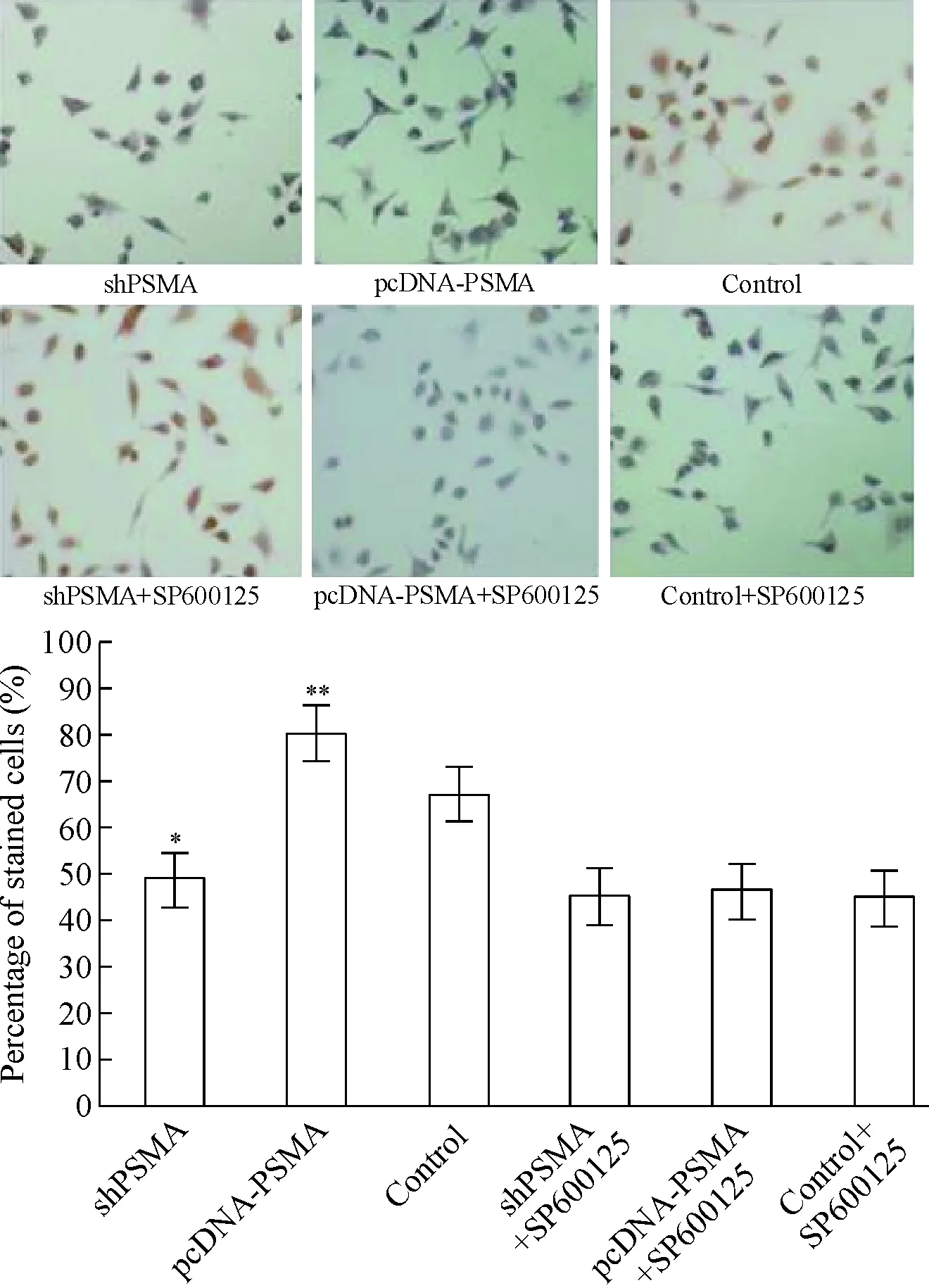
Figure 2. The expression of p-JNK/SAPK in different groups tested by immunocytochemistry (×400).Mean±SD.n=3.*P<0.05, **P<0.05 vs control group.

Figure 3. Cell growth curve of each group. Mean±SD.n=3.*P<0.05, **P<0.01 vs control group.

Figure 4. The percentage of cells in S phase detected by flow cytometry. Mean±SD.n=3.*P<0.05, **P<0.05 vs control group.
2.3流式细胞术检测细胞凋亡的结果 如图5所示,常规培养条件下,shPSMA组、pcDNA-PSMA组和control组中凋亡率分别为9.6%、3.4%和4.7%;在加入SP600125时,各组的凋亡率分别为7.7%、2.1%和3.5%。在shPSMA组中,前列腺癌细胞的凋亡率明显高于control组,这与是否加入JNK抑制剂SP600125无关;而在pcDNA-PSMA表达组,细胞凋亡率明显低于control组;加入JNK抑制剂SP600125后,细胞凋亡率均低于常规培养组,但是PSMA对凋亡的调控趋势未改变。因此,PSMA可以抑制前列腺癌细胞的凋亡,JNK通路是其一条重要的通路,但是并不是唯一的通路,应该还存在其它的信号通路对细胞的凋亡进行调控。

Figure 5. Apoptotic rate of each group tested by flow cytometry.Mean±SD.n=3.*P<0.05, **P<0.01 vs control group.
讨 论
PSMA是基因位于染色体11p11~12的横跨细胞膜的Ⅱ型糖蛋白[7-8]。它是一种高特异性的前列腺癌瘤标,和肿瘤恶性程度相关。在正常的前列腺细胞中,PSMA少量表达于基底细胞[9],在前列腺癌细胞中广泛表达,在转移性的雄激素非依赖性前列腺癌中有更高表达[10-11]。此外,PSMA在去势治疗后表达上调[12]。我们前期的研究也表明PSMA在前列腺癌的发生、发展中其重要作用,可以促进前列腺癌细胞的增殖、侵润能力,抑制凋亡发生[13],但是关于PSMA对前列腺癌细胞调控的具体机制和细胞信号通路目前还不清楚,因此我们进行了后续的研究。
JNK是丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)家族重要成员之一,由于它可以调控细胞内的应激反应,因此也被称为应激激活蛋白激酶。JNK信号通路能介导多种胞外刺激诱导的细胞凋亡,参与了包括前列腺癌细胞在内的多种细胞的凋亡发生,在调控细胞凋亡中发挥着重要作用。JNK 位于胞浆,由3 个基因编码,它们分别是:JNK1、JNK2 和JNK3。JNK1 和JNK2 基因在全身广泛表达,而JNK3 则是呈限制性表达。这3种基因都能编码产生46 kD和55 kD 的蛋白产物,因为3种基因的不同分布,执行的细胞功能也各有差异[14]。目前认为,JNK 促进细胞凋亡的机制主要有2点:(1)上调促凋亡蛋白的表达:JNK 通过使转录因子复合物AP-1 活性增强进一步促进p53、Bax、FasL、TNF 等促凋亡蛋白的表达;(2)作用于线粒体:如Bax、Bak 等促使细胞色素C释放进入胞浆,细胞色素C和caspase-9结合,最终作用于caspase-3,激活的caspase-3与凋亡底物结合引起细胞凋亡。
PSMA是位于前列腺细胞中的一种跨膜糖蛋白,而JNK是MAPK通路中最重要的信号分子,两者都与前列腺癌的进展相关。我们早期的研究提示,在前列腺癌细胞中,抑制PSMA表达后,前列腺癌细胞增殖、侵袭、凋亡等均受到影响[13, 15-16],对于其具体的机制我们进行了初步探讨,并证明PSMA可以对p38/MAPK通路进行调控,作为前列腺癌细胞中对p38通路调控的一个新的靶点[17]。同时,PSMA还可以对ERK通路进行调控,ERK通路同样参与了PSMA对前列腺癌细胞生物学影响的过程[18]。那么作为MAPK通路中另一个重要的通路JNK是否也受到PSMA的影响?为了确定PSMA和JNK磷酸化是否存在关联,以及是否对前列腺癌细胞起作用,我们设立了抑制PSMA表达的LNCaP组,增强PSMA表达组及空白组。3组分别在一般培养基和存在JNK通路抑制剂SP600125的培养基中孵育。通过检测3组细胞在2种培养条件下的JNK/SAPK通路及细胞增殖、细胞周期、凋亡等情况来验证PSMA对JNK/SAPK通路的调控及是否通过JNK/SAPK通路对前列腺癌细胞的凋亡产生调控。
与其它2组相比,抑制PSMA蛋白表达后,p-JNK/SAPK水平下降;增强PSMA表达后,p-JNK/SAPK水平升高;而在SP600125的作用下,3组JNK磷酸化水平均下降。细胞免疫组化结果也证明两者之间的关系。这个结果表明PSMA参与了p-JNK/SAPK通路的激活。此外,我们检测了3组细胞在有无JNK抑制剂情况下的增殖、细胞周期、凋亡情况。通过LNCaP细胞生长曲线表明,抑制PSMA组的生长增殖能力明显低于空白对照组,而增强PSMA表达组则高于空白对照组;但在使用SP600125培养基组中3组生长曲线相近,而且明显低于一般培养基组。通过流式细胞术评估各组细胞周期变化情况显示,在常规培养条件下,抑制PSMA表达后细胞S期百分比少于空白对照组;增强PSMA表达后则高于空白对照组;在SP600125培养基条件下,3组的S期百分比几乎相同。这个细胞周期检测的结果显示PSMA通过激活JNK通路来调控前列腺癌细胞周期。关于凋亡的检测显示在抑制PSMA表达组中,前列腺癌细胞的凋亡率明显高于增强PSMA表达组和空白对照组,这与是否加入JNK抑制剂SP600125无关;而在增强PSMA表达组,细胞凋亡率明显低于空白对照组;加入JNK抑制剂SP600125后,细胞凋亡率均低于常规培养组,但是PSMA对凋亡的调控趋势未改变。因此,结合我们前期的研究结果可以推断PSMA可以抑制前列腺癌细胞的凋亡,JNK通路是其中一条重要的通路,但是并不是唯一的通路,应该还存在其它的信号通路对细胞凋亡进行调控,比如ERK、p38、Akt等[19]。而这些通路之间的相互作用关系还不清楚,我们后期的研究将进一步进行该方面的深入研究,以阐明PSMA下游的信号通路网。
[参 考 文 献]
[1] Rajasekaran AK, Anilkumar G, Christiansen JJ. Is prostate-specific membrane antigen a multifunctional protein?[J]. Am J Physiol Cell Physiol,2005,288(5):C975-C981.
[2] O’Keefe DS, Bacich DJ, Heston WD. Comparative analysis of prostate-specific membrane antigen (PSMA) versus a prostate-specific membrane antigen-like gene[J]. Prostate,2004,58(2):200-210.
[3] Yan KH, Yao CJ, Hsiao CH, et al. Mefloquine exerts anticancer activity in prostate cancer cells via ROS-mediated modulation of Akt, ERK, JNK and AMPK signaling[J]. Oncol Lett,2013,5(5):1541-1545.
[4] 郭正辉,黄 海,杜 涛,等. 靶向于前列腺癌特异性膜抗原shRNA的筛选与鉴定[J]. 中华实验外科杂志,2008,25(9):1190-1192.
[5] 黄 海,黄 健,潘秋辉,等. 中国人前列腺特异性膜抗原基因的克隆及鉴定[J]. 中山大学学报:医学科学版,2005,26(1):84-87.
[6] 黄 海,黄 健,林天歆,等. 人前列腺特异性膜抗原cDNA的克隆、原核表达、鉴定和抗原初步纯化[J]. 中华泌尿外科杂志,2004,25(8):533-536.
[7] Israeli RS, Powell CT, Fair WR, et al. Molecular cloning of a complementary DNA encoding a prostate-specific membrane antigen[J]. Cancer Res,1993,53(2):227-230.
[8] O’Keefe DS, Su SL, Bacich DJ, et al. Mapping, genomic organization and promoter analysis of the human prostate-specific membrane antigen gene[J]. Biochim Biophys Acta,1998,1443(1-2):113-127.
[9] Kawakami M, Nakayama J. Enhanced expression of prostate-specific membrane antigen gene in prostate cancer as revealed byinsituhybridization[J]. Cancer Res,1997,57(12):2321-2324.
[10] Mhawech-Fauceglia P, Zhang S, Terracciano L, et al. Prostate-specific membrane antigen (PSMA) protein expression in normal and neoplastic tissues and its sensitivity and specificity in prostate adenocarcinoma: an immunohistochemical study using mutiple tumour tissue microarray technique[J]. Histopathology,2007,50(4):472-483.
[11] Wright GJ, Grob BM, Haley C, et al. Upregulation of prostate-specific membrane antigen after androgen-deprivation therapy[J]. Urology,1996,48(2):326-334.
[12] Hughes C, Murphy A, Martin C, et al. Molecular pathology of prostate cancer[J]. J Clin Pathol,2005,58(7):673-684.
[13] Guo Z, Huang H, Zeng L, et al. Lentivirus-mediated RNAi knockdown of prostate-specific membrane antigen suppresses growth, reduces migration ability and the invasiveness of prostate cancer cells[J]. Med Oncol,2011,28(3):878-887.
[14] Tang YQ, Jaganath I, Manikam R, et al. Phyllanthus suppresses prostate cancer cell, PC-3, proliferation and induces apoptosis through multiple signalling pathways (MAPKs, PI3K/Akt, NFκB, and hypoxia)[J]. Evid Based Complement Alternat Med,2013,2013:609581.
[15] 黄 海,黄 健,林天歆,等. 前列腺癌噬菌体抗体库的构建及抗特异性膜抗原抗体的筛选[J]. 中华泌尿外科杂志,2007,28(9):609-613.
[16] 黄 海,黄 健,林天歆,等. 前列腺特异性膜抗原人源Fab抗体可变区基因的筛选与鉴定[J]. 中华男科学杂志,2007,13(7):601-604.
[17] Zhang Y, Guo Z, Du T, et al. Prostate specific membrane antigen (PSMA): a novel modulator of p38 for proliferation, migration, and survival in prostate cancer cells[J]. Prostate,2013,73(8):835-841.
[18] 郭正辉,黄 海,杜 涛,等. PSMA对LNCaP细胞生长、迁移及ERK蛋白活性的影响[J]. 中国病理生理杂志,2011,27(6):1090-1096.
[19] Hour MJ, Tsai SC, Wu HC, et al. Antitumor effects of the novel quinazolinone MJ-33: inhibition of metastasis through the MAPK, AKT, NF-κB and AP-1 signaling pathways in DU145 human prostate cancer cells[J]. Int J Oncol,2012,41(4):1513-1519.

