Citrin缺陷导致的新生儿肝内胆汁淤积症患儿SLC25A13基因突变与生化指标的相关性研究*
卢春婷, 李佳萦, 冯 烈△, 宋元宗, 张占会, 卢筱华, 陈纤纤
(暨南大学附属第一医院 1内分泌代谢科, 2儿科, 3中心实验室, 广东 广州 510632)
在全球范围内,婴儿胆汁淤积性黄疸的患病率约为1/2 500[1]。其最常见的病因为胆道闭锁、感染和遗传性代谢异常如citrin缺陷病 (citrin deficiency, CD)、半乳糖血症、糖原累积病等[2]。没有明确病因的婴儿胆汁淤积性黄疸被称为特发性新生儿胆汁淤积症(idiopathic neonatal cholestasis, INC)。CD是由编码citrin蛋白的SLC25A13基因突变所致的一种常染色体隐性遗传病[3],目前已在CD患者中发现81种SLC25A13致病突变类型[4-5]。CD有3种年龄相关的临床表型,分别为citrin缺陷导致的新生儿肝内胆汁淤积症(neonatal intrahepatic cholestasis caused by citrin deficiency, NICCD)[6]、成人发病瓜氨酸血症II型(adult-onset citrullinemia type Ⅱ, CTLN2)[3,7]以及citrin缺陷导致的生长发育落后和血脂异常(failure to thrive and dyslipidemia caused by citrin deficiency, FTTDCD)[4]。作为CD的主要儿科临床表型,NICCD在我国并不罕见。分子流行病学调查显示我国人群SLC25A13突变携带率为1/63,其中江南地区高达1/48[8]。NICCD主要在新生儿或婴儿期发病,以肝大、黄疸、肝功能异常和低血糖为主要临床表现[7]。本研究旨在分析NICCD患儿血糖等生化指标及SLC25A13基因突变特点,并探讨两者相关性。
材 料 和 方 法
1 对象
2013年3月1日至2013年10月31日在我院以胆汁淤积性肝病临床表现就诊的0~12月龄婴儿。经SLC25A13基因分析确诊的NICCD患儿为病例组 (NICCD组);经基因分析排除NICCD诊断且未发现明确病因的INC患儿为对照组 (INC组)。本研究进行SLC25A13基因突变分析获得患儿父母书面知情同意。
2 方法
2.1DNA提取及SLC25A13基因诊断 采用DNA抽提试剂盒(Simgen)提取所有研究对象的外周血DNA;DNA marker、普通Tag酶及LA-Taq均购自TaKaRa;引物由英潍捷基(上海)贸易有限公司合成。PCR反应(PTC-200,Life Science Inc.)及凝胶电泳条件(PAC300,Bio-Rad)参考文献[9-10]。对研究对象进行4种SLC25A13基因高频突变的筛查[4],若只发现一个突变等位基因则进一步对SLC25A13基因的所有18个外显子及其侧翼序列进行测序。测序反应基于Sanger的双脱氧终止法原理,以PCR引物作为测序引物(BigDye Terminator试剂盒, BI3730测序仪)。由英潍捷基(上海)贸易有限公司广州分部完成测序反应。
2.2生化指标检测 所有患儿空腹抽取静脉血,生化实验室检查在Hitachi 7600仪器上完成,检测所有研究对象的血糖和甲胎蛋白(alpha-fetoprotein, AFP),肝酶指标丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、γ-谷氨酰转移酶(γ-glutamyltransferase, GGT)和碱性磷酸酶(alkaline phosphatase, ALP),血脂指标甘油三酯(triglyceride, TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)等数据资料。
3 统计学处理
用SPSS 13.0统计软件分析,数据用均数±标准差(mean±SD)表示,AFP及肝酶指标采用中位数 (最小值~最大值) [median (minimum~maximum)]表示。对计量资料采用t检验、方差分析或Wilcoxon秩和检验进行分析,对计数资料采用2检验进行分析,以P<0.05为差异有统计学意义。
结 果
1 NICCD血糖及其它生化指标的特点
NICCD组患儿36例,其中男14例,女22例,年龄1~12月。INC组患儿23例,其中男16例,女7例,年龄0.5~12月。如表1所示,分别经Wilcoxon秩和检验及t检验,两组间的ALT及LDL-C差异显著 (P<0.05)。NICCD组血清ALT及LDL-C的中位数均较INC组低,见图1。NICCD组血糖均值较INC组低[(5.0±1.2) mmol/Lvs(5.1±1.0) mmol/L],但差异无统计学意义。
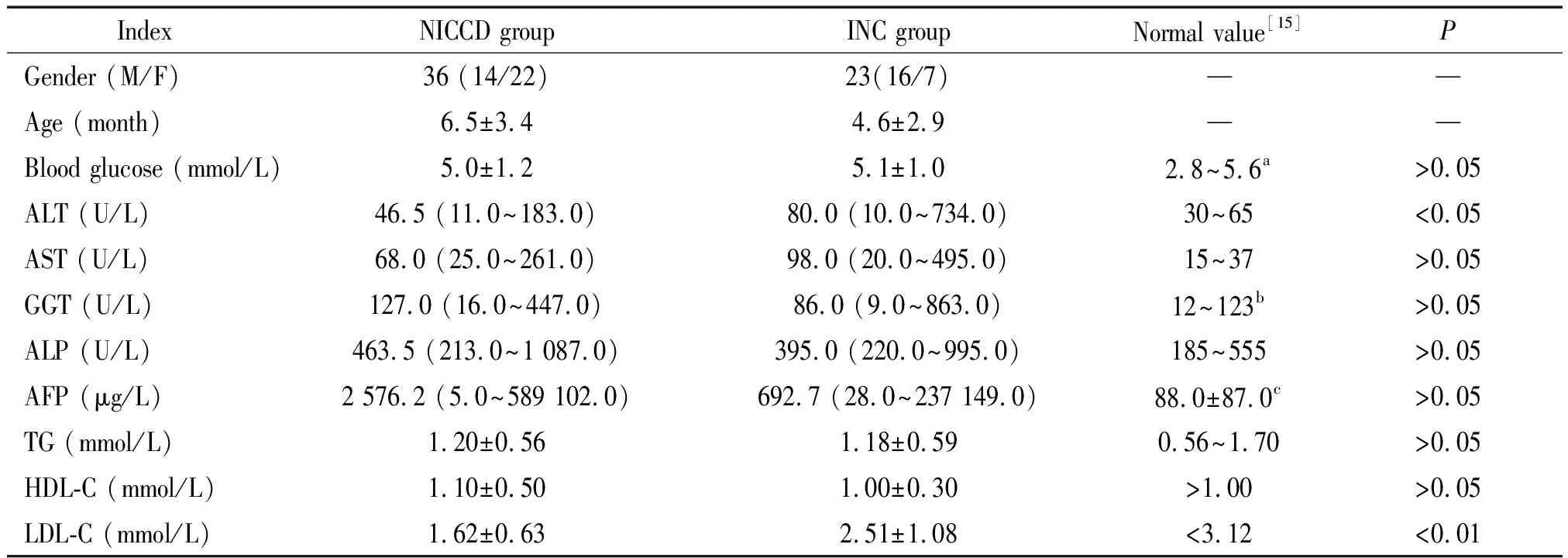
表1 NICCD组与INC组患儿的实验室指标比较
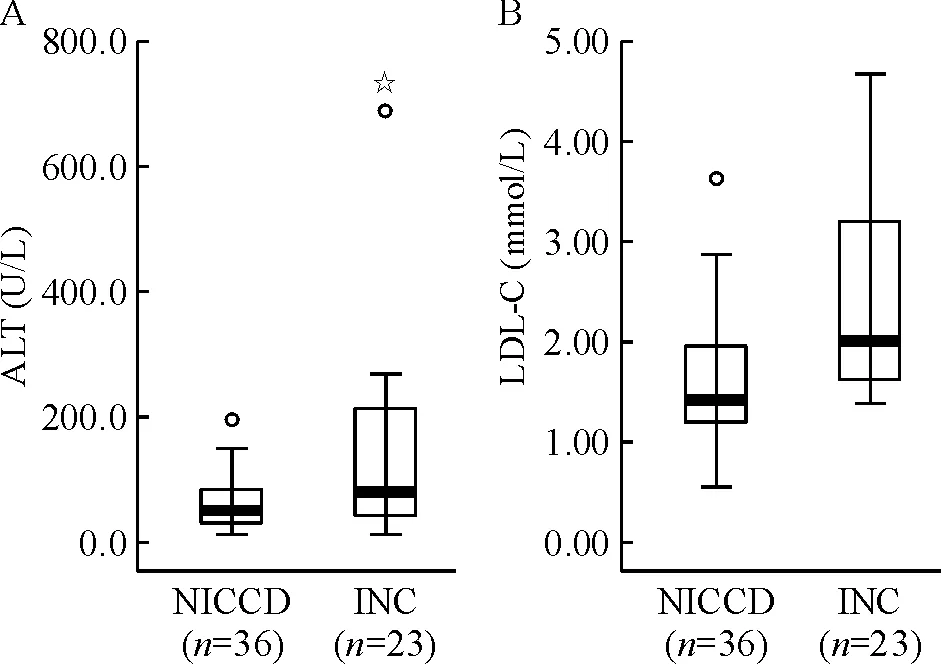
Figure 1. The serum levels of ALT (A) and LDL-C (B) in the patients with NICCD and INC. ○ and ☆ represent the outlier and extreme value, respectively.NICCD: neonatal intrahepatic cholestasis caused by citrin deficiency; INC: idiopathic neonatal cholestasis; ALT: alanine aminotransferase; LDL-C: low-density lipoprotein cholesterol. P<0.05 betweem the 2 groups.
2 SLC25A13基因突变类型在不同性别及年龄段患儿之间的差异
本研究36例NICCD患儿共检出SLC25A13基因突变10种, 其中851del4、IVS16ins3kb、IVS6+5G>A和1638ins23为高频突变,分别占全部突变的61%、11%、6%及4%,总和占82%;其余6种分别为IVSins6kb、R360X、C.2T>C、C.415G>A、Q259X和IVS11+1G>A,均为文献已报道的突变。另有5个等位基因的突变性质有待明确。经2检验,不同性别NICCD患者的SLC25A13基因突变类型分布无不同 (2=2.27,P>0.05);将NICCD患儿按月龄段分为4组,经2检验,不同年龄段的NICCD患儿SLC25A13基因突变类型无不同(2=12.03,P>0.05)。
3 SLC25A13基因突变类型与生化指标的关联性
讨 论
Citrin由SLC25A13基因编码,是一种存在于线粒体内膜的天冬氨酸/谷氨酸载体蛋白,主要在肝脏表达。Citrin的主要功能是将线粒体内天冬氨酸转运至胞质,提供尿素、蛋白及核苷酸的合成原料;同时,将胞质的谷氨酸转运至线粒体内部。以上过程与苹果酸穿梭相耦联,伴随着胞质中的NADH氧化为NAD+,从而维持NADH/NAD+比值的恒定,保持了胞质中氧化还原状态的稳定性。此外,citrin还参与能量、氨基酸、脂类代谢,并在糖酵解、糖异生代谢途径中发挥重要作用。NICCD是婴幼儿胆汁淤积症的常见病因,而citrin缺陷所致的生化与代谢异常的具体机制目前尚未十分清楚[11]。
已有研究指出NICCD与低血糖的发生有关,有学者认为这可能与citrin缺陷导致苹果酸穿梭障碍,导致胞内NADH/NAD+比值升高,抑制NADH的氧化磷酸化,致使糖酵解及糖异生受阻有关[12]。在本研究中,NICCD患儿的血糖均值较INC组低,但差异无统计学意义,与国内有关研究结果不一致[13]。这可能与本研究的对照组为非健康人群,亦可能是由于NICCD组患儿样本例数较少所致。有研究显示,与INC患儿相比,NICCD患儿的血清ALT水平较低[5],本研究结果与此一致。本研究发现NICCD患儿LDL-C水平低于INC组,在国内外属首次报道。LDL-C是富含胆固醇的脂蛋白,主要由肝脏合成,其主要作用是把胆固醇从肝脏运送到全身。NICCD患儿LDL-C的水平低于INC组,考虑是2种疾病的病因与发病机制不同所致。低LDL-C血症可能为NICCD患儿血脂紊乱的特点。

表2 SLC25A13基因突变类型与生化指标关联性分析
本研究NICCD患儿中共检出SLC25A13基因突变10种,其中851del4、IVS16ins3kb、IVS6+5G>A及1638ins23突变占所有突变的82%,为高频突变。其中,851del4所占比例为61%,是最常见的突变类型。该突变在我国SLC25A13突变携带者中占70%[14];而在患有胆汁淤积性黄疸症的婴儿中,该突变携带率为1/17,远远高于此突变在健康人群中的携带率(1/93)[15]。SLC25A13突变与血糖、ALT、AST、ALP、TG、 HDL-C及LDL-C无关联,其原因可能为不同的SLCA25A13基因突变对 citrin 蛋白功能造成的影响程度并无不同,下一步需从蛋白水平证实以上假设。另外,NICCD 患者基因型与生化表型的关系,可能存在其它影响因素,如某些未知的修饰基因、饮食因素,或者某种药物的治疗效果等。本研究提示SLC25A13基因突变分布与GGT的水平有关联,但该发现的意义或价值尚不明确。是否携带某种SLC25A13突变基因的患儿其GTT水平较携带其它突变的患儿高,有待采取增大样本量的方式进行深入研究。
[参 考 文 献]
[1] Dick MC, Mowat AP. Hepatitis syndrome in infancy: an epidemiological survey with 10 year follow up[J]. Arch Dis Child, 1985, 60(6):512-516.
[2] Suchy FJ. Neonatal cholestasis[J]. Pediatr Rev, 2004, 25(11):388-396.
[3] Kobayashi K, Sinasae DS, Iijima M, et a1. The gene mutated in adult-onset type Ⅱ citrullinaemia encodes a putative mitochondrial carrier protein[J]. Nat Genet, 1999, 22(2):159-163.
[4] Song YZ, Zhang ZH, Lin WX, et al.SLC25A13 gene analysis in citrin deficiency: sixteen novel mutations in East Asian patients, and the mutation distribution in a large pediatric cohort in China[J]. PLoS One, 2013, 8(9): e74544.
[5] Chen HW, Chen HL, Ni YH, et al. Chubby face and the biochemical parameters for the early diagnosis of neonatal intrahepatic cholestasis caused by citrin deficiency[J]. J Pediatr Gastroenterol Nutr, 2008, 47(2):187-192.
[6] Ohura T, Kobayashi K, Tazawa Y, et al. Neonatal presentation of adult-onset type II citrullinemia[J]. Hum Genet, 2001, 108(2):87-90.
[7] Saheki T, Kobayashi K. Mitochondrial aspartate glutamate carrier (citrin) deficiency as the cause of adult-onset type II citrullinemia (CTLN2) and idiopathic neonatal hepatitis (NICCD)[J]. J Hum Genet, 2002, 47(7):333-341.
[8] Tabata A, Sheng JS, Ushikai M, et al. Identification of 13 novel mutations including a retrotransposal insertion inSLC25A13 gene and frequency of 30 mutations found in patients with citrin deficiency[J]. J Hum Genet, 2008, 53(6): 534-545.
[9] Yasuda T, Yamaguchi N, Kobayashi K, et al. Identification of two novel mutations in theSLC25A13 gene and detection of seven mutations in 102 patients with adult-onset type II citrullinemia[J]. Hum Genet, 2000, 107(6): 537-545.
[10] Lin WX, Zhang ZH, Deng M, et al. Multiple ovarian antral follicles in a preterm infant with neonatal intrahepatic cholestasis caused by citrin deficiency: a clinical, genetic and transcriptional analysis[J]. Gene, 2012, 505(2):269-275.
[11] Wang JS, Wang XH, Zheng YJ, et al. Biochemical characteristics of neonatal cholestasis induced by citrin deficiency[J]. World J Gastroenterol, 2012, 18(39):5601-5607.
[12] Kimura A, Kage M, Nagata I, et al. Histological findings in the livers of patients with neonatal intrahepatic cholestasis caused by citrin deficiency[J]. Hepatol Res, 2010, 40(3): 295-303.
[13] 张 文,刘 丽,盛慧英,等. Citrin缺陷导致的新生儿肝内胆汁淤积症内分泌代谢特征分析[J]. 中国实用儿科杂志, 2013, 28(11):15-17.
[14] Lu YB, Kobayashi K, Ushikai M, et al. Frequency and distribution in East Asia of 12 mutations identified in theSLC25A13 gene of Japanese patients with citrin deficiency[J]. J Hum Genet, 2005, 50(7):338-346.
[15] Treespongkaruna S, Jitraruch S, Kodcharin P, et al. Neonatal intrahepatic cholestasis caused by citrin deficiency: prevalence andSLC25A13 mutations among Thai infants[J]. BMC Gastroenterol, 2012, 12:141.

