犬新鲜精液常温保存时间对精液冷冻效果的影响
杨应华,刘小萍,钟友刚,施振声
(中国农业大学动物医学院,北京 海淀 100193)
犬精液冷冻技术能显著提高犬繁育效率,在欧美等国家已经取得了广泛的应用。虽然目前世界上没有一个统一的冷冻操作规范,但仍然存在着一些操作惯例。比如人们总是尽快将采集的新鲜精液进入冷冻程序,因为在体外犬精液的质量会随时间延长而出现下降。然而在实际操作过程中,从精液采集成功到精液进入冷冻操作程序之间的这段时间是不可避免的。首先精液质量的评估需要一段时间,其次一些冷冻实验室与精液采集地可能距离较远,这也会耽误一定时间。为了探究延迟时间对冷冻效果的影响程度及确定一个可接受的时间范围,本研究调查了犬新鲜精液在常温下不同的保存时间对精液冷冻效果的影响,以期为实际操作规范的制定提供参考。
1 材料
1.1 试验动物 共5只公犬(3只中型杂种犬,1只比格犬,1只萨摩耶犬),年龄2~5岁,体况良好,均来自中国农业大学实验动物中心。饲喂全价日粮,不限饮水,每日遛1~2次。
1.2 试验试剂 三羟甲基氨基甲烷(Tris)、一水柠檬酸、果糖、甘油、青霉素、链霉素、蛋黄、Equex STM paste(Nova ChemicalSales,Scituate Inc.,MA,USA)、台盼蓝染色液、吉姆萨染色液、中性红、甲醛等。
1.3 主要仪器 日本Olympus公司CX41型相差显微镜;以色列Sefi MedicalInstruments公司Makler细胞计数板;德国Minitube公司,0.5 mL细管、液氮罐;澳大利亚Cryologic公司,CL-3300程序控温仪;日本视科特,JL-3001D摄像机等。
2 方法
2.1 精液采集 手握法采集富含精液段和部分前列腺液段精液,用集精漏斗收集至15 mL离心管中。每次试验共采集5只犬精液,由2人共同完成。试验重复3次,每次试验间隔3 d。
2.2 精液质量评估
2.2.1 密度 将少量精液用蒸馏水稀释10倍,放置1 min后精子即失去活力,之后移液器吸取10μL于Makler细胞计数板进行计数。
2.2.2 活力 电脑辅助的主观测量。根据精液密度将精液用生理盐水适当稀释,之后用Makler细胞计数板在相差显微镜20倍物镜下观察,配合使用带有录制和回放功能的摄像软件进行活力的主观测量。每个样品镜下随机检查5个视野,统计精子总数不少于200个。
精子活力=直线前行精子数/总精子数×100%
2.2.3 质膜完整率 采用低渗透压法(Hypo-osmotic test)进行测量。配置含75 mmol/L果糖和25 mmol/L柠檬酸的低渗透压水溶液(100 mOsmol/L)。取20μL精液用低渗液稀释至200μL,在37℃水浴中放置1 h后在相差显微镜40倍物镜下观察。
质膜完整的精子会出现尾部蜷曲,而质膜不完整的精子形态不发生变化。前者所占比例即为质膜完整率。
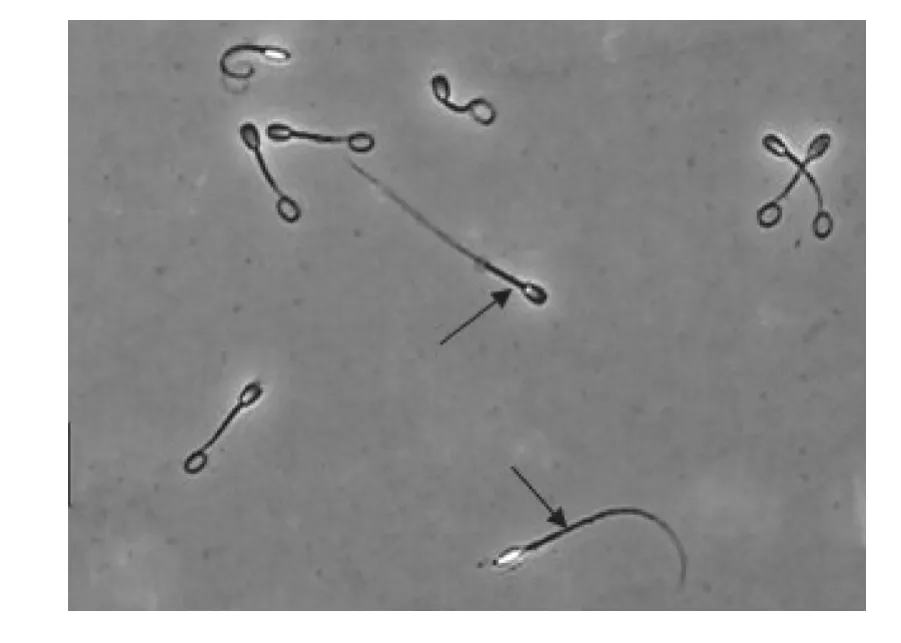
图1 犬精子在低渗液中的相差显微镜下观察 (400×)
2.2.4 顶体完整率 采用改良的台盼蓝-吉姆萨复染色法进行测量[1]。取50μL精液与等体积0.2%台盼蓝混合,置于37℃水浴中5 min,制作涂片后用福尔马林-中性红溶液固定2 min,然后将风干玻片在37℃温箱中用7.5%吉姆萨染液染色3 h,最后冲洗玻片,待风干后油镜下检查。
台盼蓝染色可鉴别精子死活,吉姆萨染色可区分顶体完整与否,所以该复染色法能同时鉴别精子的死活和顶体完整率。顶体完整率=顶体完整的活精子/精子总数
2.3 精液混合,分组 将质量合格的精液(活力>80%)混合均匀,平均分为3份,分别标记为对照组、0.5 h组和1 h组。对照组立即进入冷冻阶段,30 min后0.5 h组进入冷冻阶段,再过30 min后1 h组进入冷冻阶段。各组进入冷冻阶段前进行精子质量评估。
2.4 精液冷冻 冷冻稀释液及冷冻步骤大致遵循Linde Forsberg的方法[2],使用程序温控仪进行降温。冷冻程序简述如下:700 r/min离心5 min,去除上清液,用稀释液1稀释精液至4亿个/mL浓度,将精液置于含室温水的烧杯中后再放入冰箱平衡1.5 h至5℃,再逐滴加入与稀释液1等体积的稀释液2,最后再置于冰箱20 min。将精液用吸液器装入0.5 mL细管后热封,再插入程序温控仪降温(降温速率:5℃-20℃-80℃),最后在液氮罐中长期保存。
2.5 精液解冻和质量评估 精液冷冻保存至少1个月后,将液氮中的细管迅速浸没于37℃水浴中不断摇动。1 min后将冻融精子加入37℃的1 mL解冻液中混匀。在解冻5 min后对精液的活力、质膜完整率和顶体完整率进行评估。。
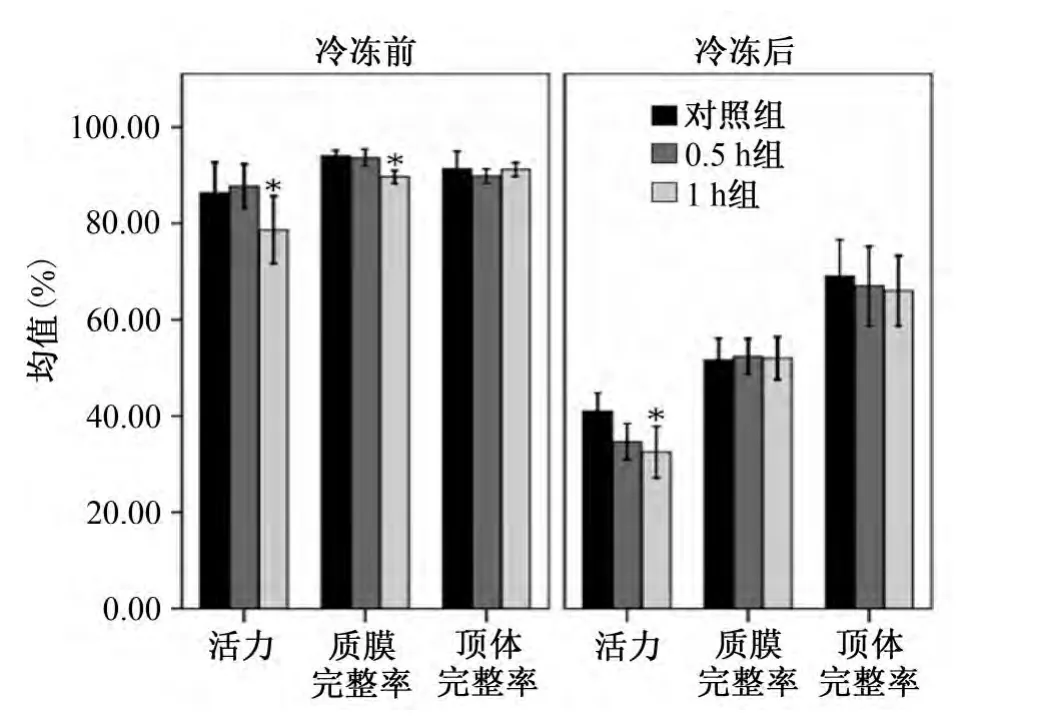
图2 犬新鲜精液常温保存不同时间对冷冻前后精液质量的影响
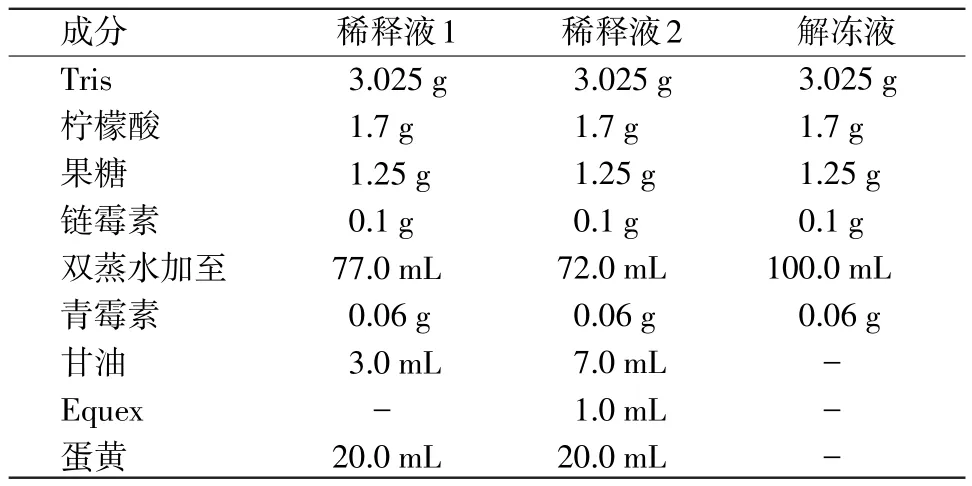
表1 稀释液及解冻液配方(100 mL体系)
2.6 统计数据分析 应用SPSS统计软件(17.0.0版本SPSS Inc.,Chicago,IL,USA)单因素方差分析中的最小差异性显著法(LSD,Least Significant Difference)进行方差分析,当P<0.05时认为有显著差异。
3 结果
刚采集的精液平均密度为1.2亿/mL,活力86.33%,冷冻前后精液质量见表2和图1
3.1 活力 冷冻前0.5 h组活力与对照组无显著差异,但1 h组活力与对照组差异显著(P<0.05);解冻后,所有组精子活力都显著低于冷冻前。对照组,0.5 h组和1 h组精子活力依次降低,但只有1 h组活力显著低于对照组(P<0.05)。
3.2 质膜完整率 冷冻前,0.5 h组与对照组无显著差异,但1 h组活力与对照组相比有显著下降(P<0.05);解冻后,同冻前相比所有组精子的质膜完整率都显著下降,但各组见无显著差异(P>0.05)。
3.3 顶体完整率 冷冻前各组间无显著差异(P>0.05),解冻后所有3组的顶体完整率都显著下降,但各组间仍无显著差异(P>0.05)。
4 分析与讨论
本研究调查了犬新鲜精液在常温下的保存时间对冷冻效果的影响。犬新鲜精液在体外常温条件下保存时间非常有限,因为精液中的主要液体成分是前列腺液,其营养、pH值等条件并不适合精液的长期保存。England等证明,如果将犬精子与其自身的前列腺液混合培养,精子质量会下降得更快[3]。Hermansson也发现,即使将新鲜精液置于4℃保存,精子活力在第1天就会显著下降,到第2天精子活力全部丧失[4]。本研究的结果与前人的发现一致,常温保存1 h就会使新鲜精液的活力和质膜完整率出现显著的下降。
由于不可避免的冷冻损伤,解冻后精液的各项指标都显著下降。对照组解冻后的活力(40.92%)还不是很理想,这可能与冷冻前精液活力(86.33%)不是非常高及冷冻过程中一些人为操作有关。对照组的活力显著高于1 h组而与0.5 h组无显著差异,这说明新鲜精液常温保存0.5 h还不足以显著影响解冻后精子活力,而保存1 h则会产生显著的影响。考虑到冷冻前后对照组和0.5 h组的活力(冻前分别:86.33%和87.67%;冻后分别:40.92%和34.58%)差距有所增大,说明新鲜精液常温保存0.5 h也对解冻后精液的品质造成了一定的不利影响。解冻后质膜和顶体完整率在各组间都无显著影响,表明这两个形态学指标对试验中采用的常温保存时间(0.5 h或1 h)没有比活力指标对保存时间那么敏感,推测更长的保存时间才能造成显著的形态学变化。
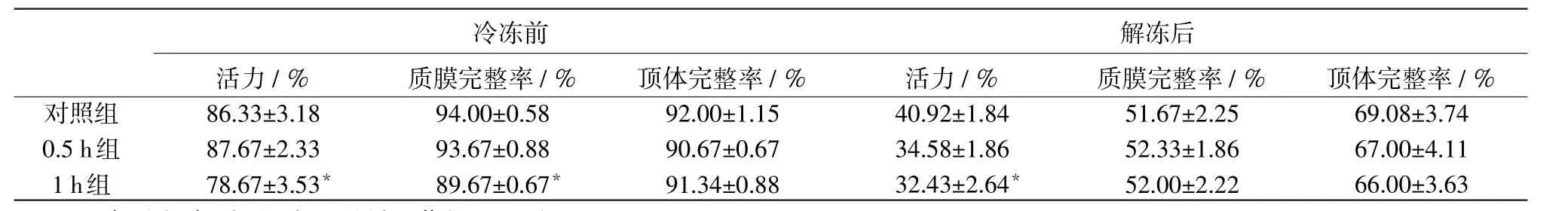
表2 犬新鲜精液常温保存不同时间对冷冻前与解冻后的精子质量的影响
犬精液冷冻的实际生产实践中,精液采集与冷冻实验室不在同一地情况时有发生。这种情况下,如果两地距离间隔比较远,可以将鲜精用专门的稀释液稀释后冷藏保存,保存时间在2 d以内不会影响冷冻效果[5]。本研究结果表明,如果两地距离很近(半小时车程内),就可以免去运送犬只、配置稀释液及冷藏操作等麻烦,可直接在室温下将精液送至实验室冷冻,而不至于对冷冻效果产生显著的不利影响。本研究选用的鲜精保存条件是便于实际操作的室温(23℃),因为犬精子相较于其他动物的精子更能耐受低温[6],而精子在低温时活动代谢减缓,据此推断在更低保存温度下(如15℃或4℃等),精子质量下降速度可能更慢,但尚需进一步试验研究证实。
5 结语
犬新鲜精液在常温下保存0.5 h不会对冻融精液的活力、质膜和顶体完整率造成显著影响;而保存1 h可显著降低冻融精液的活力,但质膜和顶体完整率不受影响。所以在犬精液冷冻的实际操作中,为了获得最好的冷冻效果,精液采集后应在30分钟内进入冷冻程序。
[1]Kovacs R H.Foote.Viability and acrosome staining of bull,boar and rabbit spermatozoa[J].Biotechnic & Histochemistry,1992,67:119-124.
[2]Linde Forsberg S.Ponglowhapan,Birgitta Esse′n-Gustavsson.In⁃fluence of glucose and fructose in the extender during long-term storage of chilled canine semen[J].Theriogenology,2004,62:1498-1517.
[3]England G C W,Allen W E.Factors affecting the viability of ca⁃nine spermatozoa.II.Effects of seminal plasma and blood[J].The⁃riogenology,1992,37:373-381.
[4]Hermansson U,Linde Forsberg C.Freezing of stored,chilled dog spermatozoa[J].Theriogenology,2006,65:584-593.
[5]Rota A,Strom B,Linde-Forsberg C.Effectofseminalplasma and three extenders on canine sperm stored at 4℃[J].Theriogenology,1995,44:885-990.
[6]Margaret V.Root Kustritz,Successful Breeding and Health Man⁃agement[M].USA:Elsevier Inc,2006:332.

