革兰阴性杆菌对喹诺酮类药物耐药变迁分析
吴小玲
(南昌大学抚州医学分院,江西 抚州 344000)
喹诺酮类抗菌药物是当今临床上最常用的抗菌药物之一,具有抗菌谱广、抗菌活性高、组织穿透性强、生物利用度高、半衰期长、血药浓度高、组织分布广等优点,对革兰阳性菌和革兰阴性杆菌均显示有良好的抗菌活性,广泛用于泌尿生殖系统、呼吸系统、消化系统感染性疾病的治疗。但随着在医疗、农业、畜牧养殖等各个领域的广泛应用和不合理应用,细菌对其耐药问题日益突出。国内各地都不同程度地开展了细菌耐药性监测,对喹诺酮类抗菌药的耐药率进行了报道,但到目前为止,对于耐喹诺酮类的革兰阴性杆菌的耐药变迁状况并不十分清楚,而了解喹诺酮类的耐药变迁状况对指导合理使用喹诺酮类药物具有重要意义。为此检索了国内公开发表的标题含2002-2011年关于细菌耐药性监测的文献,对文献中的喹诺酮类药物的耐药率进行了归类分析,以期了解细菌对喹诺酮类药物耐药的变迁状况。报告如下。
1 结果
1.1 文献筛选概况 共检索到相关文献2319篇,剔除不符合条件的文献,共筛选到文献96篇,其中对2002年间细菌耐药监测报道的文献有6篇,2003年的有5篇,2004年的有6篇,2005年的有5篇,2006-2007年的有13篇,2007年的有6篇,2008年的有11篇,2009年的有16篇,2010年的有21篇,2011年的有7篇。
1.2 细菌耐药率 环丙沙星和左氧氟沙星是喹诺酮类药物最常用的药物之一,国内细菌耐药监测机构均把两药作为喹诺酮类的代表药。本研究调查了革兰阴性杆菌中的常见肠杆菌科细菌和非发酵革兰阴性杆菌对环丙沙星和左氧氟沙星的不同年份的耐药率。肠杆菌科细菌对喹诺酮类药物的耐药率见表1,非发酵革兰阴性杆菌对喹诺酮类药物的耐药率见表2。

表1 肠杆菌科细菌对喹诺酮类药物的耐药率 /%
2 讨论
近10年来,随着氟喹诺酮类药物应用规模的扩大,细菌对其产生耐药性而使其逐渐失去抗菌活性的问题在世界范围内日益凸显。本次国内文献调查显示,2002-2011年革兰阴性杆菌对喹诺酮类药物的耐药总体呈缓慢上升趋势。从表1中可以看出,大肠埃希菌对环丙沙星的耐药率从2002年的51.3%到2007年的67.2%再到2011年的66.5%,10年间耐药率保持高位,耐药状况严重;大肠埃希菌对左氧氟沙星的耐药变迁与环丙沙星相似,耐药率略低但无显著差异。总体来看,肠杆菌科细菌对喹诺酮类药物的耐药率的变化趋势是:先逐年上行,2006年和2007年达最高,然后缓慢下行或平行。之所以在2007年后耐药率没有往上攀升,可能是与国家政府高度重视、加强监测和监管有关。表2结果表明,非发酵革兰阴性杆菌对喹诺酮类药物的耐药状况不容乐观。鲍曼不动杆菌对环丙沙星的耐药率从2002年的33.8%一直逐年攀升到2011年的68.0%,对左氧氟沙星的耐药也是保持上升的势头,耐药状况令人担忧。而嗜麦芽寡养单胞菌对喹诺酮类特别是左氧氟沙星保持低耐药,10年间耐药率保持在13.0%左右,呈现良好的敏感性。
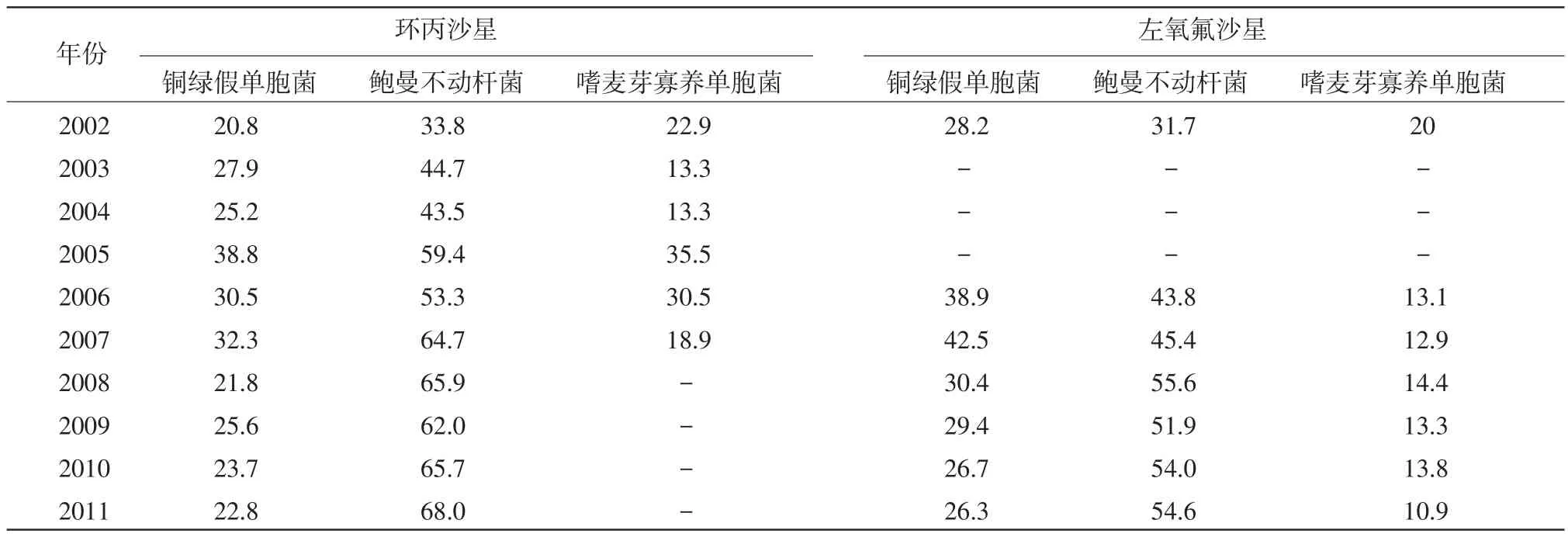
表2 非发酵革兰阴性杆菌对喹诺酮类药物的耐药率
从变迁总趋势来看,2002-2011年大肠埃希菌及鲍曼不动杆菌对喹诺酮类的耐药率呈上升趋势,10年大肠埃希菌对环丙沙星和左氧氟沙星的耐药率分别增长了15.2%、10.8%,2002-2007年的增幅较大,分别增长15.9%和15.0%;而鲍曼不动杆菌对环丙沙星和左氧氟沙星的耐药率增长速度更快,分别增长34.2%和22.9%。
环丙沙星、左氧氟沙星等喹诺酮类是一类人工合成的药物,作用于细菌DNA促旋酶和拓扑异构酶Ⅳ,使得细菌DNA无法复制而起抑菌作用。随着此类药物的过度应用,耐药菌不断出现。在20世纪,细菌对喹诺酮类耐药是由DNA促旋酶和拓扑异构酶Ⅳ编码基因(gyr A、gyr B、par C、par E)突变所致[1]。1998年,Martinez等[2]发现了第1个质粒介导的喹诺酮类耐药基因qnr,(现命名为qnr A),近年来报道证实[3-4]qnr B、Qnr S等新型质粒基因也介导喹诺酮类耐药。qnr基因表达产物对喹诺酮类作用靶位具有保护作用而耐药。2006年,Robicsek等[5]在革兰阴性杆菌中发现了质粒上存在一种能介导氨基糖苷类耐药的新型氨基糖苷乙酰转移酶基因[aac(6′)-Ib-cr],其相应的酶可作用于环丙沙星等药物的哌嗪环使胺基乙酰化而介导细菌对氟喹诺酮类药物耐药。近年来对细菌外排泵耐药研究甚多。外排泵是细菌对喹诺酮类耐药的另一重要途径。AcrAB-TolC外排泵是大肠埃希菌等的最主要多重药物外排系统,在革兰阴性杆菌的多重耐药性中起重要作用[6]。2010年,在肠杆菌科细菌中率先发现了产Ⅰ型新德里金属B-内酰胺酶(简称NDM-1金属酶)的泛耐药菌,对青霉素类、头孢菌素类、氨基糖苷类、喹诺酮类等广泛耐药[7]。
总之,作为世界上氟喹诺酮类药物生产和使用居于首位的国家,我国氟喹诺酮类药物的细菌耐药形势相当严峻。这与我国畜牧业滥用氟喹诺酮类药物有着密切关系。据报道[8],我国每年用于畜牧业的抗菌药为6000吨,其中约500~1000吨为氟喹诺酮类药物,使用数量如此之大!畜牧业抗菌药物的滥用诱导与加速了耐药菌的蔓延,造就了大肠杆菌等细菌对氟喹诺酮类药物高度耐药这一“中国特色”。为遏制细菌耐药性,建议我国有关部门应适当限制批准临床常用的氧氟沙星、环丙沙星等药物用于食用动物的饲养,尤其禁止预防性使用;所有用于食品动物的抗菌药都应制订停药期标准;开展动物源抗菌药耐药性全面、系统的监测工作;加强细菌耐药性知识的培训和宣传,尤其是各养殖企业应加强对从业人员的培训和宣传教育工作。
[1]夏磊磊,国宪虎,张玉臻,等.喹诺酮类药物及细菌对其耐药性机制研究进展[J].中国抗生素杂志,2010,35(4):255-261.
[2]Martinez-Martinez L,Pascual A,Jacoby G A.Quinolone resis⁃tance from a transferable plasmid[J].The Lance,1998,351(9105):797-799.
[3]Jacoby G A,Walsh K E,Mills D M,et al.QnrB,another plasmidmediated gene for quinolone resistance[J].Antimicrob Agents Che⁃mother,2006,50(4):1178-1182.
[4]Hata M,Suzuki M,Matsumoto M,et al.Cloning ofa novelgene for quinolone resistance from a transferable plasmid in Shigella flexneri 2b[J].Antimicrob Agents Chemother,2005,9(2):801-803.
[5]Robicsek A,Strahilevit Z J,Jacoby G A,et al.Fluoroquinolonemodifying enzyme:a new adaptation of a common aminoglycoside acetyltransferase[J].Nature Me,2006,12(1):83-88.
[6]Piddock L J.Multidrug-resistance efflux pumps-notjustfor resis⁃tance[J].Nat Rev Microbiol,2006,4:629-636.
[7]Kumarasamy K K,Toleman M A,Walsh T R,et al.Emergence of a new antibiotic resistance mechanism in India,Pakistan,and the UK:a molecular,biological,and epidemiological study[J].Lancet Infect Dis,2010,10(9):597-602.
[8]白毅.遏制氟喹诺酮类药物细菌耐药[N].中国医药报,2009-4-14(B01).

