非洲猪瘟病毒E183L、B 602L、K 205R和A 104R基因表达及诊断抗原筛选
张鑫宇,陈 宇,刘文俊,夏晓莉,孙怀昌
(扬州大学兽医学院,江苏 扬州 225009)
非洲猪瘟(African swine fever,ASF)是一种由ASFV引起家猪和野猪的传染病,具有死亡率高和传播迅速的特点[1]。1921年该病最早发现于东非的肯尼亚[2],以后的几十年内传播到非洲、欧洲、美洲等许多国家,并且有继续蔓延的趋势[3-4],目前虽然该病尚未传入我国,但近年来邻国大面积的流行[5],使得我国面临严重威胁。
本研究选择了ASFV4种基因,其中ASFV E183L基因编码的p54蛋白,其抗体具有一定的病毒中和能力[6];B602L基因编码的pB602L蛋白,可刺激机体产生较高水平的抗体[7];K205R基因是一早期转录基因,其编码的pK205R蛋白能较早刺激机体产生抗体[7];A104L基因编码的组氨酸样蛋白,能与ASFV抗体阳性血清发生免疫沉淀反应[8]。构建了携带这4种基因的重组载体,表达并纯化出重组蛋白pA104L、p54、pK205R和pB602L,分别以这4种重组蛋白包被酶标板,ELISA方法筛选可以用于ASFV抗体检测的诊断抗原,具体过程如下。
1 材料与方法
1.1 材料 重组质粒pGEX-4T-1-E183L、pGEX-4T-1-B602L、pGEX-4T-1-K205R和pGEX-4T-1-A104R 由 Gulbenkian de Ciência研 究 所 Parkhouse R M教授惠赠;原核表达载体pET-30a(+)、大肠杆菌BL21(DE3),购自Novagen公司;限制性内切酶、连接酶、PrimeSTAR HS DNA 聚合酶、dNTP;Ni-NTA琼脂糖,购自Qiagen公司;HRP标记羊抗猪IgG(H+L),购自Earthox公司;OPD,购自Sigma公司;ASFV抗体阴性、阳性血清由英国Pirbright研究所提供;其他化学试剂均为国产分析纯级试剂。
1.2 方法
1.2.1 表达载体构建 根据ASFV Ba71V株基因组序列(GenBank No.U18466.1)设计针对基因E183L和B602L特异性引物:p54F 5′-TAGAATTCCTATTCTCTTCAAGAAAG-3′,p54R 5′-TACTCGAGTTACAAGGAGTTTTCTAGG-3′;pB602LF 5′-CTGAATTCATGGCAGAATTTAATATT⁃GATGAGCTTC-3′,pB602LR 5′-CTGCGGCCGCTTAC AATTCTGCTTTTGTATATAAAATT-3′,其中E183L上游引物从该基因第151核苷酸开始。以质粒pGEX-4T-1-E183L和pGEX-4T-1-B602L为模板,分别扩增一段402bp的E183L基因及B602L基因,扩增产物用限制酶EcoRⅠ、XhoⅠ和EcoRⅠ、NotⅠ消化后,插入表达载体pET-30a(+),构建重组质粒pET-p54和pETB602L,并转化感受态大肠杆菌BL21(DE3)。用限制内切酶EcoRⅠ、XhoⅠ酶切质粒pGEX-4T-1-K205R和pGEX-4T-1-A104R,将酶切下的小片段DNA插入载体pET-30a(+),构建重组质粒pET-K205R和pETA104R,转化感受态大肠杆菌BL21(DE3)。
1.2.2 重组蛋白表达 将上述4种重组菌按1∶100接种2 mL卡那霉素(50μg/mL)2×YTK培养基,37℃培养至4 h,加入终浓度为1 mmol/L IPTG,37℃诱导表达4 h,离心沉淀菌体。0.01 moL/L pH值7.6 PBS洗涤2遍,400μL PBS悬浮菌体,加入400μL 2×上样缓冲液混匀,煮沸5 min,10000 r/min离心5 min后,取上清液进行SDS-PAGE(12%分离胶),电泳结束后,考马斯亮蓝G-250溶液染色3 h,用脱色液脱色,分析外源基因是否表达,同时设空载体转化菌对照。
1.2.3 表达产物纯化及鉴定 按照上述方法按比例进行重组菌扩大培养和诱导表达,离心沉淀菌体用PBS洗涤2遍,用超声波裂解仪裂解菌体,10000 r/min离心10 min,分别取部分离心上清及沉淀进行SDS-PAGE分析,确定表达产物是可溶的还是以包涵体形式存在。
按照Qiagen公司说明书,用His亲和层析凝胶纯化表达的重组蛋白,ND-1000紫外分光光度计(Nano Drop公司)定量蛋白浓度,并用0.01 mol/L pH值7.4 PBS调整最终浓度为1 mg/mL。Western blotting鉴定纯化的4种重组蛋白,所用的一抗为200倍56℃灭活2 h的ASFV抗体阳性猪血清,二抗为10000倍辣根过氧化物酶标记的羊抗猪IgG,最终用DAB显色。
1.2.4 间接ELISA 纯化的抗原包用0.05 mol/L pH值9.6的碳酸盐缓冲液稀释后,包被NUC公司96孔酶标板,100μL/孔,37℃作用2 h;PBST洗涤液(0.01 mol/L pH值7.6 PBS,0.05%Tween-20)洗板2次,200 μL/孔,3 min/次;加入封闭液(0.01 mol/L pH值7.6 PBS,5%脱脂乳粉),200μL/孔,37℃作用1 h;洗板2次后,加入用封闭液200倍稀释的血清,100μL/孔,37℃作用1 h;洗板4次后,加入1倍工作浓度的HRP标记羊抗猪IgG(H+L),100μL/孔,37℃作用1 h;洗板4次后,吸水纸上拍干板孔中液体,加入新鲜配制的OPD底物溶液,100μL/孔,室温静置15 min;加入2 mol/L H2SO终止反应,50μL/孔;酶标仪490 nm波长下,读取每孔吸光值。
2 结果
2.1 表达载体鉴定 将PCR产物及酶切产物插入载体pET-30a(+),限制内切酶酶切重组质粒pET-p54、pET-B602L、pET-K205R和pET-A104R进行鉴定,结果分别切下大小约402 bp、1809 bp、618 bp和315bp的DNA条带(图1),确认构建的重组载体正确。
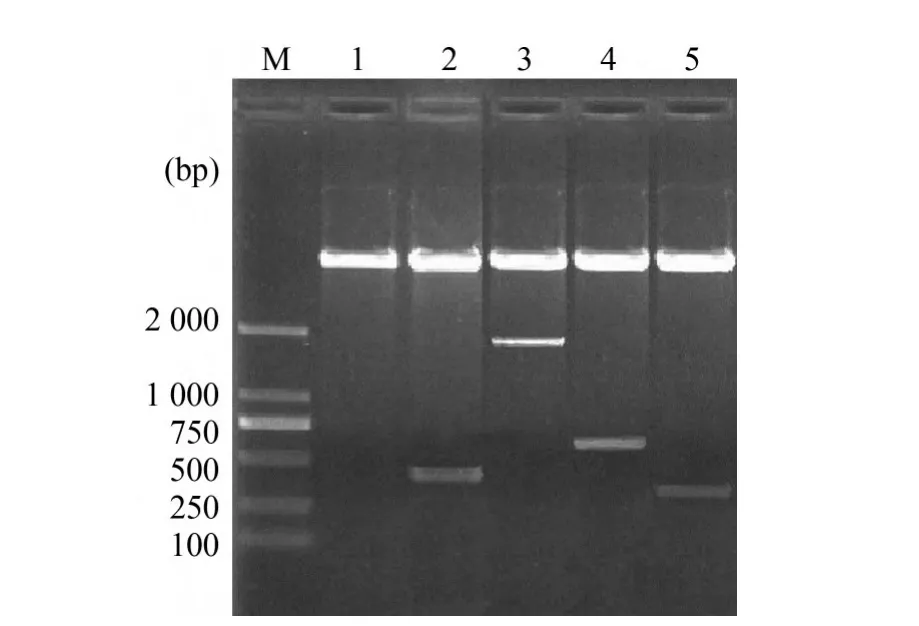
图1 重组载体酶切鉴定
2.2 重组蛋白表达 IPTG分别诱导携带重组质粒pET-A104R、pET-B602L、pET-p54、pET-K205R的大肠杆菌表达,SDS-PAGE电泳裂解产物,结果上述4种重组菌分别表达预期大小的pA104R、pB602R、p54、pK205R重组蛋白,分子量分别为19 kDa、75 kDa、21 kDa和25 kDa,而诱导及空载体对照无相应的蛋白条带。
2.3 重组蛋白纯化及鉴定 IPTG诱导重组菌表达后,超声波裂解菌体,分别取离心上清和沉淀进行SDS-PAGE分析,结果显示,除重组蛋白pK205R以包涵体形式存在外,其他3种重组蛋白pA104R、pB602R、p54均为可溶性蛋白。分别在尿素变性和非变性条件下进行Ni柱亲和纯化,纯化产物进行Western-blotting分析,结果显示,纯化的重组蛋白pA104R、pK205R、pB602R、p54与ASFV免疫血清均呈阳性反应(图2)。

图2 纯化的重组蛋白W estern-blotting分析
2.4 血清学诊断抗原筛选
2.4.1 重组蛋白检测高滴度的ASFV抗体 将重组蛋白p54、pB602R、pK205R和pA104R梯度稀释后包被酶标板,以ASFV弱毒OURT88/3接种后第20天感染强毒OURT88/1存活下来的猪血清为检测对象,间接ELISA测定其抗体,同时设立ASFV抗体阴性对照,结果重组抗原pK205R、p54和pB602L血清学反应较好,但pB602L与阴性血清有轻微的交叉反应(图3)。
2.4.2 重组蛋白检测不同时期的ASFV抗体 将重组蛋白p54、pB602R、pK205R和pA104R稀释成2μg/mL,包被酶标板,以ASFV弱毒OURT88/3接种后第6、13、19天采集的猪血清为检测对象,间接ELISA测定其抗体,同时设立ASFV抗体阴性对照,结果重组抗原p54在13 d时检测效果最好,pK205R次之(图4)。
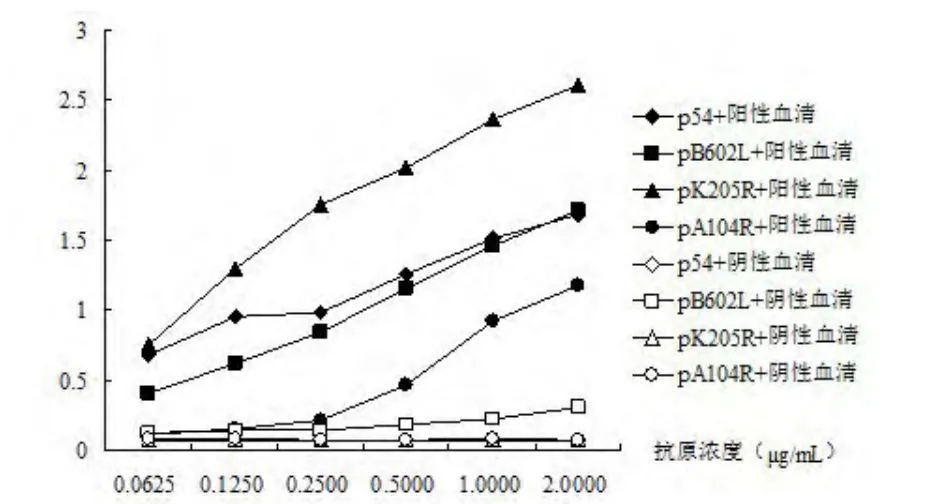
图3 间接ELIS A检测高滴度A S FV抗体
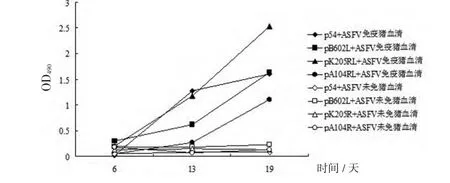
图4 间接ELIS A检测A S FV感染后不同时期的抗体
3 讨论
非洲猪瘟病毒(ASFV)是一种复杂的大DNA病毒,猪或野猪感染后,潜伏期通常为3~15 d,强毒株感染的死亡率可达到100%,毒力稍弱的毒株感染后表现为发热、精神沉郁等症状,低毒株感染出现亚临床症状或仅血清抗体转阳,易与猪其他疾病混淆[1]。OIE认为,在ASF流行疫区和低毒力ASFV感染初期地区进行调查、诊断,血清学方法是首推的诊断方法,而以纯化的重组蛋白作为检测抗原,比病毒感染后的可溶性细胞裂解更具优势[9]。
ASFV感染猪巨噬细胞后,细胞内至少可表达100种病毒蛋白,其中约50种能与感染或康复期猪血清发生抗原抗体反应[10],2009年,Gallardo等[11]从ASFV感染康复猪血清中筛选到12种较强免疫原性 抗 原,以其中的 p54、pB602L、pK205R 和pA104L重组蛋白为抗原,分别建立了检测ASFV抗体的ELISA方法,田间检测发现,该ELISA方法与OIE推荐的ELISA方法具有较高的检测符合率。这些重组蛋白融合标签为谷胱甘肽S转移酶(GST),由于其分子量较大(26kDa),造成ELISA背景值较高,检测时需要设立GST本底对照。本研究对ASFV E183L、B602L、K205R和A104R基因进行了亚克隆,其中的E183L基因,由于前150个核苷酸编码疏水性蛋白和无B细胞表位蛋白,因此将其切除,并融合上组氨酸(His)标签,以表达纯化的重组蛋白为抗原进行ELISA试验,结果反应背景大大降低,检测时也不需要设立本底对照。
用不同抗原建立的间接ELISA分别检测ASFV感染后猪血清中的抗体,发现在感染后的中后期,pK205R、p54和pB602L检测效果较好,而在感染早期抗体检测时,p54检测效果最好,pK205R次之。由此可见,4种重组蛋白中,p54和pK205R无论在ASFV感染早期还是中后期,均可用作诊断抗原检测相应的抗体,这对今后检测ASFV抗体试剂盒的开发具有重要的指导意义。
[1]Straw B E,Zimmerman J J,Allaire S D,et al.Disease of Swine[M].9th ed.Wiley-Blackwell Publishing,2006:291-298.
[2]Montgomery R E.On a form of swine fever occurring in British East Africa(Kenya Colony)[J].Journalof Comparative Pathology,1921,34:59-191.
[3]Nix R J,Gallardo C,Hutchings G,et al.Molecular epidemiology of African swine fever virus studied by analysis offour variable ge⁃nome regions[J].Archives ofVirology,2006,151:2475-2494.
[4]Sanchez-Vizcaino J M,Mur L,Martine-Lopez B.African swine fe⁃ver:an epidemiologic update[J].Transboundary and Emerging Disease,2012,59:1-9.
[5]http://web.oie.int/wahis/public.php.
[6]Gomez-Puertas P,Rodriguez F,Oviedo J M,et al.The African swine fever virus proteins p54 and p30 are involved in two dis⁃tinctsteps ofvirus attachmentand both contribute to the antibodymediated protective immune response[J].Virology,1998,243:461-471.
[7]Gutierrez-Castaneda B,Reis A L,Corteyn A,et al.Expression,cellular localization and antibody responses of the African swine fever virus genes B602L and K205R[J].Archives of Virology,2008,153:2303-2306.
[8]Borca M V,Irusta P M,Kutish G F,et al.A structural DNA bind⁃ing protein of African swine fever virus with similarity to bacterial histone-like proteins[J].Archives of Virology,1996,141:301-313.
[9]OIE.African swine fever.In:Manual of Diagnostic Tests and Vac⁃cines for Terrestrial Animals[M].Office International des Epizo⁃oties Paris France(Chapter 2.8.1,NB:version adopted in May 2012).
[10]Gallardo C,Blanco E,Rodriguez M J,et al.Antigenic properties and diognostic potential of Afican swine fever virus protein pp62 expressed in insect cells[J].Journal of Clinical Microbiology,2006,44(3):1489-1495.
[11]Gallardo C,Reis A L,Kalema-Zikusoka G,et al.Recombinant Antigen Targets for Serodiagnosis of African Swine Fever[J].Clini⁃caland Vaccine Immunology,2009,1012-1020.

