负向调控miR-9抑制鼻咽癌细胞的增殖、迁移和侵袭*
郑朝攀, 韩 灵, 侯伟坚, 文译辉, 傅 然, 文卫平
(中山大学附属第一医院耳鼻咽喉科医院,中山大学耳鼻咽喉科学研究所,广东 广州 510080)
鼻咽癌是我国华南地区高发病率恶性肿瘤;虽然早期鼻咽癌放射治疗效果良好,但鼻咽癌的复发、转移以及对放化疗抵抗等问题降低了生存率[1]。既往研究中,miR-9参与了多种肿瘤的恶性生物过程和恶性特质[2]。我们也在鼻咽癌的相关研究中发现负向调控miR-9能够促进肿瘤细胞对紫外线介导的活性氧损伤[3];但是和鼻咽癌预后密切相关的增殖和转移等相关研究有待完善。本实验通过转染miR-9抑制剂下调鼻咽癌肿瘤细胞中miR-9表达,观察了肿瘤增殖、迁移以及侵袭的变化,并初步探讨其相关作用机制。
材 料 和 方 法
1 材料
人鼻咽癌细胞系CNE2(低分化肿瘤细胞)和CNE1(高分化肿瘤细胞)为研究对象。肿瘤细胞通过应用LipofectamineTM2000进行转染处理,并按照miR-9抑制组和miR-9抑制对照组进行分组。miR-9抑制剂与抑制对照剂均由上海吉玛公司合成。LipofectamineTM2000 (Invitrogen)。miR-9抑制剂序列为5’- ucauacagcuagauaaccaaaga-3’;抑制对照剂序列为5’- caguacuuuuguguaguacaa -3’。RPMI-1640培养基和胎牛血清(HyClone);CCK-8 检测试剂(同仁生物化工有限公司);PI周期试剂盒(凯基生物有限公司);Transwell侵袭小室(Corning)。上皮性钙黏附蛋白(E-cadherin)、β-连环蛋白(β-catenin)和GAPDH抗体分别为Boster和Santa Cruze产品。其它试剂为国产试剂。
2 方法
2.1细胞培养和转染 细胞均置于37 ℃含5%CO2湿饱和的培养箱中,应用10%FBS RPMI-1640培养基进行培养;当细胞浓度达到70%~80%时给予消化传代。在细胞进行转染过程中,当细胞密度达到30%~50%时,应用脂质体LipofectamineTM2000进行转染,分为抑制组和对照组(按照使用说明,转染浓度为25 nmol/L进行转染)。转染后4 h后更换新培养液,继续培养以用于后续实验。
2.2CCK-8检测细胞增殖 肿瘤细胞转染4 h后,重悬细胞。取96孔板,设6个复孔,调整每孔细胞的浓度为1×108cells/L,连续培养72 h;分别在转染培养24 h、48 h、72 h后,更换培养液,每孔10 μL CCK-8 与 90 μL含10%FBS的RPMI-1640培养液;培养箱内孵育 1 h,用多功能酶标仪测定在 450 nm波长的吸光度(A)。
2.3流式细胞术检测细胞周期 肿瘤细胞转染48 h后,收集转染肿瘤细胞,70%乙醇固定1 h,RNA酶消化0.5 h后给予碘化丙啶染色,流式细胞术检测细胞周期变化。
2.4细胞划痕实验和侵袭实验 划痕实验为在肿瘤细胞转染48 h、培养细胞单层长满达90%后,10 μL枪头划线,更换无血清RPMI-1640培养液孵育24 h,并分别在0 h、24 h观察照相;然后根据划痕间垂直直线距离,随机取10组数据,进行分析。侵袭实验用无血清RPMI-1640培养液重悬细胞,接种于martrigel包被的Transwell小室内,外槽加入含5%血清培养基。12 h后,棉签蘸去上层的细胞,用DAPI染核;荧光显微镜检测细胞,随机选取10×20镜下5个视野,并计数。
2.5免疫印迹实验和免疫荧光实验 肿瘤细胞转染48 h后,提取总蛋白;常规电泳,半干转膜,封闭,给予E-cadherin、β-catenin和GAPDH抗体4 ℃孵育过夜,加入对应的辣根过氧化物酶标记的Ⅱ抗常温孵育1 h后,滴加ECL发光液,胶片显影,定影。ImageJ软件分析各蛋白条带的灰度值。以GAPDH蛋白表达为内参照,以目的蛋白和GAPDH条带灰度值的比值表示目的蛋白的相对含量,进行分析。
3 统计学处理
应用SPSS 13.0统计软件分析,数据用均数±标准差(mean±SD)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 负向调控miR-9抑制鼻咽癌细胞的增殖
CNE1细胞转染72 h后, 转染抑制组与对照组细胞比较,A值存在显著差异(P<0.05);而CNE2细胞在转染48 h和72 h后2组均存在A值显著差异(P<0.01;P<0.05),见图1。结果表明负向调控miR-9表达抑制了不同分化鼻咽癌细胞的增殖。

Figure 1. Changes of cell proliferation were tested with CCK-8 after miR-9 expression was inhibited.A: CNE2 cells; B: CNE1 cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs control.
2 负向调控miR-9阻滞鼻咽癌细胞在G0/G1期分布
经PI染色法流式细胞术检测,在鼻咽癌CNE2细胞转染48 h后,miR-9抑制组中G0/G1期细胞比例为(57.96±1.39)%,比对照组细胞[(47.93±1.76)%]明显增加(P<0.05);而S期和G2期细胞比例[S期: (31.27±3.56)%;G2期: (20.79±3.85)%]与对照组[S期: (32.72±1.17)%;G2期: (16.70±4.19)%]无显著差异。CNE1细胞中,miR-9抑制组肿瘤细胞中处于G0/G1期的细胞数较对照组亦增多[(51.24±0.88)%vs(48.29±0.39)%,P<0.05],S期和G2期细胞比例与对照组比较无显著差异,见图2。抑制不同分化鼻咽癌细胞miR-9表达,可阻滞肿瘤细胞于G0/G1期,抑制了肿瘤细胞的增殖。

Figure 2. Changes of cell cycle after miR-9 expression was inhibited.Mean±SD. n=3. *P<0.05 vs CNE2-control;#P<0.05 vs CNE1-control.
3 负向调控miR-9对鼻咽癌细胞迁移和侵袭作用
划痕实验提示,抑制鼻咽癌细胞miR-9表达后,miR-9抑制组较对照组迁移距离明显缩短。CNE2细胞:抑制组细胞迁移距离为(186.50±7.94)μm,对照组为(247.56±15.56)μm, 差异显著(P<0.05);CNE1细胞:抑制组和对照组分别为(139.06±16.73)μm和(230.66±14.27)μm, 差异显著(P<0.01);见图3A。Transwell侵袭实验中, CNE2细胞抑制miR-9表达组较对照组降解基质和侵袭的细胞数明显减少(43.00±3.17vs65.80±5.20,P<0.01);而CNE1细胞抑制miR-9表达后,虽然抑制组较对照组侵袭细胞数降低,但两者无明显差异(54.60±2.60vs63.00±3.53,P>0.05),见图3B。
4 负向调控miR-9对β-catenin和E-cadherin表达的影响
免疫印迹实验表明抑制CNE2细胞miR-9表达后, E-cadherin水平增加,并伴有β-catenin含量降低;CNE1细胞抑制组E-cadherin水平与对照组比无明显差异,但β-catenin水平降低,差异显著,见图4。

Figure 3. Changes of the abilities of migration (A) and invasion (B) after miR-9 expression was inhibited. Mean±SD. n=10. *P<0.05, **P<0.01 vs control.
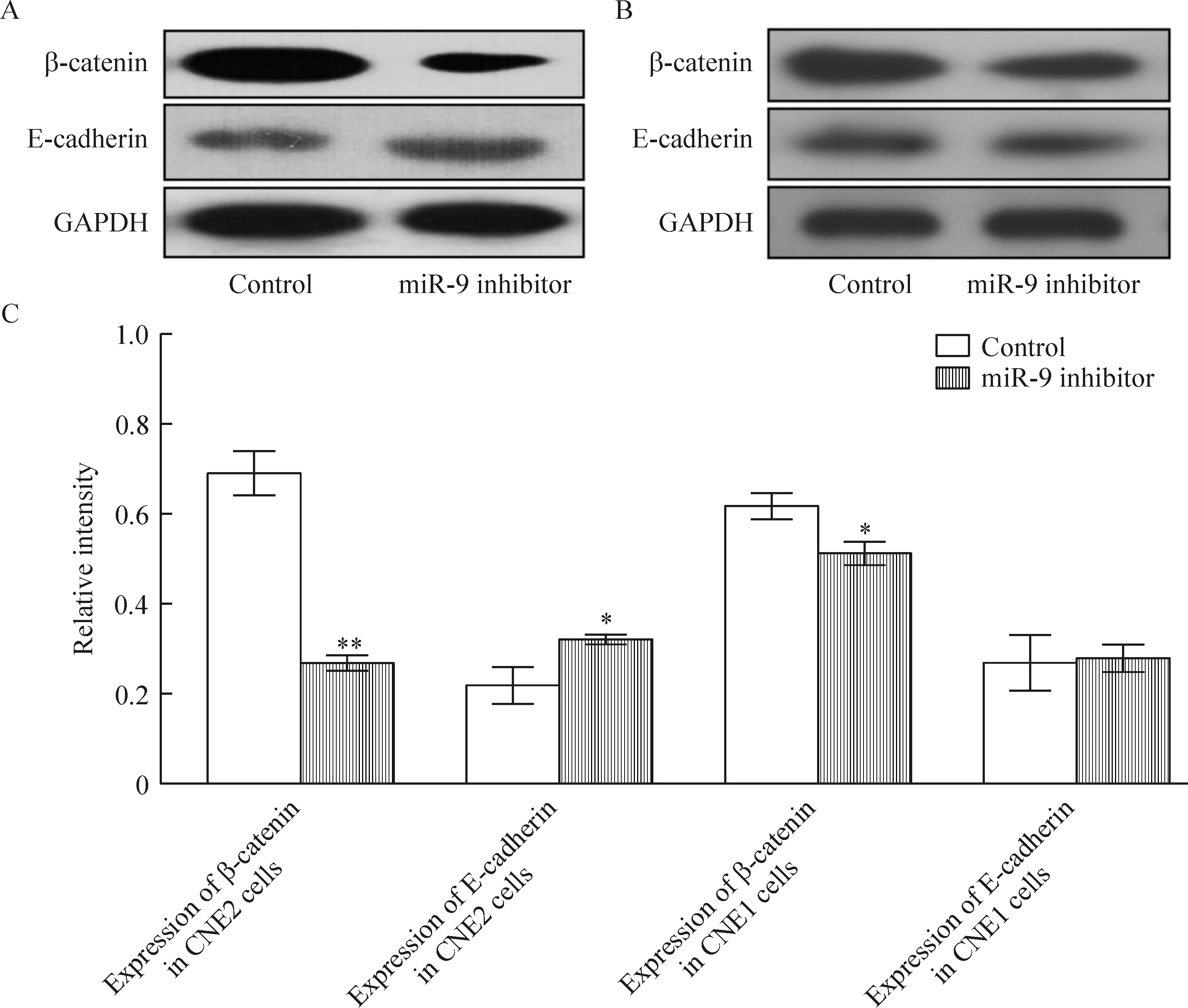
Figure 4. Changes of the expression of β-catenin and E-cadherin after miR-9 expression was inhibited.A: expression of β-catenin and E-cadherin in CNE2 cells; B: expression of β-catenin and E-cadherin in CNE1 cells; C:relative intensity of expression of β-catenin and E-cadherin in different cells. Mean±SD. n=3.*P<0.05, **P<0.01 vs control.
讨 论
通过研究miRNA相关机制揭示肿瘤恶性生物特征以及各种治疗抵抗等是研究肿瘤的热点;在鼻咽癌细胞中,通过观察肿瘤细胞放疗后miRNA的差异表达可以作为研究鼻咽癌放疗抵抗的切入点[3-4]。miR-9在不同的肿瘤细胞中异常表达决定了其和肿瘤关系密切。在霍奇金淋巴瘤、乳腺癌细胞、神经源性肿瘤等细胞中,miR-9促进肿瘤增殖;但在卵巢癌、黑色素瘤等肿瘤细胞中,miR-9则抑制了细胞的增殖和转移[2,5-6]。虽然我们既往发现miR-9能够调节鼻咽癌细胞对紫外线介导的活性氧损伤,但是其对增殖和转移等相关研究有待深入。
在鼻咽癌的相关研究中,Wang等[7]和Song等[8]指出β-catenin可以作为鼻咽癌细胞治疗与预后的一个重要指标。miR-200a、let-7和miR-26等均可通过不同的作用靶基因发挥调节鼻咽癌细胞增殖的作用[9-11]。Xia等[10]在miR-200a研究中指出,miR-200a对CNE1细胞增殖的抑制作用主要通过对β-catenin的抑制而发挥作用,但是在C666细胞中却发挥截然相反的作用。Lu等[9]则通过过表达miR-26延长G1期细胞比例,抑制了肿瘤细胞的增殖与克隆形成。本实验中,抑制miR-9表达后,不同分化程度的鼻咽癌细胞均阻滞肿瘤细胞于G0/G1期,并抑制了肿瘤细胞增殖。虽然负向调控miR-9后β-catenin表达变化机制未能明确,miR-9调节E-cadherin表达后相关上皮-间质转化过程以及β-catenin的相应变化可能是重要因素[12]。结果表明抑制miR-9表达后,鼻咽癌细胞中β-catenin水平显著降低其与抑制肿瘤细胞的增殖变化密切相关。
鼻咽癌侵袭和远处转移是影响预后的重要因素。作为重要的黏附蛋白,E-cadherin与多种肿瘤的转移、放疗以及预后关系密切[13-14];同时通过抑制其表达可促进鼻咽癌细胞的侵袭和转移能力[15]。鼻咽癌细胞中,miR-200a通过调控E-cadherin的转录抑制因子锌指E盒结合同源盒蛋白2(zinc-finger E-box binding homeobox 2,ZEB2),促进了肿瘤细胞侵袭和迁移[10]。Ma等[12]指出miR-9直接抑制E-cadherin表达明显促进肿瘤细胞的转移和侵袭能力。实验中,CNE2细胞中抑制miR-9表达促进E-cadherin含量增加,而CNE1细胞中E-cadherin表达变化对于miR-9负向调控后无明显变化;因此对应的肿瘤细胞中侵袭细胞数出现变化,但迁移能力均明显受到抑制。实验结果表明,E-cadherin的变化是miR-9调节鼻咽癌肿瘤细胞侵袭和迁移能力的关键蛋白。
本实验通过负向调控鼻咽癌细胞中miR-9表达抑制了肿瘤细胞的增殖、侵袭和迁移,提示miR-9可能与鼻咽癌细胞的增殖、恶性转化和预后密切相关。结合miR-9对于放疗相关的活性氧的调节作用,miR-9可能作为鼻咽癌治疗研究的新靶点,需要我们进一步关注和深入。
[参 考 文 献]
[1] Wei WI, Sham JS. Nasopharyngeal carcinoma[J]. Lancet,2005,365(9476): 2041-2054.
[2] Yuva-Aydemir Y, Simkin A, Gascon E, et al. MicroRNA-9: Functional evolution of a conserved small regulatory RNA[J]. RNA Biol, 2011, 8(4):557-564.
[3] Zheng CP, Han L, Hou WJ, et al. Inhibition of micro-RNA-9 expression promotes UV-induced ROS damage in nasopharyngeal carcinoma cells[J]. Zhong hua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi, 2013, 48(8): 668-672.
[4] 王旭丹,杨惠玲,郭禹标,等.不同辐射抗拒鼻咽癌细胞微小RNA差异表达的研究[J].中国病理生理杂志,2007, 23(6): 1045-1048.
[5] Rotkrua P, Akiyama Y, Hashimoto Y, et al. MiR-9 downregulates CDX2 expression in gastric cancer cells[J]. Int J Cancer, 2011,129(11):2611-2620.
[6] Guo LM, Pu Y, Han Z, et al. MicroRNA-9 inhibits ovarian cancer cell growth through regulation of NF-kappaB1[J]. FEBS J, 2009, 276(19): 5537-5546.
[7] Wang ZP, Chen YR, Zheng RL, et al. Effects of reactive oxygen species on lymphokine-activated killer cells in patients with bladder cancer[J]. Acta Pharmacol Sin, 2002, 23(3): 257-262.
[8] Song LB, Zeng MS, Liao WT, et al. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells[J]. Cancer Res, 2006, 66(12): 6225-6232.
[9] Lu J, He ML, Wang L, et al. MiR-26a inhibits cell growth and tumorigenesis of nasopharyngeal carcinoma through repression of EZH2[J]. Cancer Res, 2011, 71(1): 225-233.
[10] Xia H, Ng SS, Jiang S, et al. miR-200a-mediated downregulation of ZEB2 and CTNNB1 differentially inhibits nasopharyngeal carcinoma cell growth, migration and invasion[J]. Biochem Biophys Res Commun, 2010, 391(1): 535-541.
[11] Wong TS, Man OY, Tsang CM, et al. MicroRNA let-7 suppresses nasopharyngeal carcinoma cells proliferation through downregulating c-Myc expression[J]. J Cancer Res Clin Oncol, 2011, 137(3): 415-422.
[12] Ma L, Young J, Prabhala H, et al. miR-9, a MYC/MYCN-activated microRNA, regulates E-cadherin and cancer metastasis[J]. Nat Cell Biol, 2010, 12(3): 247-256.
[13] 唐克晶,饶 青,孟继虹,等. E-cadherin表达缺失在白血病细胞行为中的作用[J].中国病理生理杂志,2009, 25(3): 489-492.
[14] Xie LQ, Bian LJ, Li Z, et al. Altered expression of E-cadherin by hepatocyte growth factor and effect on the prognosis of nasopharyngeal carcinoma[J]. Ann Surg Oncol, 2010, 17(7): 1927-1936.
[15] Huang GW, Mo WN, Kuang GQ, et al. Expression of p16, nm23-H1, E-cadherin, and CD44 gene products and their significance in nasopharyngeal carcinoma[J]. Laryngoscope, 2001, 111(8): 1465-1471.

