自动固相微萃取-气相色谱-质谱法测定食品接触材料中多环芳烃(PAHs)的迁移量
李 英,李成发,白 爽,孙小颖,梁 烽,陈麒宇,李 彬,陈旭辉,李泳涛,廖文忠
(深圳出入境检验检疫局,广东 深圳 518067)
多环芳烃(PAHs)是指由2个或2个以上苯环,以线状、角状或簇状排列的化合物,其脂溶性高、不易降解、易在生物体内积累,具有致癌、致畸、致突变性,且致癌性随着苯环数的增加而加大,对生态环境和人体健康具有巨大的潜在危害,已被世界各国列为优先控制的环境污染物[1-2]。目前,对于大气、水、土壤、沉积物、植物等环境样品和熏肉、牛奶、茶叶、食用油脂等食品中多环芳烃的测定已有大量报道[3-10]。食品接触材料作为与食品相关联的产品,其安全卫生问题已受到广泛关注,美国环保署、《德国食品和商品法》、德国联邦的工作用技术设备与消费品委员会(AtAV)等均对食品接触材料中的PAHs有强制要求。因此,建立食品接触材料中PAHs的分析方法,对保证食品质量、维护食品安全体系具有重要意义。
目前,PAHs的前处理方法主要有液-液提取法、索氏提取法、超声波提取法、固相萃取法、超临界流体提取法、微波萃取法、快速溶剂萃取法、固相微萃取(SPME)法等[3-17]。固相微萃取是20世纪90年代初发展起来的一种集萃取、富集、解析为一体的样品前处理技术[18],具有不需任何有机溶剂、操作简单、灵敏度高等特点,已广泛应用于食品分析、化学分析等各个领域。食品接触材料,尤其是塑胶和纸质食品接触材料的基体复杂,在生产及后续的加工过程中会添加大量的助剂,如增塑剂、抗氧化剂、防腐剂、着色剂等,同时还可能存在各种残留单体。本工作建立SPME与GC/MS联用方法,采用选择离子监测(SIM)及分段扫描方式测定食品接触材料模拟物中的PAHs,旨在为食品接触材料的生产质量控制和安全监督检测提供技术支持。
1 实验部分
1.1 主要仪器与装置
Agilent7890A-5975C气相色谱-质谱联用仪:美国Agilent公司产品,配有CTC Combi PAL自动进样器;DELTA320A pH计:瑞士Mettler公司产品;Milli-Q超纯水器:美国Millipore公司产品。
1.2 主要材料与试剂
16种PAHs混合标准溶液(甲醇介质,100 mg/L):美国 Supelco公司产品;甲醇(色谱纯):中国医药集团公司上海化学试剂公司产品;冰乙酸、氢氧化钠(分析纯):广州化学试剂厂产品;氯化钠、无水乙醇(分析纯):国药集团化学试剂有限公司产品;100 μm聚二甲基硅氧烷(PDMS)萃取头:加拿大Supelco公司产品;Milli-Q超纯水;质量浓度为3%乙酸溶液和10%氢氧化钠溶液:实验室自制。
1.3 实验条件
1.3.1色谱条件 色谱柱: HP-5MS(30 m×0.25 mm×0.25 μm);程序升温:初始温度60 ℃,以10 ℃/min升至260 ℃,再以2 ℃/min升至280 ℃,保持10 min;进样口温度280 ℃;载气:高纯He,纯度大于99.999%;载气流速1.0 mL/min;不分流进样。
1.3.2质谱条件 电子轰击(EI)离子源;电子能量70 eV;传输线温度280 ℃;四极杆温度150 ℃;离子源温度230 ℃;溶剂延迟6.5 min;质量扫描范围m/z50~650;采用分段选择离子的方式(SIM)进行定量分析,选择离子具体条件列于表1。
1.4 实验方法
1.4.1标准溶液的配制 分别准确移取适量PAHs混合标准溶液,用甲醇配制成浓度约为20 mg/L标准储备液。使用时,再用相应的模拟物稀释至所需浓度,置于4 ℃冰箱中保存。
1.4.2前处理方法 3%乙酸模拟液应按照GB/T 23296.1—2009《食品接触材料 塑料中受限物质 塑料中物质向食品及食品模拟物待定迁移试验和含量测定方法以及食品模拟物暴露条件选择的指南》中的要求从迁移试验中获取,在4 ℃冰箱中,避光保存。
1.4.3固相微萃取方法 按1.4.2方法,将3%乙酸模拟液先用10%氢氧化钠溶液调节至pH 6.8,准确移取18 mL该溶液,立即盖上瓶盖;将SPME萃取纤维插入萃取瓶内,并完全浸入溶液中,萃取针套管的其他部分不要与水相接触;在45 ℃振荡状态下(振荡速度为250 r/min)萃取30 min后,迅速插入GC/MS进样口,250 ℃解吸4 min。

表1 SIM选择离子条件Table 1 Conditions of selected ion monitor
2 结果与讨论
2.1 16种多环芳烃色谱图
按1.4.3方法进行萃取,在1.3.1条件下,16种多环芳烃能被很好的萃取和分离,其色谱图示于图1。
2.2 萃取条件的优化
2.2.1萃取头的选择 SPME遵循相似相溶原理,即待分析物在涂层和样品之间的分配平衡。由于PAHs 属于非极性化合物,而PDMS纤维更容易吸附非极性物质,因此本实验选用100 μm PDMS萃取涂层。
2.2.2解吸时间的选择 在同一温度下,待测物解吸程度与解吸时间直接相关。按照1.4.3方法对5 μg/L多环芳烃混合标准溶液进行萃取,然后在280 ℃下解吸3 min后,再将该萃取头进行第2次热解吸,仍有部分待测物峰出现。将解吸时间设置为4 min,按同样的方法,可以发现,此时的萃取头在第2次热解吸时未见色谱峰出现,证明已被解吸完全。因此,本实验选择4 min为最佳解吸时间。
2.2.3pH值的选择 3%乙酸溶液和水的pH值分别为2.7和6.8,因此,用10%氢氧化钠溶液将2份3%乙酸溶液分别调节pH值至5和6.8;取3个100 mL容量瓶,均加入25 μL 20 mg/L PAHs甲醇溶液,分别用pH 5、pH 6.8、pH 2.7的3%乙酸溶液定容至刻度,按1.4.3方法进行测定,结果示于图2。实验表明:1~8#组分随着pH值的减小,峰面积变小;9~10#组分的峰面积在不同pH值时无明显差异;而11~16#号组分则随着pH值的减小,峰面积变大。考虑到pH值对组分的总体影响并不十分明显,而且PDMS萃取涂层直接浸没在pH值小于4的溶液中会影响寿命,因此最终采用pH 6.8来进行测定实验。
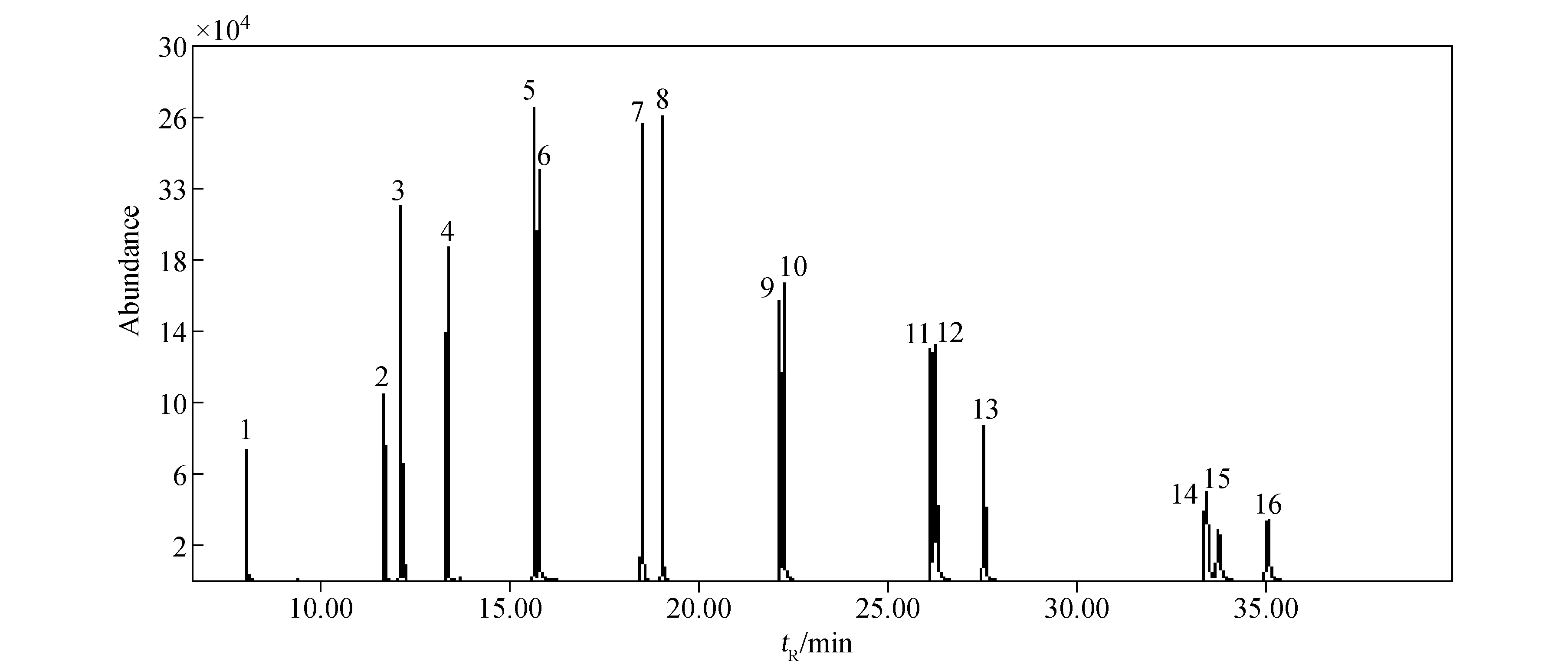
注:1.萘;2.苊烯;3.苊;4.芴;5.菲;6.蒽;7.荧蒽;8.芘;9.苯并[a]蒽;10.屈;11.苯并[b]荧蒽;12.苯并[k]荧蒽;13.苯并[a]芘;14.茚并[1,2,3-cd]芘;15.二苯并[a,h]蒽;16.苯并[g,h,i]芘图1 16种多环芳烃的选择离子流色谱图Fig.1 Selected ion monitor chromatograms of 16 PAHs

图2 pH值对16种多环芳烃萃取量的影响Fig.2 Effect of pH on the adsorption of 16 PAHs
2.2.4萃取时间的选择 固相微萃取是一个富集平衡的过程,选择一个优化的萃取时间是建立该方法的关键步骤之一。在其他条件相同的情况下,进行萃取时间的优化实验,结果发现:随着萃取时间的增加,1#组分的峰面积基本不变;2~4#组分随萃取时间的变化较大,但20 min后峰面积基本保持恒定;5~6#、14~16#组分在30 min后峰面积增大趋势明显变缓;7~13#组分则随着萃取时间的增加,峰面积一直呈现明显上升的趋势,60 min时仍未达到平衡。根据Ai等[19]提出的平衡和非平衡萃取理论,在非平衡状态下也可以进行定量分析,尤其是对于沸点较高的非极性和弱极性目标分析物,应选择在非平衡态下萃取,但此时的萃取时间和传质条件(如温度、搅拌速度等)必须严格控制[20]。本实验最终选择的萃取时间为30 min。
2.2.5萃取温度的选择 温度升高可以加大待分析物的扩散系数,增加待分析物向涂层纤维的传质速率,有利于提高萃取效率,缩短萃取达到平衡的时间,但因为萃取过程是放热的,所以同时又会减少待测物在涂层和液相间的分配系数。在其他条件相同的情况下,测定了不同萃取温度下16种多环芳烃的萃取量,结果发现:随着温度的升高,1~4#组分的萃取量明显减小;5~6#组分的峰面积随着温度的升高而有所增加,但在55 ℃以后峰面积却随着温度的升高而降低;7~16#组分随着温度的升高,萃取量明显增大。综合考虑温度对16种多环芳烃萃取量的影响,最终选择萃取温度为45 ℃。
2.2.6振荡速度的选择 搅拌有助于样品与涂层间的传质,从而缩短达到平衡的时间,振荡是搅拌的方式之一。本实验考察了不同振荡速度对萃取效率的影响,结果示于图3。不振荡时,待测物的峰面积最小;振荡速度为250 r/min时,待测物的吸附量明显增加;但随着振荡速度增加至500 r/min,吸附量只略有增加;振荡速度为750 r/min时,吸附量反而稍有降低。考虑增加振荡速度会给针和纤维涂层带来过量的压力,故选择振荡速度为250 r/min。
2.2.7离子强度的优化 在水性模拟液中加盐可以改变溶液中相界面的性质,影响分配系数,同时会增加水性模拟液中的离子强度,降低有机物在水中的溶解度,起到盐析作用,有利于待测物在涂层中的萃取。但加盐,尤其是高浓度盐,可能会使盐在萃取头沉积或者堵塞毛细管,且易出现干扰峰。本实验选择不加盐和添加0、5%、10%、20%等4种不同情况来考察离子强度对16种多环芳烃萃取效率的影响。结果表明:1~8#组分随着离子强度的增加峰面积增大;而9~16#组分则与之相反,即随着离子强度的增加峰面积反而减小。考虑到酸性模拟液中后8个峰的响应相对较低,同时也为了操作简便、保护萃取头及色谱柱等,最终选择不加盐。
2.3 方法的线性范围和检出限
将多环芳烃标准储备液用3%乙酸溶液逐级稀释,配制成浓度为0、0.01、0.02、0.05、0.1、0.2、0.5、1.0、2.0、5.0 μg/L多环芳烃标准系列工作溶液。在优化的实验条件下进行分析,以浓度x为横坐标,峰面积y为纵坐标,绘制标准曲线。结果表明,在0.01~5 μg/L范围内,多环芳烃的质量浓度与相应的峰面积比值呈良好的线性关系,相关系数在0.997 9~0.999 7之间。
2.4 精密度及回收率实验
用浓度分别为0.1、0.5、1.0 μg/L加标样品溶液进行精密度实验(n=5),16种多环芳烃的相对标准偏差在2.72%~14.70%之间。结果表明,在优化的实验条件下,方法的重现性良好。
选择丙烯腈-苯乙烯量杯(浸泡条件为:温度60 ℃,时间0.5 h)、硅橡胶压面棒(浸泡条件为:温度60 ℃,时间0.5 h)、筷子(浸泡条件为:温度95 ℃,时间0.5 h)3种实际样品,按照1.4.2方法进行前处理,得到相应的模拟液。在优化的萃取条件下,同一浓度的模拟液中分别加入不同浓度的标准溶液,测得水模拟物和3%乙酸模拟物中16种多环芳烃的回收率均在 73.47%~117.6% 之间。
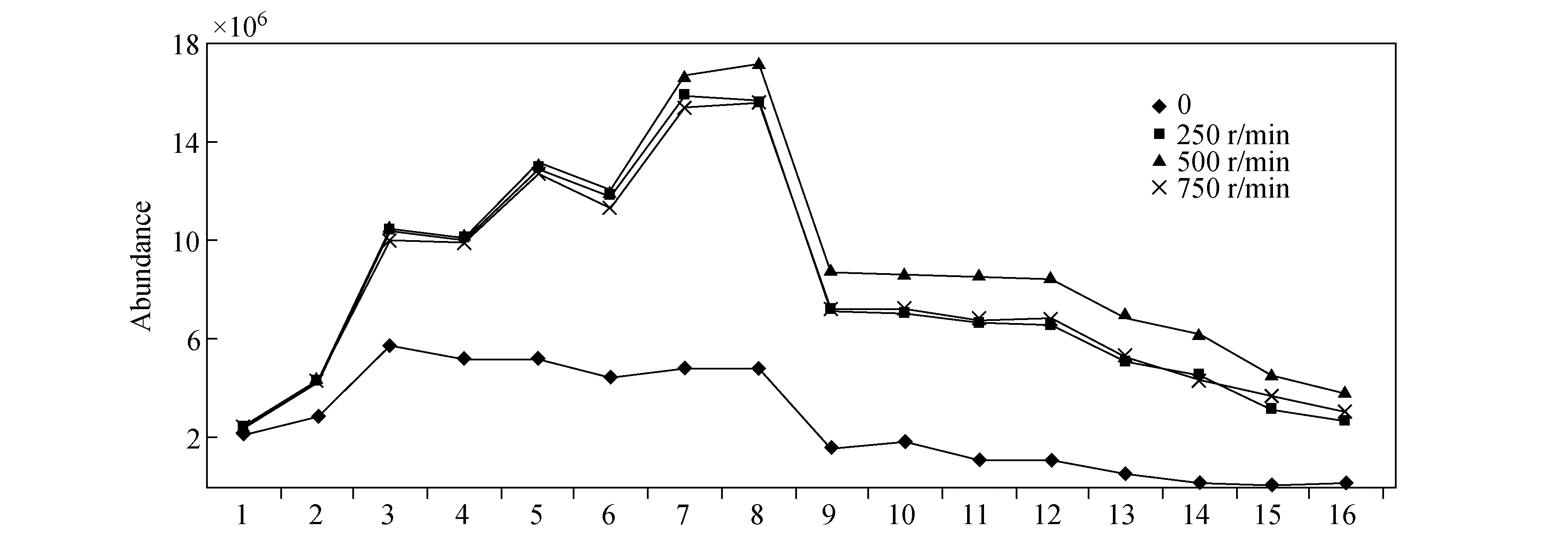
图3 振荡速度对萃取效率的影响Fig.3 Effect of stirring rate on SPME extraction efficiency
2.5 实际样品的分析
按照1.4.2前处理方法、1.3分析条件及1.4.3固相微萃取方法对塑料、橡胶和木制品等35批实际食品接触材料样品进行检测。测定结果表明,除4批木制品检出萘组分外,其余样品均未检出16种多环芳烃。4批阳性样品均为涂有油漆的木制品,萘的含量在1.19~9.97 μg/L范围内。
3 结论
采用固相微萃取技术,通过对SPME纤维头、萃取温度、萃取时间及解吸时间等萃取条件和GC/MS色谱条件进行优化,建立了一种固相微萃取-气相色谱-质谱联用(SPME-GC/MS)测定食品接触材料中多环芳烃迁移量的分析方法。该方法操作简单、快速、灵敏、且不需要有机溶剂,可大大简化样品前处理步骤,提高检测效率,能实现绿色检测,从而满足快速检测的需要。
参考文献:
[1] 杨若明.环境中有毒有害化学物质的污染与监测[M]. 北京:中央民族大学出版社, 2001:21-178.
[2] 肖海清,王 星,王 超,等.气相色谱-质谱法测定塑料制品中多环芳烃[J].理化检验-化学分册,2009,45(2):187-189.
XIAO Haiqing, WANG Xing, WANG Chao, et al. GC-MS determination of polycyclic aromatic hydrocarbons in plastics[J]. Ptca (Part B: Chem. Anal), 2009,45(2):187-189(in Chinese).
[3] 宋冠群,林金明.环境样品中多环芳烃的前处理技术[J].环境科学学报,2005,25(10):1 287-1 296.
SONG Guanqun, LIN Jinming. Sample pretreatment techniques for polycyclic aromatic hydrocarbons in environmental matrix[J]. Acta Scientiae Circumstantiae, 2005, 25(10):1 287-1 296(in Chinese).
[4] 孟凡生,陈 晶,王业耀.环境中多环芳烃前处理和分析方法[J].环境监控与预警,2011,3(1):12-16.
MENG Fansheng, CHEN Jing, WANG Yeyao. Review of pretreatment and analysis methods of polycyclic aromatic hydrocarbons (PAHs) in the environment[J]. Environmental Monitoring and Forewarning, 2011,3(1):12-16(in Chinese).
[5] 赵文昌,程金平,谢 海,等.环境中多环芳烃(PAHs)的来源与监测分析方法[J].环境科学与技术,2006,29(3):105-107.
ZHAO Wenchang, CHENG Jinping, XIE Hai, et al. PAHs sources pathway and their monitoring ang analysis[J]. Environmental Science and Technology, 2006, 29(3):105-107(in Chinese).
[6] 李永新,张 宏,毛丽莎,等.气相色谱/质谱法测定熏肉中的多环芳烃[J].色谱,2003,21(5):476-479.
LI Yongxin, ZHANG Hong, MAO Lisha, et al. Determination of polycyclic aromatic hydrocarbons in smoked meat by gas chromatography/mass spectrometry[J]. Chinese Journal of Chromatography, 2003, 21(5): 476-479(in Chinese).
[7] 陈代武,王 芳,蒙松年,等.微波辅助-固相微萃取联用技术萃取腊肉中多环芳烃的研究[J]. 食品工业科技,2008,29(6):197-199.
CHEN Daiwu, WANG Fang, MENG Songnian, et al. Study on extraction of polycyciic aromatic hydrocarbons from smoked meat by MAE-SPME[J]. Science and Technology of Food Industry, 2008,29(6):197-199(in Chinese).
[8] NEREA A, NATALIA C, PILAR V, et al. Determination of 16 polycyclic aromatic hydrocarbons in milk and related products using solid-phase microextraction coupled to gas chromatography-mass spectrometry[J]. Analytica Chimica Acta, 2007, 596(2): 285-290.
[9] ISHIZAKI A, SAITO K, HANIOKA N, et al. Determination of polycyclic aromatic hydrocarbons in food samples by automated on-line in-tube solid-phase microextraction coupled with high-performance liquid chromatography-fluorescence detection[J]. Journal of Chromatography A, 2010, 1 217 (35): 5 555-5 563.
[10] 俞 晔,金青哲,刘海珍,等. 食用油脂中多环芳烃检测的前处理技术研究进展[J].中国油脂,2011,36(7):1-4.
YU Ye, JIN Qingzhe, LIU Haizhen, et al. Review on sample pretreatment techniques for determination of polycyclic aromatic hydrocarbons in edible oils[J]. China Oils and Fats, 2011,36(7):1-4(in Chinese).
[11] 陶敬奇,王超英,李碧芳,等.固相微萃取-高效液相色谱联用分析环境水样中的痕量多环芳烃[J].色谱,2003,21(6):599-602.
TAO Jingqi, WANG Chaoying, LI Bifang, et al. Determination of trace polycyclic aromatic hydrocarbons in environmental waters by solid-phase microextraction coupled with high performance liquid chromatography[J]. Chinese Journal of Chromatography, 2003,21(6):599-602(in Chinese).
[12] 罗世霞,朱淮武,张笑一.固相微萃取-气相色谱法联用分析饮用水源水中的16种多环芳烃[J].农业环境科学学报, 2008,27(1):395-400.
LUO Shixia, ZHU Huaiwu, ZHANG Xiaoyi. Solid-phase microextraction coupled with gas chromatography for the analysis of 16 polycyclic aromatic hydrocarbons in drinking water sources[J]. Journal of Agro-Environment Science, 2008, 27(1):395-400(in Chinese).
[13] CHENG S, YONGQIANG L, YONGHUA W, et al. Determination of 16 polycyclic aromatic hydrocarbons in water using fluorinated polyaniline-based solid-phase microextraction coupled with gas chromatography[J]. Environmental Monitoring and Assessment, 2012, 184(7): 4 345-4 353.
[14] RIANAWATI E, BALASUBRAMANIAN R. An
aniline-based fiber coating for solid phase microextraction of polycyclic aromatic hydrocarbons from water followed by gas chromatography-mass spectrometry[J]. Physics and Chemistry of the Earth, 2009, 34 (13/16): 857-865.
[15] POON K F, LAM P K S, LAM M HW. Deternination of polynuclear aromatic hydrocarbons in human blood serum by proteolytic digestion-direct immersion SPME[J]. Analytica Chimica Acta, 1999, 396(2/3):303-308.
[16] VAZ J M. Screening direct analysis of PAHS in atmospheric particulate matter with SPME[J]. Talanta, 2003,60(4):687-693.
[17] RIANAWATE E, BALASUBRAMANIAN R. Optimization and validation of solid phase micro-extraction (SPME) method for analysis of polycyclic aromatic hydrocarbons in rainwater and stormwater[J]. Physics and Chemistry of the Earth, 2009, 34(13/14/15/16):857-865.
[18] ARTHUR C L, PAWLISZYN J. Solid-phase mi-
croextraction with thermal desorption using fused silica optical fibers[J]. Anal Chem, 1990, 62(19): 2 145-2 148.
[19] AI J. Solid phase microexaction for quantitative analysis in nonequilibrium situations[J]. Anal Chem, 1997,69(16):3 260-3 266.
[20] 吴采樱. 固相微萃取[M].北京:化学工业出版社,2012:118.

