超高效液相色谱-串联质谱法测定豆芽中7种药物残留
刘春生,罗海英,冼燕萍,王 斌,王 莉,罗东辉,郭新东
(广州质量监督检测研究院,国家加工食品质量监督检验中心(广州),广州市食品安全检测技术重点实验室,广州市食品安全风险动态监测与预警研究中心,广东 广州 510110)
豆芽是人们喜食的一种传统的物美价廉的蔬菜。但是,近年来“问题豆芽”事件频频曝光,一些豆芽生产作坊为了牟取最大利润,使用国家明令禁止的植物生长激素、抗生素、杀菌剂等药物,以达到缩短生长周期、增加产量、降低成本、使豆芽色泽鲜亮和延长保鲜期等目的。媒体报导的非法添加的药物一般有6-苄氨基嘌呤、赤霉酸和对氯苯氧乙酸等植物生长促进剂,头孢类和喹诺酮类抗生素,咪鲜胺等广谱杀菌剂。此外,2,4-二氯苯氧乙酸也是一种常用的植物生长素,但其具有急性神经毒性,对肾脏有损害,NY 5317—2006《无公害食品 芽类蔬菜》[1]中规定其限量值为0.1 mg/kg。从食品安全的角度来讲,食品中残留的植物生长激素、抗生素和杀菌剂等药物会对人体产生一定的危害,长期食用会影响人体内分泌和代谢平衡等[2-3]。
国内外关于豆芽中相关药物残留的检测方法报道较少,且主要集中在单一类型药物的检测,如2,4-二氯苯氧乙酸、6-苄氨基嘌呤等植物生长激素和喹诺酮类等药物[4-15],检测方法以气相色谱法[4-5]、液相色谱法[6]和色谱-质谱联用法[7-16]为主。不同的检测方法具有其特定的优缺点:气相色谱法需要进行衍生化反应,前处理操作繁琐,且存在定性不足和灵敏度低等问题;液相色谱法不需要衍生处理,但同样存在选择性差、灵敏度低和易受复杂样品基质干扰等问题;色谱-质谱联用法结合了色谱的高分离能力和质谱的高鉴别能力,能够实现准确定性定量,以减少误判,而且可以简化前处理、缩短检测时间、提高检测效率,是当前检测痕量化合物残留的主导技术,主要包括气相色谱-质谱联用法(GC/MS、GC-MS/MS)和液相色谱-质谱联用法(LC/MS、LC-MS/MS),其中串联质谱法的多反应监测(MRM)模式具有更好的选择性和灵敏度,在食品中药物残留的检测领域应用广泛。
鉴于目前豆芽生产市场存在滥用多种类型药物的情况,建立同时检测豆芽中植物生长激素、抗生素、杀菌剂等多种不同类型药物残留的方法,对于提高检测效率和加强监管具有积极的意义。因此,本研究应用具有快速、简单、廉价、高效、耐用、安全等优点的分散固相萃取净化技术(QuEChERS)[14-15, 17-21],结合超高效液相色谱(UPLC)的快速分离以及串联质谱(MS/MS) ESI电离源正、负模式分段扫描功能,优化前处理和色谱、质谱条件,建立同时定性定量检测豆芽中植物生长激素(6-苄氨基嘌呤、赤霉酸、2,4-二氯苯氧乙酸和4-氯苯氧乙酸)、抗生素(头孢氨苄和诺氟沙星)与杀菌剂(咪鲜胺)的方法,以满足对豆芽中残留药物监测的要求。
1 实验部分
1.1 主要仪器
AcquityTM超高效液相色谱和Waters XevoTMTQ MS 三重四极杆串联质谱仪:美国Waters公司产品;高速组织捣碎机:德国IKA公司产品;MS3 basic漩涡混合器:德国IKA公司产品;KQ-250DV型数控超声波清洗仪:昆山市超声仪器有限公司产品;LD5-2A离心机:北京京立离心机有限公司产品;5418高速离心机:德国Eppendorf公司产品;Milli-Q去离子水发生器:美国Millipore公司产品。
1.2 主要材料与试剂
6-苄氨基嘌呤、赤霉酸、2,4-二氯苯氧乙酸、对氯苯氧乙酸、头孢氨苄、诺氟沙星和咪鲜胺标准品:德国Dr. Ehrenstorfer公司产品;乙腈、甲醇(HPLC级):德国Merck公司产品;甲酸(HPLC级):美国Sigma公司产品;乙二胺-N-丙基硅烷(PSA)和C18填料(40 μm):美国Agilent公司产品;超纯水(电阻率18.2 MΩ·cm):实验室自制。
7种待测物标准品用甲醇-水溶解后,用甲醇配成单标储备液,再用甲醇配成混标储备液。临用时,选用阴性试样样液配制所需浓度的系列基质校准工作溶液。
分析样品(黄豆芽和绿豆芽):均购自本地不同市场。
1.3 实验方法
1.3.1样品的处理 称取5.0 g捣碎混匀的样品于50 mL玻璃比色管中,加入25 mL 0.1%甲酸甲醇,涡漩1 min,超声提取20 min,取2 mL上清液于装有50 mg PSA和150 mg C18的2 mL离心管中,涡漩振荡2 min,以13 000 r/min离心5 min,吸取1.0 mL上清液至氮吹管,置于40 ℃水浴中,氮吹至干,用10%甲醇水溶液定容至1.0 mL,过0.22 μm滤膜,待UPLC-MS/MS测定。
1.3.2色谱条件 Acquity UPLC HSS T3色谱柱 (100 mm×2.1 mm×1.8 μm);流动相:A为0.1%甲酸,B为乙腈;梯度洗脱程序:0.0~3.0 min、90%~40%A,3.0~5.0 min、40%~10%A,5.0~5.5 min、10%A,5.5~5.6 min、10%~90%A,5.6~7.5 min、90%A;流速0.3 mL/min;进样量5 μL;柱温30 ℃。
1.3.3质谱条件 ESI正、负模式分段采集;ESI正模式下,毛细管电压0.5 kV,ESI负模式下,毛细管电压2.9 kV;正负模式切换20 ms;离子源温度150 ℃;去溶剂气温度500 ℃;去溶剂气(氮气)流速800 L/h;锥孔气(氮气)流速50 L/h;碰撞气(高纯氩气)流速0.15 mL/min;多反应监测(MRM)模式。7种待测物的监测离子对及锥孔电压、碰撞能量等参数列于表1,每个离子对的驻留时间均为0.03 s。

表1 7种待测物的质谱分析条件Table 1 MS parameters for the analysis of 7 compounds
注:*为定量离子
2 结果与讨论
2.1 提取条件的选择
根据7种待测物的溶解性,对比了甲醇、0.1%甲酸甲醇、乙腈和0.1%甲酸乙腈的提取效果(与相应的基质标准溶液进行比较),结果示于图1。可见,0.1%甲酸甲醇的整体提取效果最好,因此,本实验选择0.1%甲酸甲醇作为提取溶剂。

图1 不同提取溶剂的提取结果Fig.1 Extraction results of the different extraction solvent
超声提取是实验室常用的提取方式,具有提取效率高、操作简便等优点。超声提取时间会影响提取率,故本实验分别考察超声5、10、15、20、25、30 min对提取率的影响,结果示于图2。图2表明,超声20 min已提取充分,故本实验选择超声提取时间为20 min。

图2 超声时间的优化Fig.2 Optimization of the time of ultrasonic extraction
2.2 净化条件的优化
实验考察了PSA、C18和GCB三种吸附剂对7种待测物的吸附效果。分别称取各50、100、150、200 mg PSA和C18两种吸附剂,25、50、75、100 mgGCB吸附剂,置于2.0 mL 离心管中,各加入1.5 mL 50 μg/L混标溶液,经涡旋、离心等处理后,通过检测进行比较。结果表明:GCB对除头孢氨苄外的6种待测物均有吸附,对诺氟沙星的吸附作用最强;PSA对2,4-二氯苯氧乙酸、4-氯苯氧乙酸、诺氟沙星、GA3都具有一定的吸附,吸附作用随着PSA用量的增加而增强;C18对7种待测物的吸附作用较弱,其中对6-苄氨基嘌呤、赤霉酸、2,4-二氯苯氧乙酸的吸附作用随着C18用量的增加而稍稍增强,C18用量为150 mg时,7种化合物的整体回收率最佳(86%~109%)。考虑到豆芽含有丰富的氨基酸和维生素,而PSA是一种弱阴离子交换剂,可以吸附脂肪酸、有机酸、碳水化合物等极性杂质,因此,进一步考察PSA和C18两种吸附剂对浓度为50 μg/L基质混标溶液的吸附作用。实验发现:PSA对待测物的吸附作用减弱,可能是由于基质竞争吸附而导致的;当PSA使用量为50 mg、C18使用量为150 mg时,仪器检测获得的响应值最大。因此,本实验选用50 mg PSA和150 mg C18作为净化吸附剂。
2.3 仪器条件的确定
在7种待测物中,咪鲜胺、头孢氨苄和6-苄氨基嘌呤的分子结构中均含有氨基,在ESI正模式下获得较高的[M+H]+峰;诺氟沙星分子结构中同时含有氨基和羧基,在ESI正、负模式下均有响应,但在正模式下的响应更高,信号更稳定,故选择ESI正模式检测;赤霉酸、2,4-二氯苯氧乙酸和4-氯苯氧乙酸的分子结构中均含有羧基,在ESI负模式下获得较高的[M-H]-峰。因此,本实验选用ESI正、负模式切换对7种待测物进行分段扫描检测。咪鲜胺和赤霉酸的一、二级质谱图示于图3。

图3 咪鲜胺和赤霉酸的一级(a1和a2)和二级(b1和b2)质谱图Fig.3 MS spectra (a1 and a2) and MS/MS spectra (b1 and b2) of prochloraz and gibberellic acid
植物生长激素类及抗生素类化合物的检测多采用C18柱。本实验比较了100 mm的HSS T3和BEH C18色谱柱对7种待测物的分离效果,发现T3柱对6-苄氨基嘌呤和赤霉酸的分离效果稍好,更有利于质谱的分段检测,故选择T3柱进行分离。单独采用ESI正模式检测时,流动相中加入甲酸,有利于提高待测物的电离效率,增强响应值;但对于ESI负模式,酸性流动相一般会抑制响应。由于本实验采用ESI正、负切换模式检测,选择流动相时应该兼顾考虑。通过比较乙腈-水和乙腈-0.1%甲酸水两组流动相体系,发现采用乙腈-水为流动相时,3种在ESI负模式下检测的化合物响应值比采用乙腈-0.1%甲酸水为流动相时均提高约3倍,而4种在ESI正模式下检测的化合物响应值下降了1~10倍。综合考虑,本实验选择乙腈-0.1%甲酸水作为流动相。
7种待测物标准溶液在优化好的仪器条件下的提取离子色谱图示于图4。

图4 7种待测物标准溶液的提取离子色谱图Fig.4 Selected ion chromatograms of the standard solution of 7 compounds
2.4 基质效应的校正
分别采用纯溶剂和经1.3处理的基质样液配制0.4 ~ 100 μg/L范围内6个浓度的混合标准溶液,按1.3条件进行测定,以峰面积y对质量浓度x(μg/L)绘制标准曲线,通过基质标准曲线的斜率与纯溶剂标准曲线的斜率之间的比值考察基质效应。若比值小于1,说明基质抑制;若比值大于1,说明基质增强。7种待测物的斜率比值分别为:咪鲜胺0.96,头孢氨苄0.57,诺氟沙星0.98,6-苄氨基嘌呤0.74,赤霉酸0.66,2,4-二氯苯氧乙酸0.81,4-氯苯氧乙酸0.58。结果表明,除咪鲜胺和诺氟沙星外,其余5种待测物存在一定的基质抑制效应。因此,本实验采用空白基质标准溶液工作曲线进行定量,以校正基质效应。
2.5 线性关系、检出限和定量限
浓度为0.4~100 μg/L的阴性基质标准溶液的标准曲线方程列于表2,可见,7种待测物的线性关系良好,相关系数在0.999 0~0.999 7之间。分别以S/N=3和S/N=10计算检出限(LOD)和定量限(LOQ),结合前处理的稀释倍数(5倍),得到7种待测物的方法检出限(MLOD)和方法定量限(MLOQ)。
2.6 方法回收率与精密度
选取自制阴性绿豆豆芽和黄豆豆芽样品进行3个水平的加标回收实验(与基质标准曲线校准),6次平行实验的结果列于表3。可见,在添加浓度范围内,7种待测物在2种豆芽中的平均回收率在80.7%~115%之间,相对标准偏差(RSD,n=6)为2.6%~13.5%。
阴性黄豆豆芽样品及其第1添加水平的提取离子色谱图示于图5。
3 结论
建立了以PSA和C18进行QuEChERS净化,超高效液相色谱-串联三重四极杆质谱在ESI正、负模式切换下测定豆芽中7种药物残留的方法。实验优化了提取和净化条件、色谱和质谱条件等,考察了方法检出限、基质效应、回收率、精密度等方法学指标。结果表明,该方法准确、灵敏、前处理简单,具有良好的回收率和精密度,能够满足检测豆芽中药物残留的要求,已应用于豆芽中7种药物残留的日常监测工作。

表2 7种待测物在阴性豆芽基质中的线性范围、线性方程和方法检出限与方法定量限Table 2 Linear range, linear equation, MLOD and MLOQ of 7 compounds
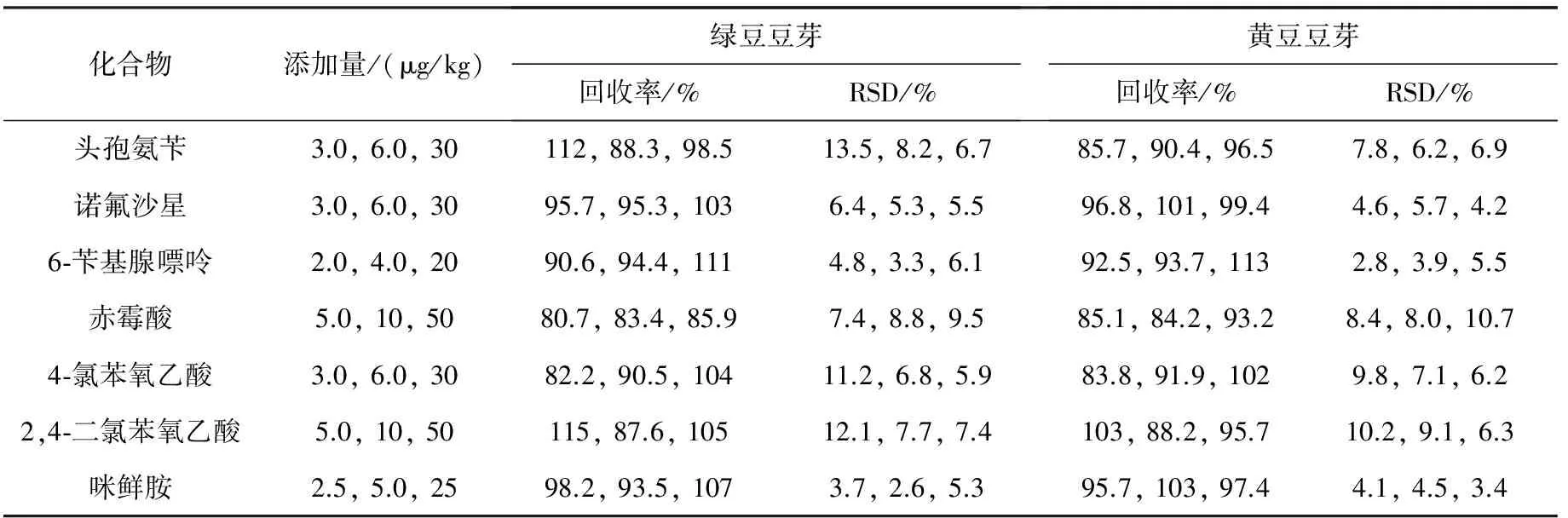
表3 回收率和精密度测定结果(n=6)Table 3 Determination results of recoveries and precisions(n=6)

a. 阴性样品;b. 加标样品 图5 阴性黄豆豆芽样品及其第1添加水平的提取离子色谱图Fig.5 Selected ion chromatograms of negative sample and its No.1 spiked
参考文献:
[1] NY 5317—2006 无公害食品 芽类蔬菜[S]. 北京:中国农业出版社, 2006.
[2] 郑宝珠, 贺 琴, 樊莉蕊, 等. 环境中的植物激素与人体健康[J]. 中国社会医学杂志, 2007, 24(4): 251-253.
ZHENG Baozu, HE Qing, FAN Lirui, et al. Effect of plant hormone in environment on humane health[J]. Chinese Journal of Social Medicine, 2007, 24(4): 251-253(in Chinese).
[3] 唐莉娟, 万益群. 植物激素的分析研究进展[J]. 食品科学, 2009, 30(21): 393-398.
TANG Lijuan, WAN Yiqun. Progress in methods for analyzing plant hormone[J]. Food Science, 2009, 30(21): 393-398(in Chinese).
[4] 常宇文, 吴晓宗, 李 伟, 等. 凝胶渗透色谱-气相色谱法测定豆芽中2,4-二氯苯氧乙酸残留量[J]. 食品工业科技, 2007, 28(12): 203-205.
CHANG Yuwen, WU Xiaozong, LI Wei, et al. Determination of residues of 2,4-dichlorophenoxyacetic in bean sprout by gas chromatography and gel permeation chromatography[J]. Science and Technology of Food Industry, 2007, 28(12): 203-205(in Chinese).
[5] AMER M M, SHEHATA M A, LOTFY H M, et al. Determination of tetraconazole and diniconazole fungicide residues in tomatoes and green beans by capillary gas chromatography[J]. Yakugaku Zasshi, 2007, 127(6): 993- 999.
[6] 夏 慧, 陆自强, 杨益众. 高效液相色谱法测定豆芽中2,4-二氯苯氧乙酸残留[J]. 扬州大学学报:农业与生命科学版, 2011, 32(4): 86-89.
XIA Hui, LU Ziqiang, YANG Yizhong. Determination of 2,4-dichlorophenoxyacetic acid residues in bean sprout samples by high performance liquid chromatography[J]. Journal of Yangzhou University(Agricultural and Life Science Edition), 2011, 32(4): 86-89(in Chinese).
[7] CHO S K, ABD EL-ATY A M, PARK K H, et al.
Simple multiresidue extraction method for the determination of fungicides and plant growth regulator in bean sprouts using low temperature partitioning and tandem mass spectrometry[J]. Food Chemistry, 2013, 136: 1 414-1 420.
[8] 林黛琴, 万承波, 王婷婷. 高效液相色谱-串联质谱测定豆芽中6-苄氨基嘌呤方法的研究[J]. 江西化工, 2013, (3): 99-103.
LIN Daiqin, WAN Chengbo, WANG Tingting. Determination of 6-benzylaminopurine in bean sprout by high performance liquid chromatography coupled with tandem mass spectrometry[J]. Jiangxi Chemical Industry, 2013, (3): 99-103(in Chinese).
[9] 谢寒冰, 林 洪, 蒋万枫, 等. 高效液相色谱-电喷雾质谱联用法检测豆芽中残留的6-苄基腺嘌呤[J]. 山东农业科学, 2008, (2): 92-94.
XIE Hanbing, LIN Hong, JIANG Wanfeng, et al. Determination of 6-benzylaminopurine in bean sprouts by HPLC/ESI/MS[J]. Shandong Agricultural Sciences, 2008, (2): 92-94(in Chinese).
[10] 张宪臣, 华洪波, 张朋杰, 等. SA-HPLC-MS/MS法快速检测豆芽中4种喹诺酮类药物残留量[J]. 吉林农业大学学报, 2012, 34(2): 216-220.
ZHANG Xianchen, HUA Hongbo, ZHANG Pengjie, et al. Simultaneous determination of four quinolones residues in bean sprout by SA-HPLC-MS/MS[J]. Journal of Jilin Agricultural University, 2012, 34(2): 216-220 (in Chinese).
[11] 崔相勇, 张凤清, 周长民, 等. 高效液相色谱-质谱联用法测定豆芽中恩诺沙星含量[J]. 食品科学, 2012, 33(20): 180-183.
CUI Xiangyong, ZHANG Fengqing, ZHOU Changmin, et al. Determination of enrofloxacin in soy bean sprout by LC-MS/MS[J]. Food Science, 2012, 33(20): 180-183(in Chinese).
[12] 吴淑秀, 公茂金, 刘玉芳, 等. 芽苗类蔬菜中喹诺酮类药物的高效液相色谱-质谱测定法[J]. 环境与健康杂志, 2012, 29(5): 457-459.
WU Shuxiu, GONG Maojin, LIU Yufang, et al. Determination of quinolones residues in shoots by high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Environment and Health, 2012, 29(5): 457-459(in Chinese).
[13] 柳 菡, 吴 斌, 殷 耀, 等. 高效液相色谱-串联质谱法测定芽苗类蔬菜及其来源豆类中4种非法添加物的残留量[J]. 色谱, 2013, 31(1): 22-26.
LIU Han, WU Bin, YIN Yao, et al. Determination of four kinds of illegal additive residues in sprouts and source beans by high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2013, 31(1): 22-26 (in Chinese).
[14] ZHANG F Z, ZHAO P Y, SHAN W L, et al. Development of a method for the analysis of four plant growth regulators (PGRs) residues in soybean sprouts and mung bean sprouts by liquid chromatography-tandem mass spectrometry[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 89(3): 674-679.
[15] MA L Y, ZHANG H Y, XU W T, et al. Simultaneous determination of 15 plant growth regulators in bean sprout and tomato with liquid chromatography-triple quadrupole tandem mass spectrometry[J]. Food Analytical Methods, 2013, 6(3): 941-951.
[16] 陈卫军, 张耀海, 李云成, 等. 果蔬中常用植物生长调节剂分析方法研究进展[J]. 食品科学, 2012, 33(11): 283-289.
CHEN Weijun, ZHANG Yaohai, LI Yuncheng, et al. Research advances in analytical methods of plant growth regulators for fruits and vegetables[J]. Food Science, 2012, 33(11): 283-289(in Chinese).
[17] 王 璐, 吴 倩, 段春凤, 等. 基质固相分散萃取-高效液相色谱-串联质谱法分析拟南芥中的赤霉素[J]. 色谱, 2011, 29(9): 923-926.
WANG Lu, WU Qian, DUAN Chunfeng, et al. Determination of gibberellins in Arabidopsis thaliana by matrix solid-phase dispersion extraction and high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2011, 29(09): 923-926 (in Chinese).
[18] 刘靖靖, 宫 萍, 张晓梅, 等. 液相色谱-四极杆飞行时间质谱法快速测定草莓中6 种植物生长调节剂的残留量[J]. 色谱, 2012, 30(10): 1 012-1 016.
LIU Jingjing, GONG Ping, ZHANG Xiaomei, et al. Determination of six plant growth regulator residues in strawberry by liquid chromatography-quadrupole time of flight mass spectrometry[J]. Chinese Journal of Chromatography, 2012, 30(10): 1 012-1 016(in Chinese).
[19] 孔志强, 董丰收, 刘新刚, 等. 超高效液相色谱-串联质谱法测定柑橘及柑橘精油中4种农药残留[J]. 分析化学, 2012, 40(3): 474-477.
KONG Zhiqiang, DONG Fengshou, LIU Xingang, et al. Determination of 4 pesticides residues in citrus and essential oil by ultra performance liquid chromatography-mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2012, 40(3): 474-477(in Chinese).
[20] LEE S D, KIM G Y, MOON J H. Detection of 6-benzylaminopurine plant growth regulator in bean sprouts using OFRR biosensor and QuEChERS method[J]. Anal Methods, 2013,(5): 961-966.
[21] LEHOTAY S J, SONB K A, KWONB H, et al. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables[J]. Journal of Chromatography A, 2010, 1 217(16): 2 548-2 560.

