一种河口沉积物总DNA的高效提取方法
王东升,黄江丽,谭胤静,田晓娟,张志红,丁建南
(江西省科学院生物资源研究所,330096,南昌)
0 引言
近些年来,分子生物学技术在环境工程学、微生物生态学和环境生物学的研究中应用越来越广泛。例如,环境中土壤微生物功能基因的发掘和种群的分析与检测等就主要是应用分子生物学手段来研究,而提取高质量的DNA是分子生物学实验的前提和基础。已知土壤、特别是湖泊河流的沉积物中含有大量的腐殖质,主要包括能溶于酸也溶于碱的富里酸(Fulvic Acids,FA),溶于碱但不溶于酸的胡敏酸(Humic Acids,HA)和不溶于酸碱的胡敏素(Humin,HM)[1],其中腐质酸在沉积物DNA提取过程中不容易被去除,这些物质可对后续的PCR扩增、内切酶消化、DNA杂交等实验产生不利影响[2-3],因而在沉积物微生物总DNA提取过程中去除腐质酸尤为重要。然而,在现有土壤和沉积物总DNA提取的方法中,腐质酸很难被完全去除,目前普遍采用并相对较好的方法主要是DNA提取试剂盒法和CTAB-SDS-冻融法[4-5]。本文以3种不同河口沉积物为研究对象,采用改进的CTAB-SDS-冻融法和DNA提取试剂盒法提取DNA并加以分析比较,旨在建立一种适用于高含腐殖质沉积物总DNA的提取方法,以期为后续的分子生物学研究奠定基础。
1 材料和方法
1.1 实验材料
实验材料1取自修河与赣江交汇处修河上游200 m处,沉积物呈黑色,腐殖质含量非常高;实验材料2取自修河与赣江交汇处赣江上游150 m处,沉积物为黄色粘土,黄色色素含量高;实验材料3取自饶河进入鄱阳湖的河口,沉积物主要以沙子为主。取上层0~3 cm的沉积物作为样品,每个河口取6个点混合在一起。
1.2 主要试剂
脱腐殖酸缓冲液:参考魏斐[4]等改进,100 mmol/L Tris,100 mmol/L Na4P2O7,100 mmol/L Na2EDTA,1.0% 聚乙烯吡咯烷酮 K30(PVP),NaCl,0.05%Trition X-100,pH10.0,121 ℃ 高压灭菌20 min。
CTAB溶液:由终浓度为 100 mM的 Tris-HCl,100 mM 的 EDTA,1.5 M 的 NaCl,1% 的十六烷基三甲基溴化铵(CTAB),1 mg/mL的溶菌酶和0.2 mg/mL的蛋白酶K组成(溶菌酶和蛋白酶K用时再加入)。
10%的十二烷基磺酸钠(SDS);酚/氯仿/异戊醇(25∶24∶1)。
洗涤缓冲液:0.33 mol Tris·HCl(pH8.0),1 mmol EDTA·Na(pH8.0)。
核酸电泳缓冲液:1×TAE缓冲液。
DNA沉淀和洗涤试剂:异丙醇,无水乙醇。
1.3 河口沉积物总DNA提取方法
1.3.1 方法1 1)沉积物中微生物的细胞裂解:称取1.5 g沉积物样品,加3 mL CTAB溶液,涡旋充分混匀;在液氮和65℃水浴中反复冻融3次;在37℃下摇30 min。2)DNA的分离:加10%的SDS至终浓度为2%,在65℃水浴中保温1.5 h,每隔20 min颠倒混匀1次;室温12 000 r/min离心10 min,收集上清;上清加等体积酚/氯仿/异戊醇(25∶24∶1),轻轻颠倒混匀;室温12 000 r/min离心10 min,留上清;酚/氯仿/异戊醇(25∶24∶1)抽提3次;上清加等体积的异丙醇,沉淀1-2 h;在4℃下,以12 000 r/min离心10 min,弃上清;用70%的冰冻乙醇洗涤DNA沉淀,在4℃下,以12 000 r/min离心5 min,弃上清;70%的冰冻乙醇洗涤DNA沉淀3次,自然干燥;用100 μL TE(pH8.0)溶解 DNA沉淀,得到河口底泥总DNA粗提液。DNA跑0.8%的琼脂糖凝胶电泳。
1.3.2 方法2 1)沉积物的预处理:称取15 g河口底泥放入50 mL离心管中,加入30 mL脱腐殖酸缓冲液,涡旋振荡5 min,静置2 min,在4℃下先2 500 r/min低速离心3 min,再10 000 r/min高速离心8 min,弃上清,取沉淀的上部1/2转移到另一新的离心管中;重复上步2次,将得到1.5 g底泥转移到10 mL离心管中,再用脱腐殖酸缓冲液洗涤到无色为止;最后用洗涤缓冲液洗涤底泥2次。2)细胞裂解和DNA分离步骤与方法1相同。
1.3.3 方法3 1)样品预处理方法与方法2相同;2)细胞裂解和DNA分离步骤与方法一相同;3)DNA重沉淀:DNA粗提液加1倍体积的冰冻异丙醇,在 -20℃下沉淀1.5 h;在4℃下,以12 000 r/min离心10 min,弃上清;沉淀用70%的冰冻乙醇洗涤,在4℃下,以12 000 r/min离心5 min,弃上清,本步骤重复2 次;用50 μL TE(pH8.0)溶解DNA沉淀,得到最终河口沉积物总DNA。1.3.4 方法4 沉积物总 DNA提取使用 ZOMANBIO公司的离心柱型超纯土壤基因组DNA快速提取试剂盒,操作步骤见说明书。
1.4 提取的总DNA琼脂糖凝胶电泳
提取的DNA样品跑0.8%琼脂糖凝胶电泳检测。
1.5 DNA纯度和产量检测
用美国Nanodrop公司的ND-1000紫外分光光度法分别测定 DNA溶液的 OD230、OD260和OD280值。DNA浓度可以直接读数,通过计算OD260/OD280(DNA/蛋白质)和OD260/OD230(DNA/腐殖酸)的比值来评价所提取DNA的纯度[6]。
1.6 16S rDNA的PCR扩增
以上述4种方法提取的沉积物总DNA为模板,用细菌16S rDNA 通用引物63F(5'-CAGGCCTAACACATGCAAGTC-3')和 1387R(5'-GGGCGGWGTGTACAAGGC-3')进行 PCR扩增。PCR反应体系:模板 DNA 1 μL,20 μM 的引物 63F 和1387R 各 1 μL,2 × EasyTaq PCR SuperMix 25 μL,加ddH2O到50 μL。PCR反应参数:95℃变性5 min;95℃变性35 s,54℃退火40 s,72℃延伸90 s,30个循环;72℃延伸8 min。PCR产物跑1%的琼脂糖凝胶电泳。
2 结果与分析
2.1 提取的总DNA琼脂糖电泳结果
如图1所示,泳道1~12的DNA电泳图谱条带单一清晰,几乎无拖尾现象,DNA片断大小约23 130 bp,说明所提取的 DNA没有断裂。从DNA条带的明亮程度来判断,CTAB-SDS-冻融法和样品预处理-CTAB-SDS-冻融法提取的DNA浓度高,沉积物样品经过预处理所提取的DNA浓度最高,而样品预处理-CTAB-SDS-冻融-DNA 重沉淀法和土壤总DNA提取试剂盒法提取的DNA浓度较低。这说明方法3中DNA重沉淀会损失大量的DNA;土壤总DNA提取试剂盒的吸附柱能吸附的DNA量有限,大量的DNA没能附着在吸附柱上;沉积物样品经过预处理去除了大量的腐殖酸,有利于提高DNA的回收率(如图1中泳道1~6)。此外,由于沉积物样品的不同,也会影响DNA的提取量,如图1中泳道3、6比较暗,DNA含量少,主要是由于饶河沉积物多为沙子,含有微生物少,而泳道1、2和4、5比较亮,DNA含量多,它们分别为修河和赣江沉积物,沙子少,营养多,含有微生物量也多。
2.2 DNA纯度和产量检测结果
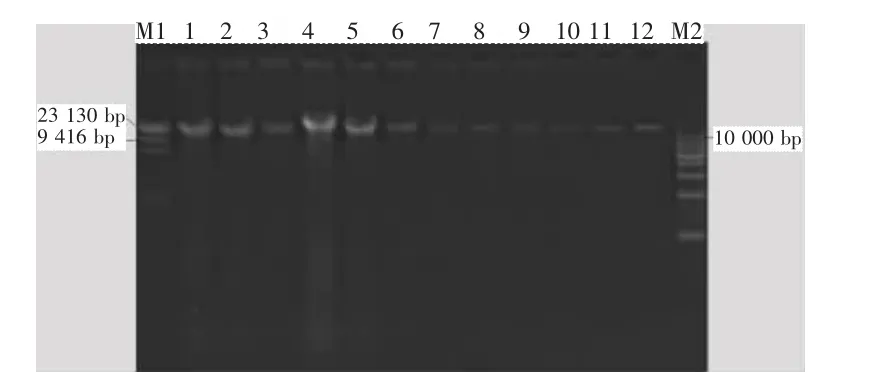
图1 沉积物总DNA的0.8%琼脂糖凝胶电泳图谱
在高含腐殖质的沉积物DNA提取过程中,腐殖酸、酚类物质、杂蛋白等难以去除干净,一般通过检测 OD260/OD230和 OD260/OD280比值来评价DNA样品的纯度。腐殖酸在230 nm和260 nm处有吸收峰,OD260/OD230比值高(>2)表示DNA较纯,而比值低表明腐殖酸污染多;蛋白质在280 nm处有吸收峰,OD260/OD280比值高(>1.7)表示DNA较纯,而比值低表明蛋白质污染多[3]。
从表1中可以看出,方法1、2所得DNA样品的OD260/OD230和OD260/OD280比值相对较小,说明其中蛋白质、腐殖酸等杂质成分较多,也可以看出方法2比方法1 DNA纯度要高些,说明沉积物样品经过预处理后,对提取高质量的DNA有好处,同时也能增加 DNA的提取量;方法3、4所得DNA样品的OD260/OD230和OD260/OD280比值相对较高,说明其中蛋白质、腐殖酸等杂质成分较少,也可以看出方法3比方法4所得DNA的纯度更高,说明DNA重沉淀对除去腐殖酸、蛋白质等杂质作用显著,但DNA重沉淀会导致DNA的大量损失,即便DNA有大量损失,还是比试剂盒提取的量要大;从表1中也可以看出,同一种方法不同沉积物样品所得DNA纯度和产量也不一样,修河河口沉积物含有腐殖质最多,最不容易去除,赣江河口沉积物的腐殖质要少一些,饶河河口沉积物的腐殖质最少,基本为沙子为主,不用对沉积物样品进行预处理就能提取质量相对较高的DNA,但由于以沙子为主的沉积物营养少,微生物含量也就少,最终提取的DNA产量也相对较少,但是用试剂盒提取方法中,饶河河口沉积物所得到的DNA量最多,推测是与DNA竞争吸附柱的腐殖酸少的原故。腐殖酸与DNA有相似的物理化学性质,在使用柱子进行纯化时腐殖酸与DNA竞争性地结合吸附位点[7]。
2.3 16S rDNA的PCR扩增结果
如图2所示,泳道3、6、9、12能够清晰的看到PCR扩增16S rDNA得到约1 380 bp的目的片断,说明饶河河口沉积物用这4种方法都可以提取到质量能满足PCR扩增要求的DNA,因为该样品所含腐殖质少。泳道1、4、10都没有PCR扩增的目的片断,只有泳道7有PCR扩增的目的片断,说明方法1、2、4提取的修河河口沉积物的DNA质量不能满足PCR扩增条件,含有的杂质太多,而方法3进行了重沉淀DNA,去除了大量的DNA中的杂质,使其达到了PCR扩增的要求。泳道2、5没有PCR扩增的目的片断,泳道8、11有PCR扩增的目的片断,说明方法1、2提取的赣江河口沉积物DNA质量达不到PCR扩增的要求,方法3、4提取的符合PCR扩增要求。从DNA样品上看,方法1提取的修河、赣江河口沉积物总DNA样品显褐色,方法2提取修河、赣江河口沉积物总DNA样品显黄色,方法4提取的修河河口沉积物总DNA样品显浅黄色,DNA样品颜色的深浅代表含腐殖酸的多少,这些腐殖酸通过鳌合Mg2+抑制PCR关键酶Taq聚合酶的活性[8]。这与实验结果相吻合,如图2中的泳道1、2、4、5、10所示。

表1 4种方法提取的3种河口沉积物总DNA的纯度和产量比较
结合表1数据,得出4种方法提取沉积物DNA的质量由高到低的顺序:方法3>方法4>方法2>方法1。
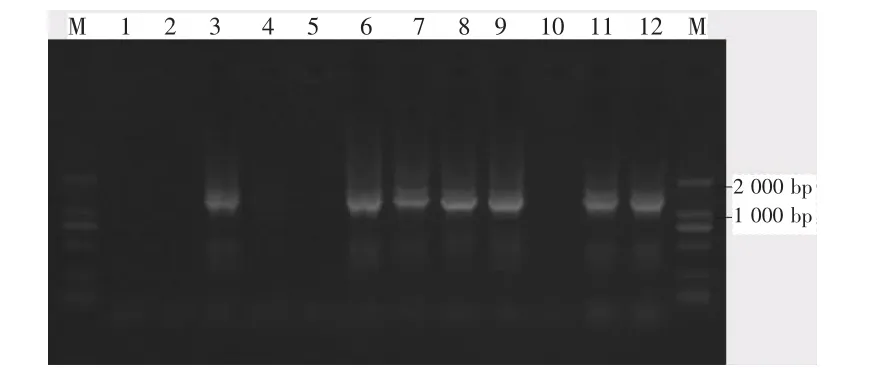
图2 沉积物总DNA的16S rDNA PCR扩增结果
3 讨论
通常提取DNA的方法主要包括两大步骤:一是细胞裂解,二是DNA分离。但是对于土壤和沉积物提取DNA来说,只有细胞裂解和DNA分离这两步还远远不够,因为土壤中含有大量的腐殖酸,污染腐殖酸的DNA不能进行后续的分子生物学实验。本文在沉积物总DNA提取方法中最常用且相对有效的CTAB-SDS-冻融法的基础上,增加和改进了去除DNA中腐殖酸的步骤。土壤样品中的腐殖酸一般常用PVP和CTAB去除[9],方法2用PVP去除沉积物样品中的腐殖酸,结果比方法1没有用PVP的效果要好,当然CTAB也有很好的去除腐殖酸作用。但是,对于腐殖酸含量高的沉积物样品来说,虽然沉积物样品经过预处理去除腐殖酸,其最后提取的DNA质量仍然不高,达不到分子生物学实验的要求。因此,方法2所提取的DNA还必须经过进一步纯化来去除腐殖酸。DNA纯化最常用的方法为琼脂糖凝胶电泳纯化法和直接DNA吸附柱纯化法[10],这2种方法成本都比较高,琼脂凝胶电泳纯化法虽然效果好,但操作相对繁琐,直接DNA吸附柱纯化法腐殖酸会也与DNA竞争吸附柱的吸附位点,纯化效果也不理想。本文方法3纯化DNA的方法是对DNA进行重新沉淀,虽然会导致DNA的大量损失,但是比试剂盒法提取沉积物总DNA所得到的DNA产量更多、质量更好。
综上所述,河口沉积物总 DNA提取前,用PVP预处理沉积物样品可以除去部分腐殖酸,对于含有大量腐殖质的沉积物所提取的DNA还必须进行纯化,异丙醇重沉淀DNA的纯化方法虽然会损失大量DNA,但是操作简单、价格低廉,最重要的是可以获得高质量的DNA,为后续的分子学实验奠定基础。
[1] 马连刚,肖保华.土壤腐殖质提取和分组综述[J].矿物岩石地球化学通报,2011,30(4):465-470.
[2] 腾应,骆永明,赵祥伟,等.重金属复合污染农田土壤DNA的快速提取及其PCR-DGGE分析[J].土壤学报,2004,41(3):343 -348.
[3] Yeates C,Gillings M R,Davison A D,et al.Methods for microbial DNA extraction from soil for PCR amplification[J].Biological Procedures Online,1998,1(1):40-47.
[4] 魏斐,杨丽荣,吴坤,等.不同方法提取土壤、活性污泥中总DNA的比较研究[J].河南农业科学,2012,41(5):74 -77,95.
[5] 黄淑君,胡兴明,于翠,等.一种高效提取桑树根围土壤微生物总DNA的方法[J].蚕业科学,2012,38(3):0397-0403.
[6] 何沙娥,张智俊.适用于竹林土壤PCR-DGGE分析用的微生物总DNA提取及纯化方法[J].浙江林学院学报,2009,26(2):164 -168.
[7] Roose-Amsaleg C L,Garnier-Sillam E,Harry M.Extraction and Purification of rnicrobial DNA from soil and sediment samples[J].Applied Soil Ecology,2001,18(1):47-60.
[8] Caffrey J M,Bano N,Kalanetra K,et al.Ammonia oxidation and ammonia-oxidizing baeteria and archaea from estuaries with differing histories of hypoxia[J].International Society for Microbial Ecology,2007,1(7):660-662.
[9] Robe P,Nalin R,Capellano C,et al.Extraction of DNA from soil[J].European Journal of Soil Biology,2003,39(4):183-190.
[10] 窦莹颖,林展民,朱英德,等.浙贝母根际土壤总DNA提取和纯化方法的比较[J].微生物学通报,2008,35(11):1840-1844.

