稻草秸秆酶解条件优化
程旺开
(芜湖职业技术学院 生物工程学院,安徽 芜湖 241003)
稻草秸秆酶解条件优化
程旺开
(芜湖职业技术学院 生物工程学院,安徽 芜湖 241003)
以高温预处理稻草秸秆为原料,分别进行纤维素酶、木聚糖酶单因子和正交试验,探索秸秆适宜工艺条件。结果表明:在1∶8的酶解固液比条件下,添加纤维素酶15 FPU/g底物和木聚糖酶200 IU/g底物,于50 ℃温度下酶解48 h,将获得82.13%的还原糖得率。说明以纤维素酶及木聚糖酶处理稻草秸秆是可行方法之一。
稻草;高温预处理;纤维素酶;木聚糖酶;还原糖
随着工业化的发展进程,人类长期使用的化石能源将逐渐减少,且在其使用过程中还带来了严重的环境污染问题,探寻清洁、可再生能源已成为研究热点,其中利用木质纤维为原料制备燃料乙醇被认为是最有工业应用前景的途径之一[1-2]。在木质纤维燃料乙醇的制备过程中,关键技术在于将木质纤维降解为可发酵性糖。目前常用的处理方法有生物法、化学法和物理法[3-4]。化学处理法特别是酸碱法存在成本高、环境污染大等缺点;生物处理法存在处理周期长、效率低等不足;而采用物理方法不需要添加如硫酸、石灰或氨水等化学试剂,减少了中和或回收的成本,同时对环境不会产生污染,具有环保性[5-6]。本研究以稻草秸秆木质纤维为原料,经过适当的高温处理后,添加木聚糖酶和纤维素酶进行酶解,以获得一定的还原糖供后续的酒精发酵,为木质纤维生产燃料乙醇提供理论基础。
1 材料和方法
1.1 材料及仪器
稻草秸秆:晚季梗稻秸秆,取于安徽省当涂县石桥镇,经粉碎,过40目筛子,备用;纤维素酶、木聚糖酶:无锡市酶制剂厂;其他试剂均为分析纯。
高温高压反应釜:烟台高新区科立自控设备研究所;紫外可见分光光度计:北京普析通用仪器有限责任公司;振荡数显恒温水浴锅:金坛市瑞尔电器有限公司;电子天平:上海精密科学仪器公司;台式离心机:上海安亭科学仪器厂。
1.2 方法
1.2.1 稻草秸秆高温预处理
用天平称取稻草秸杆112.5 g倒入高温高压反应釜中,加水(自来水)900 mL搅拌(固液比为1∶8),温度设置为180 ℃。使温度尽快升至设置温度(因反应釜升温速度较慢,本试验统一设置为1 ℃/min),保温30 min,急剧冷却至40 ℃左右,打开反应釜,将固体和液体一同80 ℃烘干一天,为酶解试验材料。1.2.2 酶解单因素试验
在其他酶解工艺参数一定的情况下,单独考察纤维素酶、木聚糖酶、固液比和酶解时间对还原糖得率的影响,旨在找出各单因素的合适工艺参数范围,以便采用正交试验对酶解条件进行优化。具体酶解单因素试验条件如下:
1)纤维素酶添加量试验:取酶解试验材料0.833 3 g于500 mL三角瓶内,用0.1 M乙酸-乙酸钠缓冲溶液(pH=4.8)配制成1∶12的固液比,添加不同的纤维素酶(4、6、8、10、12.5、15、20、30 FPU/g底物),在50 ℃下酶解48 h后,取2 mL酶解液,离心取上清液测还原糖,计算还原糖得率。
2)木聚糖酶添加量试验:取酶解试验材料0.833 3 g于500 mL三角瓶内,用0.1 M乙酸-乙酸钠缓冲溶液(pH=4.8)配制成1∶8的固液比,添加10 FPU/g底物的纤维素酶和不同量的木聚糖酶(50、100、150、200、250、300、400 IU/g底物),在50 ℃下酶解48 h后,取2 mL酶解液,离心取上清液测还原糖,计算还原糖得率。
3)酶解固液比试验:取酶解试验材料0.833 3 g于500 mL三角瓶内,用0.1 M乙酸-乙酸钠缓冲溶液(pH=4.8)配制成不同的固液比(1∶20、1∶18、1∶16、1∶14、1∶12、1∶10、1∶8、1∶6、1∶4),添加15 FPU/g底物的纤维素酶和200 IU/g底物的木聚糖酶,在50 ℃下酶解48 h后,取2 mL酶解液,离心取上清液测还原糖,计算还原糖得率。
4)酶解时间试验:取酶解试验材料0.833 3 g于500 mL三角瓶内,用0.1 M乙酸-乙酸钠缓冲溶液(pH=4.8)配制成1∶14的固液比,添加15 FPU/g底物的纤维素酶量和200 IU/g底物的木聚糖酶,在50 ℃温度下酶解不同的时间后,取2 mL酶解液,离心取上清液测还原糖,计算还原糖得率。
1.2.3 酶解正交试验
在上述单因素试验的基础上进行L2556正交表安排试验(见表1),以还原糖得率为指标,通过正交试验优化酶解工艺及参数。试验数据采用《正交设计助手IIV3.1版》软件处理。
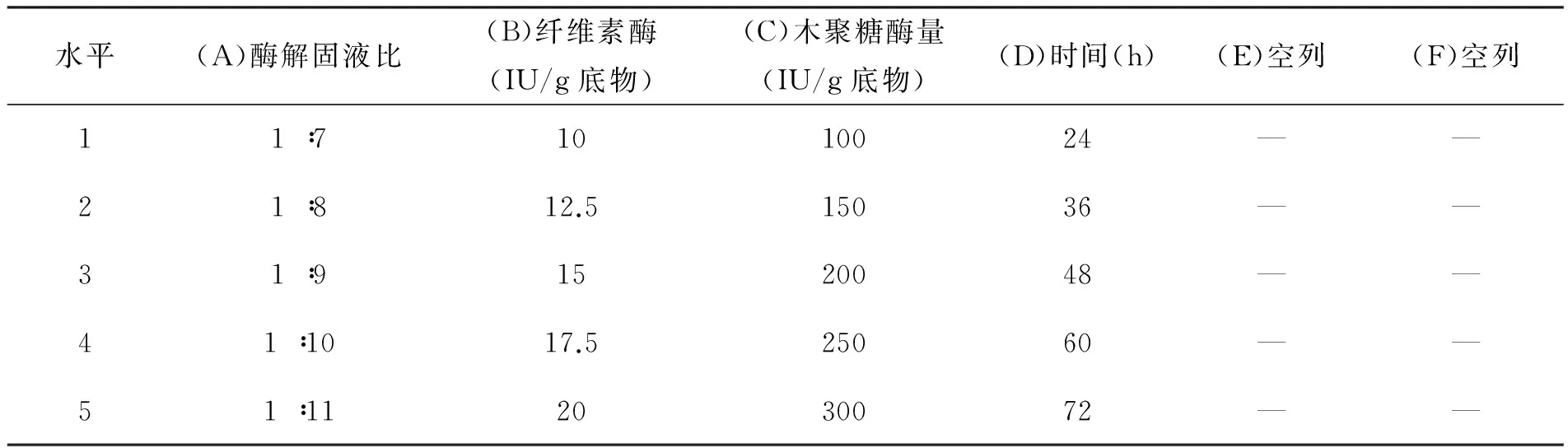
表1 酶解正交试验L2556因素水平表
1.3 酶与酶解成分测定
1.3.1 酶活定义
纤维素酶活力单位(FPU):酶于50 ℃ 和pH 4.8条件下,每分钟水解0.5 g滤纸生成1 μmol葡萄糖所需的酶量定义为1个纤维素酶活力单位;
木聚糖酶活力单位(IU):1 g酶粉(或者1 mL酶液)于50 ℃和pH 4.8条件下,每分钟分解1%的木聚糖溶液产生1 μmol还原糖(木糖)的酶量定义为1个木聚糖酶活力单位。
1.3.2 木糖测定
地衣酚法测定[7]。
1.3.3 还原糖浓度测定
采用3,5-二硝基水杨酸法(DNS法)[8]。
1.3.4 酶解得率的计算
还原糖得率计算式为:

式中 M总:稻草秸杆原料的总质量(g);M:稻草秸杆高温处理后烘干的质量(g);m:酶解物料的质量(g);C:酶解液的还原糖浓度(g/mL);10:酶解液体积(mL);0.5914:总糖量/g稻草秸杆。
2 结果与讨论
2.1 酶解单因素试验
2.1.1 纤维素酶添加量
高温预处理后稻草秸秆在其他酶解条件一定的情况下,改变不同的纤维素酶添加量,酶解结束后测还原糖,计算还原糖得率。纤维素酶添加量与还原糖得率关系如图1所示。
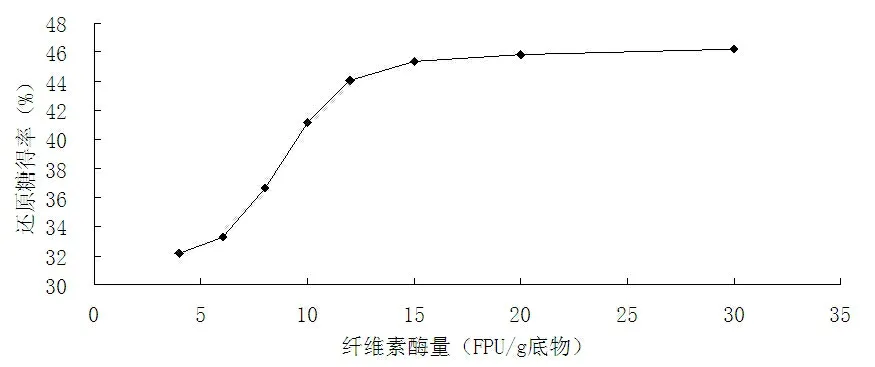
图1 纤维素酶量对酶解效果的影响
从图1可以看出,当纤维素酶量太少时,酶浓度过低,酶解效果不好。还原糖得率随着酶量的增大而增加,当纤维素酶量为15 FPU/g底物时,还原糖得率达到45.35%,再增加酶量,还原糖得率趋于稳定,因此合适的纤维素酶添加量应为15 FPU/g底物。
2.1.2 木聚糖酶添加量
在其他酶解条件一定的情况下,添加不同量的木聚糖酶进行酶解。木聚糖酶添加量对还原糖得率的影响如图2所示。
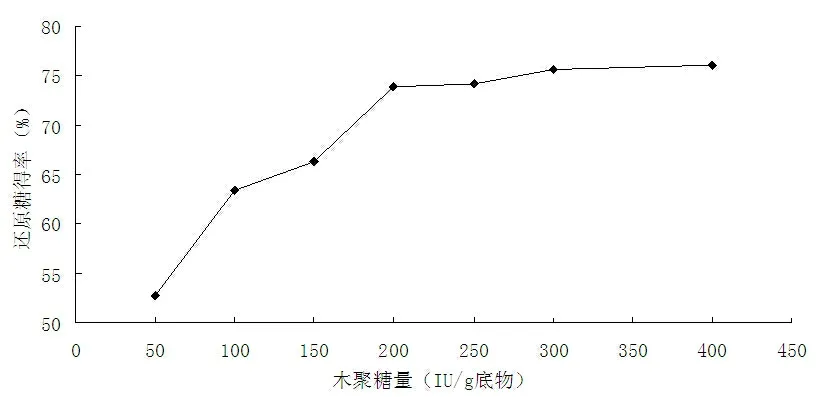
图2 木聚糖酶量对酶解效果的影响
从图2可以看出,木聚糖酶的加入提高了还原糖得率,这说明经过高温预处理的稻草秸秆,其半纤维素受到很大程度的降解,产生了比较多的木聚糖。当木聚糖酶添加量为200 IU/g底物时,还原糖得率达73.91%,再增加酶量对酶解没有多大的影响,因此在该条件下,合适的木聚糖酶添加量应为200 IU/g底物。
2.1.3 酶解固液比
将高温预处理后的原料配制成不同的固液比,添加15 FPU/g底物的纤维素酶和200 IU/g底物的木聚糖酶,在50 ℃下酶解48 h,考察不同的固液比对还原糖得率的影响,其结果如图3所示。
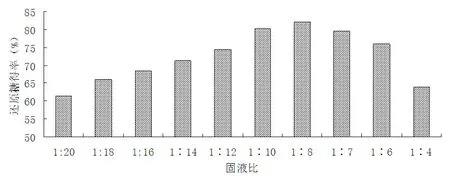
图3 固液比(底物浓度)对酶解效果的影响
从图3可以看出,当底物浓度过低或过高时,还原糖得率都降低。当底物浓度过低时,酶浓度较低,底物与酶接触的面积少,酶解效率下降;当底物浓度过高时,酶受到底物的抑制,酶解效果也下降。合适的酶解固液比为1∶8左右,此时还原糖得率为82.13%。
2.1.4 酶解时间
高温预处理后的稻草秸秆在其他酶解参数一定的条件下,在不同的酶解时间内测酶解液中还原糖得率,其变化情况如图4所示。
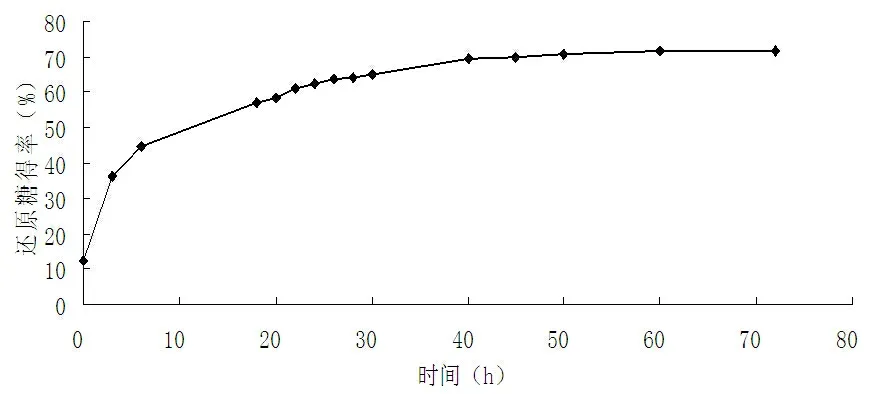
图4 酶解时间对酶解效果的影响
从图4可以看出,在酶解过程中,酶解速率较强的时间段为前3 h,当酶解时间到达24 h后,还原糖得率增加较缓慢,酶解时间达48 h后,还原糖得率基本不再增加,这表明酶解已基本结束。
2.2 酶解正交实验
根据单因素实验结果,设计正交试验(L2556)(见表1)进行试验,并对试验结果进行正交分析,结果如表2所示。
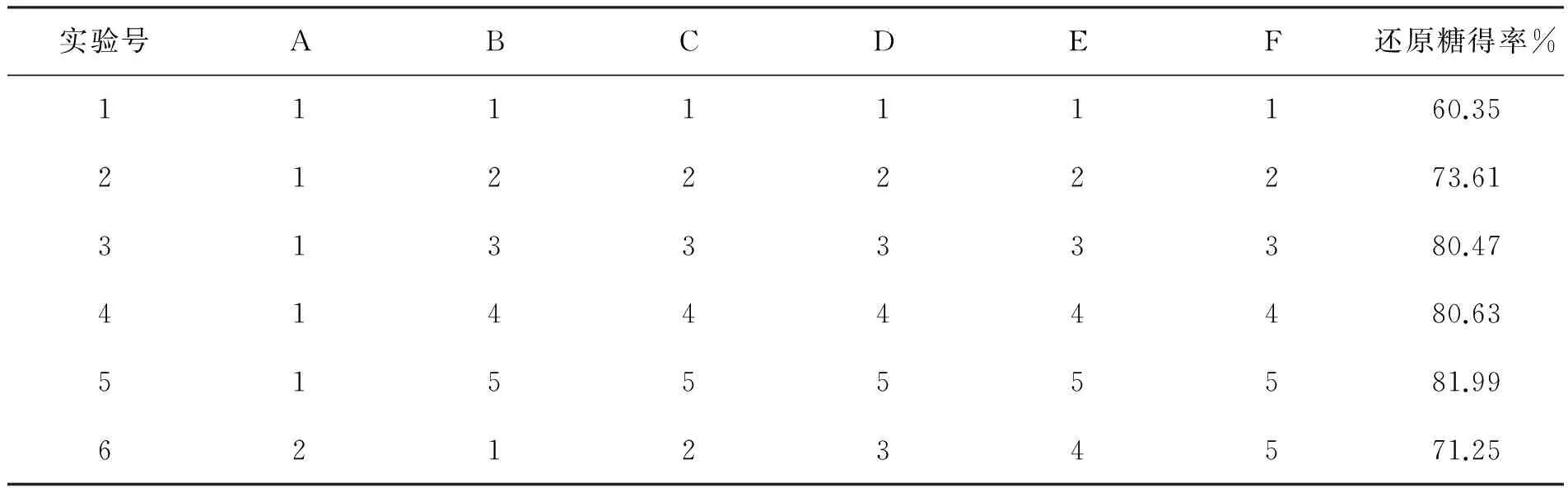
表2 酶解正交表(L2556)

续表2
从表2极差分析看出,各因素对酶解的影响次序是B>C>D>A,说明在本试验中纤维素酶添加量为最大的限制因素,其次是木聚糖酶添加量,而时间和固液比影响较小。根据表2中k值,最适宜的酶解条件为A2B5C5D5,但从k值及效应曲线图(图5)可以看出,A2B3C3D3和A2B5C5D5很接近,基于节约成本及缩短酶解时间,选择A2B3C3D3为最佳组合,与酶解固液比单因素实验基本一致,即固液比为1∶8,纤维素酶量为15 FPU/g底物,木聚糖酶量为200 IU/g底物,酶解48 h,还原糖得率为82.13%。
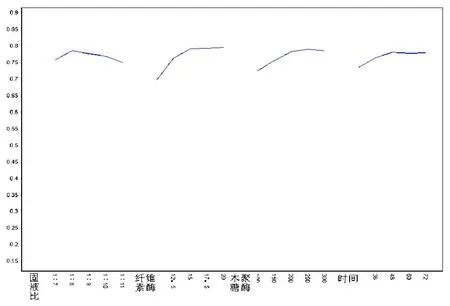
图5 酶解正交效应曲线图
3 结论
经高温预处理后的稻草秸秆,在固液比为1∶8的条件下,添加15 FPU/g底物的纤维素酶和200 IU/g底物的木聚糖酶,于温度50 ℃和pH 4.8下酶解48 h,将获得82.13%的还原糖得率。这表明稻草秸秆经高温预处理后,使其纤维素结晶区受到破坏,半纤维素部分得到降解,有利于木聚糖酶和纤维素酶的酶解,因此,采用高温和酶解的方法能有效将木质纤维转化为可发酵性糖。
[1] 黄忠乾,龙章富.农作物秸杆资源的综合利用[J].资源开发与市场,1999,15(1):32-34.
[2] Nathan Mosier,Charles Wyman,Bruce Dale,et al.Features of promising technologies for pretreatment of lignocellulosic biomass[J].Bioresource Technology,2005,(96):673-686.
[3] 张强,陆军.玉米秸杆制酒精—秸杆预处理及水解方法的探讨[J].酿酒科技,2004,(4):57-58.
[4] 崔永强,林燕,华鑫怡,等.木质纤维素为原料的燃料乙醇发酵技术研究进展[J].化工进展,2010,29(10):1 868-1 876.
[5] Banerjee S,Sen R,Giri B,et al.Commercializing lignocellulosic bioethanol:Technology bottlenecks and possible remedies[J].Biofuels Bioproducts and Biorefining,2010,(4):77-93.
[6] Yang B,Wyman C E.Pretreatment:The key to unlocking low-cost cellulosic ethanol[J].Biofuels Bioproducts and Biorefining,2008,2(1):26-40.
[7] 李建武.生物化学实验原理和方法[M].北京:北京大学出版社,1994:125-132.
[8] Sharmas S K,Kalra K L,Grewal H S.Enzymatic saccharification of pretreated sunflower stalks[J].Biomass and Bioenergy, 2002,23(3):237-243.
[责任编辑:寸晓非]
2014-10-15
安徽省高等学校省级自然科学研究项目(KJ2013Z345);芜湖职业技术学院项目(Wzyzr201405)
程旺开(1972-),男,安徽休宁人,芜湖职业技术学院生物工程学院副教授,硕士。
S216.2
A
1008-4657(2014)06-0053-06

