高中化学教材选修3 中几种常见晶体结构分析归纳
刘子丽
(延边第二中学,吉林 延吉 133000)
一、氯化钠、氯化铯晶体——离子晶体
由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下:
离子数目的计算:在每个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:中心位置上的微粒完全属于该单元,即所占该单元的份额为1,面上的微粒属于该单元中所占的份额为,棱上的微粒属于该单元中所占的份额为,顶点上的微粒属于该单元中所占的份额为。
如:氯化钠晶体中每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,与一个Na+距离最近且相 等的Cl-围成的空间构型为正八面体。每个Na+ 周围与其最近且距离相等的Na+有12个。见图1,图2。

图1
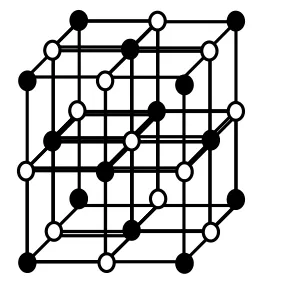
图2 NaCl
再如:氯化铯晶体中每个Cs+周围有8个Cl-,每个Cl-周围有8个Cs+,与一个Cs+距离最近且相等的Cs+有6个。晶胞中平均Cs+个数:1;晶胞中平均Cl-个数:8 ×= 1 。
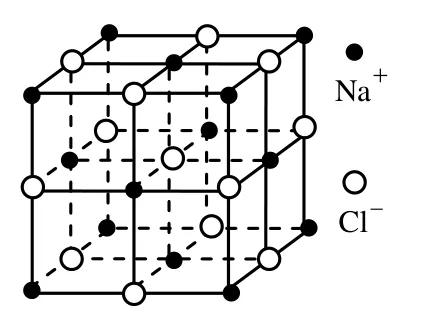
因此CsCl的一个晶胞中含有1个CsCl(1个Cs+和1个Cl-)。
【例题1】NaCl的晶胞如图4,则每个NaCl晶胞所含有的Na+离子和Cl-离子的数目分别是:

图3 CsCl 晶体
A. 8,8 B. 4,4 C. 1,1 D. 14,13 Cl-离子的数目:1 + 1 2 ×= 4 个
二、金刚石、二氧化硅——原子晶体

图4 金刚石晶体

C原子数: C—C键键数 = 1:2; C原子数: 六元环数 = 1:2。
例如:二氧化硅晶体结构与金刚石相似,C被Si代替,每个C与C之间插氧,即为SiO2晶体,则SiO2晶体中最小环为12元环(6个Si,6个O),
即Si : O= 1 : 2,用SiO2表示。
在SiO2晶体中每个Si原子周围有4个氧原子,同时每个氧原子结合2个硅原子。一个Si原子可形成4个Si—O键,1mol Si原子可形成4mol Si—O键。由此有许多学生误认为二氧化硅晶体结构中一个最小的环是由8个原子构成的。事实上,在二氧化硅晶体中每个硅原子与周围的四个氧原子的成键情况与金刚石晶体中的碳原子与周围的其它碳原子连接的情况是相同的。即每个硅原子与周围的四个氧原子构成一个正四面体。只是每个氧原子又处在由另一个硅原子为中心的一个正四面体上。即每个氧原子为两个硅氧四面体所共用。如上图所示。从此图中可以明显看出,构成二氧化硅晶体结构的最小环是由12个原子构成的椅式环,注意图中键角∠O-Si-O=109°28′。

【例题2】(2010年全国卷)下面关于SiO2晶体网状结构的叙述正确的是

A.最小的环上,有3个Si原子和3个O原子
B.最小的环上,Si和O原子数之比为1 : 2
C.最小的环上,有6个Si原子和6个O原子
D.存在四面体结构单元,O处于中心,Si处于4个顶角
解析:二氧化硅是结构为空间网状的原子晶体,存在四面体结构,硅处于四面体的体心,氧处于四面体的4个顶点,在SiO2晶体中,每6个Si和6个O形成一个12元环(最小环),所以C选项正确,A、B、D选项均错误。
点拨:该题主要考查的是考生的空间想象能力和知识迁移能力,选修3教材里面有SiO2晶体结构示意图。再次说明了化学学习要重视研究课本,利用课本,以课本为本。
【例题3】石墨烯的结构示意图如右图,是由碳原子构成的单层片状结构的新材料,可由石墨剥离而成。下列说法正确的是:
A.石墨烯与金刚石互为同位素
B.0.12g 石墨烯中含有的碳原子为:6.02*1023个
C.石墨烯可能是有机物
D.石墨烯中的碳原子和碳原子之间以共价键相结合
解析:同种元素的不同原子之间互称为同位素。对象是原子,A选项错误;有机物是大多数含碳的物质,除了碳单质、一氧化碳、二氧化碳碳酸盐、碳酸氢盐、金属碳化物等,而且有机物一般含有碳和氢元素,C选项不对;从图示可知,石墨烯中碳原子和碳原子之间均为共价键相结合,D选项正确。
三、干冰——分子晶体
干冰晶体是一种立方面心结构,立方体的八个顶点及六个面的中心各排布一个CO2分子,晶胞是一个面心立方。一个晶胞实际拥有的CO2分子数为四个(均摊法),每个CO2分子周围距离相等且最近的CO2分子共有12个。分子间由分子间作用力形成晶体。每个CO2分内存在共价键,因此晶体中既有分子间作用力,又有化学键,但熔、沸点的高低由分子间的作用力决定,重要因素是相对分子质量,因此当晶体熔化时,分子内的化学键不发生变化。
每个结构单元中含CO2分子数目为:
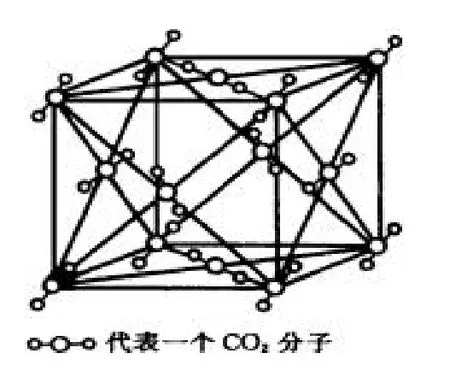
图7 CO2 晶体
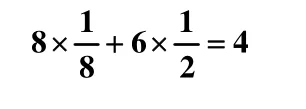
四、石墨——混合型晶体
石墨晶体是层状结构,在每一层内有无数个正六边形,同层碳原子间以共价键结合,晶体中C—C的夹角为120℃,层与层之间的作用力为范德瓦尔斯力,每个C原子被六个棱柱共用,每六个棱柱实际占有的C原子数为2个。

图8 石墨的结构
石墨是一种混合型晶体。独特结构决定了它的特殊性质,该晶体实际介于原子晶体、分子晶体、金属晶体之间,因此具有各种晶体的部分性质特点,如熔点高、硬度小、能导电等。
五、固态金属单质——金属晶体
金属(除汞外)在常温下都是晶体,在金属中,金属原子好像许多硬球一样一层一层紧密地堆积着。每个金属原子周围都有许多相同的金属原子围绕着。其实由于金属原子的最外层电子较少,故金属原子容易失去电子变成金属离子。金属原子释放电子后形成的离子按一定规律堆积,释放的电子则在这个晶体里自由运动,这就是自由电子。在金属晶体的内部,金属离子和自由电子之间存在很强的相互作用,这种作用力便是金属键。因此有人将金属键形象地比喻为金属阳离子沉浸在自由电子的海洋里。
【例题4】铜及其化合物在很多领域有重要的用途,如金属铜用来制造电线、电缆,五水硫酸铜可合成波尔多液,作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+ 的价电子排布式为____。
(2)如右图是铜的某种氧化物的晶胞结构示意图,由此可确定该晶胞中阴离子的个数为____。
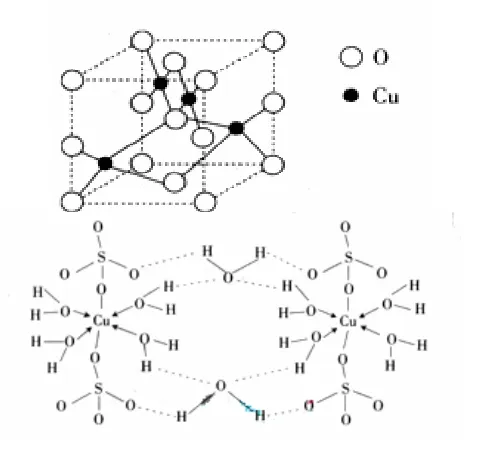
(3)CuSO4·5 H2O俗称胆矾,可写成[Cu(H2O4)]S O4·H2O,其结构示意图如右图所示:下列说法正确的是
A. 在结构示意图中,每个氧原子均采用sp3杂化
B. 在结构示意图中,存在共价键、离子键和配位键
C. 胆矾是分子晶体,分子间存在氢键,属于电解质
D. 胆矾中的结晶水会在不同温度下分步失去
(4)往硫酸铜溶液中加入逐滴滴入过量氨水,可生成[Cu(NH3)4]2+ 配合物离子。已知NH3与NF3的分子空间构型都是三角锥形,但NF3却不易与Cu2+ 形成配离子, 其主要原因是________。
(5)分析Cu2S 的熔点比Cu2O 的熔点 (填“高”或“低”),试分析原因________。
解析:(1)Cu的价电子排布式应为:3d104s1 在Cu → Cu2+ 的过程中,失去的是4s及3d上各一个电子,故Cu2+ 离子的价电子排布式是:3d9;
(2)由图可以知该阴离子在晶胞的位置有四种:顶点有8个、棱上有4个、面上有2个、体心有1个,根据晶胞的分摊法,可知推出该晶胞中含有4个阴离子;(3)胆矾是由水合铜离子和硫酸根离子构成的离子化合物,C错;(4)因为N、F、H的电负性为:F>N>H,所以NH3分子中的共用电子对偏向N原子,而在NF3中,共用电子则对偏向F,进而偏离N原子;(5)由于氧离子的半径小于硫离子的半径,所以氧离子和亚铜离子形成的离子键强于硫离子和亚铜离子形成的离子键,所以Cu2S的熔点比Cu2O的低。

