结肠癌干细胞样细胞的体外培养、鉴定及n-3多不饱和脂肪酸对结肠癌干细胞样细胞的抗增殖作用*
方 仕, 龙健婷, 张 冰, 杨 婷, 卢 味, 李鹤平, 石汉平
(中山大学附属第一医院 1临床营养科, 2肿瘤科, 3核医学科, 5普通外科,广东 广州 510080; 4中山市人民医院重症治疗科,广东 中山 528400)
结肠癌干细胞样细胞的体外培养、鉴定及n-3多不饱和脂肪酸对结肠癌干细胞样细胞的抗增殖作用*
方 仕1, 龙健婷2, 张 冰3, 杨 婷4△, 卢 味1, 李鹤平2, 石汉平5
(中山大学附属第一医院1临床营养科,2肿瘤科,3核医学科,5普通外科,广东 广州 510080;4中山市人民医院重症治疗科,广东 中山 528400)
目的: 采取无血清培养法培养出SW620细胞球,并对细胞球细胞进行干细胞鉴定;在细胞水平研究n-3多不饱和脂肪酸(n-3 PUFAs)对结肠癌干细胞样细胞的作用。方法: 正常培养人结肠癌细胞株SW620并使其逐步适应无血清培养条件,经无血清培养1周后收集SW620细胞球。用免疫荧光法检测胚胎干细胞标志物SSEA-1和TRA-1-81;采用real-time PCR的方法检测干细胞相关基因Sox-2和Oct-4的表达情况;对比SW620贴壁细胞和干细胞样细胞(CSCLC)在软琼脂上的克隆形成能力;采用裸鼠移植瘤模型比较2种细胞的成瘤能力;用MTS法对比2种细胞在递增浓度的5-氟尿嘧啶(5-FU)或mitomycin C处理下的生长抑制情况;用MTS法、Annexin V/PI染色和台盼蓝染色分别观察递增浓度二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)作用于SW620 CSCLC后细胞生长抑制情况、凋亡情况和死亡情况;MTS法检测5-FU或mitomycin C联合n-3 PUFAs对结肠癌CSCLC增殖的影响。结果: 无血清培养法成功从SW620中培养出细胞球。细胞球细胞高表达SSEA-1和TRA-1-81并一过性表达Sox-2和Oct-4基因;对5-FU及mitomycin C相对抵抗;在软琼脂上克隆形成率及在裸鼠皮下的成瘤率均显著高于贴壁细胞,表明这些细胞具有干细胞特性,即为来自于SW620的CSCLC。DHA和(或)EPA作用于SW620 CSCLC能抑制细胞生长、诱导细胞凋亡,并能增强5-FU及mitomycin C对其抑制作用。结论: 无血清培养法能够从SW620细胞中培养出具有干细胞特性的细胞,它们具有高克隆形成能力及高致瘤性,对化疗药物相对抗拒;DHA和EPA能够诱导SW620来源CSCLC发生凋亡并增强化疗药物的抗肿瘤活性。
结肠肿瘤; 肿瘤干细胞; 无血清培养; n-3多不饱和脂肪酸; 化学治疗
结直肠癌(colorectal cancer, CRC)为起源于结直肠黏膜上皮的恶性肿瘤。根据美国的统计数字,进入2014年,预计将有71 830名男性和65 000名女性会被诊断为结直肠癌,而26 270名男性及24 040名女性将死于此病[1]。
Reya等[2]首次提出肿瘤干细胞(cancer stem cell, CSC)学说,认为恶性肿瘤组织中存在一群数量极少的具有干细胞样特性的细胞,这群细胞具有自我更新、无限增殖以及多向分化潜能,而且对传统的抗肿瘤治疗相对抗拒,具有启动和维持肿瘤的能力[3]。日益增加的证据显示几乎所有的实体瘤包括CRC都包含特有的CSC亚群,是导致术后转移和复发、肿瘤耐药及总生存下降的根源[4]。
n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acids, n-3 PUFAs)主要包括α-亚麻酸、二十碳五烯酸(eicosapentenoicacid, EPA)和二十二碳六烯酸(docosahexaenoicacid, DHA)。多年来研究发现,n-3 PUFAs具有调节免疫反应、调节心血管功能、抗动脉硬化、抗炎、抗癌等多种特殊功效[5-6]。n-3 PUFAs已被用于多种恶性肿瘤的辅助治疗,并证实其能通过改变肿瘤细胞生物膜结构和功能、增加肿瘤细胞内脂质过氧化物的产生、促进肿瘤细胞凋亡、调节机体免疫系统及增强化疗药物抗肿瘤效果等机制抑制肿瘤的发生、进展和转移[7-10]。然而,n-3 PUFAs对CSC作用如何,是否能通过抑制CSC达到进一步抑制肿瘤的作用,是否能够提高化疗药物对CSC的杀伤作用,这些问题国内外尚未见文献报道。
本研究首先探讨在体外大量培养、富集结肠癌干细胞样细胞(cancer stem cell-like cells, CSCLC)的方法,并对其干细胞性进行鉴定;研究n-3 PUFAs在体外对结直肠癌CSCLC的作用。
材 料 和 方 法
1 细胞及动物
SW620人结肠癌细胞株购自中国科学院上海细胞生物研究所,正常培养于含有10%小牛血清、5×104U/L青霉素及50 mg/L链霉素的DMEM/F12培养基(Gibco)。培养在37 ℃、5% CO2的湿化培养箱内。逐步降低含血清培养基的比例直至无血清培养,约1周后获得SW620细胞球。无胸腺裸鼠购自中山大学实验动物中心。所有动物实验均遵守中山大学《实验动物管理条例》,并在实验前获得伦理委员会批准。
2 主要方法
2.1 免疫荧光胰酶消化贴壁生长的SW620细胞及细胞球 细胞制成单细胞悬液,制作细胞爬片,4%甲醛固定后以PBS清洗,5% BSA+10%山羊血清封闭后以SSEA-1或TRA-1-81抗体(Cell Signaling)孵育过夜,经PBS及蒸馏水振洗、吹干后滴加荧光素标记Ⅱ抗(1∶150),室温孵育60 min后行DAPI(Invitrogen)染色,封片后4 ℃避光干燥保存24 h后在激光共聚焦显微镜下观察。
2.2 Real-time PCR检测Sox-2和Oct-4 mRNA表达 从细胞球细胞中用Trizol(Invitrogen)提取总RNA,以ReverTra Ace反转录酶(Toyobo)合成cDNA第1链,实时荧光定量PCR实验应用SYBR Green PCR Master Mix(Applied Biosystems)在ABI Prism 7500测序仪(Applied Biosystems)中进行。Sox-2扩增引物序列如下:正义链为5′-ATGCACCGCTACGACGTGA-3′;反义链为 5′-CTTTTGCACCCCTCCCATTT-3′。Oct-4扩增引物序列如下:正义链为5′-CGACCATCTGCCGCTTTGAG-3′;反义链为 5′-CCCCCTGTCCCCCATTCCTA-3′。内参照基因为GAPDH。PCR过程简述如下:95 ℃变性5 min;然后40个循环:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s。mRNA水平用2-ΔΔCt方法分析。
2.3 软琼脂克隆形成实验 将1.32%低熔点琼脂糖与2×细胞培养基以1∶1的体积比混合制备0.66%的底层琼脂,6孔板中每孔1 mL,将0.66%的低熔点琼脂糖与2×细胞培养基以1∶1的体积比混合制备0.33%的上层琼脂,每孔加1 mL。消化贴壁细胞或细胞球细胞成单个细胞,调整单细胞悬液密度为1×107/L,在每孔琼脂平面上加100 μL单细胞悬液(每孔1 000个细胞)。置于37 ℃、5% CO2的细胞培养箱内培养2~3周,计数含50个细胞以上的克隆,计算集落形成率(克隆数/接种细胞数×100%)。
2.4 裸鼠体内成瘤实验 裸鼠分为3组(每组6只),分别接种2×103、2×104和2×105的SW620贴壁细胞(右侧皮下),或细胞球细胞(左侧皮下),每3 d观察肿瘤形成情况,连续观察4周,处死后测量肿瘤大小。
2.5 细胞生长抑制实验 DHA、EPA、5-氟尿嘧啶(5-fluorouracil,5-FU)及丝裂霉素C (mitomycin C)均购自Sigma;DMSO购自北京化工厂。细胞球细胞在96孔板中悬浮培养,加入含10 μmol/L、30 μmol/L、50 μmol/L、70 μmol/L的DHA、EPA或DHA+EPA,或含10-9、10-8、10-7、10-6、10-5mol/L mitomycin C,或2、4、6、8、10 mg/L 5-FU。活细胞琥珀酸脱氢酶能把外源性MTT还原成难溶的紫蓝色formaza结晶并沉积在细胞里,而死细胞无此功能。Formaza结晶溶解于DMSO中,用酶标仪测定570 nm处吸光度(A)值。抑制率(%)=(未加药组A-加药组A)/未加药组A×100%。
2.6 流式细胞术检测细胞凋亡 取10 μmol/L、30 μmol/L、50 μmol/L、70 μmol/L的DHA、EPA或DHA+EPA处理过1 d的干细胞球,按照试剂说明书操作,以Annexin V和PI标记细胞,避光孵育后进行流式细胞仪检测,每次计数10 000个细胞。
3 统计学处理
所有实验均独立重复至少3次。数据以均数±标准差(mean±SD)表示。统计方法采用单因素方差分析或t检验。统计软件使用SPSS 18.0 。以P<0.05为差异有统计学意义。
结 果
1 无血清培养方法得到的SW620细胞球高表达胚胎干细胞表面标志物及干细胞相关基因
SW620细胞于无血清培养液中培养3 d后,可见单层细胞中有些区域逐渐增厚,6~7 d即可离开多层贴壁细胞,最后悬浮于培养液中。镜下观察悬浮细胞结构致密、形态均一、核大、核仁清晰、核质比高,见图1A。共聚焦显微镜下观察,这些来自于细胞球的细胞膜表面表达SSEA-1和TRA-1-81胚胎干细胞标志物,其阳性率显著高于贴壁培养的SW620细胞,见图1B。Real-time PCR检测干细胞相关基因Sox-2和Oct-4在SW620细胞无血清培养第1天至第7天的表达情况,结果表明SW620细胞在形成细胞球的过程中,Sox-2和Oct-4基因表现出启动现象,其表达量在第2~3天最高,而在细胞球已经形成以后,这2个基因的表达量又恢复至培养之初的水平,表明SW620细胞在形成细胞球过程中由分化状态转入未分化状态,见图1C。

Figure 1.SW620 cell line-derived spheroid cells highly expressed embryonic stem cell markers. A: SW620 cells formed spheres in serum-free medium after acclimation gradually for 7 d; B: immunofluorescence staining of spheroid cells and adherent cells with antibodies against SSEA-1 (red) and TRA-1-81 (red); C: the expression levels of pluripotency marker genesSox-2 andOct-4 were examined by real-time PCR during the transformation of SW620 to spheres from 1 d to 7 d.Mean±SD.n=3.*P<0.05vsserum-free medium on day 2;△P<0.05vsserum-free medium on day 3.
图1 无血清培养方法得到SW620细胞球高表达胚胎干细胞表面标志物及干细胞相关基因
2 SW620细胞系来源的细胞球细胞克隆形成能力和成瘤性显著增加,并对化疗药抗拒
在倒置显微镜下对2组细胞所生成的细胞克隆进行观察、计数。结果显示,无血清条件培养下的SW620细胞球消化成单个细胞克隆形成率是(4.44±3.85)%,含10%血清的DMEM/F12培养液培养的SW620细胞克隆形成率为(0.89±0.38)%,两者的克隆形成率差异有统计学意义(P<0.05),见图2A。接种2×103个细胞球细胞组中,2只裸鼠4周后皮下可观察到直径3 mm左右隆起,而贴壁细胞组无一只形成皮下隆起;接种2×104个细胞球细胞组中,2只裸鼠4周后形成皮下移植瘤。而贴壁细胞至少需要2×105个细胞才能形成皮下移植瘤。同样以2×105个细胞接种的情况下,细胞球细胞形成的移植瘤体积为(2 279±346.3)mm3,而SW620贴壁细胞形成的移植瘤体积为(889.8±78.8)mm3(P<0.05)。细胞球细胞具有更强的体内成瘤能力,见图2B。随着浓度的递增,5-FU和mitomycin C对SW620贴壁细胞及细胞球细胞的抑制作用逐渐增强,但细胞球细胞对2种化疗药物的作用较贴壁细胞明显抗拒,见图2C。这些具备干细胞特性的细胞即为SW620 CSCLC。

Figure 2.SW620-derived spheroid cells exhibited greater abilities of clonogenicity and tumorigenicity. A: colony formation in soft agar medium was photographed 3 d, 8 d and 10 d after seeding. The spheroid cells had higher colony formation efficiency as compared to the adherent SW620 cells. B: sorted cells were subcutaneously injected into the dorsal regions of nude mice at a dose of 2×105cells. Spheroid cells produced palpable xenograft tumors at the injection site, while adherent cells didn’t generate tumors. C: 5-FU- or mitomycin C-induced growth inhibition was compared between adherent cells and spheroid cells. Spheroid cells showed higher resistance to both chemotherapeutic drugs compared with adherent cells. Mean±SD.n=3.*P<0.05vsadherent cells.
图2 SW620细胞系来源的细胞球细胞克隆形成能力和成瘤性显著增加,并抗化疗药
3 n-3 PUFAs抑制SW620 CSCLC的增殖
随着DHA、EPA、DHA+EPA浓度从10 μmol/L增加至70 μmol/L,DHA、EPA或2种n-3 PUFAs联合对SW620 CSCLC及贴壁细胞的抑制作用呈增强趋势。结果显示,各浓度n-3 PUFAs对CSCLC的抑制作用以联合组最强,单用DHA组居中,单用EPA组最弱,各组之间差异有统计学意义(P<0.05)。流式细胞术检测Annexin V/PI染色凋亡细胞以及台盼蓝染色死亡细胞计数进一步支持MTS生长抑制实验的结果,即各浓度n-3 PUFAs诱导CSCLC凋亡及促进细胞死亡的作用以联合组最强,单用DHA组居中,单用EPA组最弱,各组之间差异具有统计学意义(P<0.05)。n-3 PUFAs对贴壁细胞同样具有抑制作用,见图3。
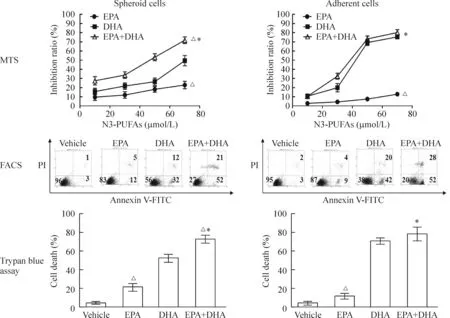
Figure 3.n-3 PUFAs induced apoptotic cell death in both spheroid cells and adherent cells.Mean±SD.n=3.*P<0.05vsEPA alone;△P<0.05vsDHA alone.
图3 n-3 PUFAs对SW620 CSCLC增殖的影响
4 n-3 PUFAs增加SW620 CSCLC对化学治疗药物的敏感性
随着浓度的递增,5-FU及mitomycin C对SW620 CSCLC的生长抑制作用呈现浓度依赖性。2种化疗药物联合EPA(50 μmol/L)或DHA(50 μmol/L),或联合EPA(50 μmol/L)+DHA(50 μmol/L)均较单用化疗药物时对SW620 CSCLC的生长抑制作用增强,该增强作用在联合2种n-3 PUFAs时最为有效。DHA增强化疗药物抑制SW620 CSCLC的作用显著高于EPA,见图4。
讨 论
Hierarchy学说认为肿瘤组织中存在极少数具有无限增殖和自我更新能力、能够导致肿瘤发生的细胞,即“肿瘤干细胞”,它是肿瘤转移、复发及耐药的根源[11]。关于CRC,近年的研究也发现了CSC的存在[3],然而,缺乏公认的结直肠CSC的特异性标志物以及难以获取大量结直肠CSC作为研究对象,影响了人们对结直肠CSC的深入研究。为了解决CSC来源问题,本研究率先进行了包括无血清培养等一系列尝试,并成功从SW620细胞系中培养、稳定传代了具有干细胞特性的细胞,称之为CRC的CSCLC。
实验伊始,我们收集了23例CRC患者原代肿瘤组织,希望通过体外培养获得原代CRC细胞,以便进一步分离、纯化肿瘤干细胞。然而,在对这些原代肿瘤组织进行培养的过程中,屡屡遭遇的污染问题曾一度使实验陷于困境。通过不断总结经验,克服污染后,培养出来的细胞成分复杂,难以去除大量的成纤维细胞,以致所能获得的肿瘤细胞数量稀少,无法连续传代,无法从患者的原代组织中培养出CRC的CSCLC。
以上实验的失败让我们不得不考虑从其它途径获取结直肠CSC。有报道指出,一些哺乳动物的成体干细胞能够在无血清培养基内呈非黏附性球形生长,而大多数已分化的肿瘤细胞由于不能贴壁而发生失巢凋亡,而存活下来的则是一些增殖力强、类似于干细胞样的肿瘤细胞[12]。因此,无血清培养法成为一种有效富集肿瘤干细胞的方法[13]。本实验用无血清培养法培养出SW620细胞球,并且实现在体外的大量繁殖和稳定传代,实验结束时,此细胞球已稳定传至12代,且其干细胞特性并未发生改变。

Figure 4.n-3 PUFAs increased chemosensitivities of SW620 CSCLC to 5-FU and mitomycin C (Mit C). When 5-FU (A) or Mit C (B) were combined with DHA(50 μmol/L), EPA(50 μmol/L), or DHA plus EPA, the therapeutic effects of the chemotherapeutics increased in a dose-dependent manner. The combination of chemodrugs with DHA plus EPA had greater effect than DHA or EPA alone. EPA alone had the weakest effect on chemosensitivity. Mean±SD.n=3.
图4 n-3 PUFAs增加SW620 CSCLC对化学治疗药物的敏感性
对n-3 PUFAs重要性的认识缘于20世纪80年代对爱斯基摩人心血管发病率降低与经常食用深海鱼类有关这一发现。近年来,大量流行病学调查结果提示n-3 PUFAs能预防肿瘤发生、抑制肿瘤生长。已知n-3 PUFAs对CRC的抑制作用主要表现为抑制细胞增殖、迁移,诱导其分化、凋亡和改善患者肿瘤体质等[14]。本研究提出如下假设,n-3 PUFAs亦可以抑制结直肠CSCLC的生长、诱导其凋亡。本研究结果发现,EPA及DHA不仅能够抑制SW620 CSCLC的生长,促使其凋亡,而且能够增强化疗药物抗CSCLC的效果。尽管此前一些动物学实验结果支持在化疗前和化疗过程中使用n-3 PUFAs能够起到良好的增敏作用,但其机制尚不明确。目前认为n-3 PUFAs可能通过以下机制参与调节肿瘤细胞的化疗敏感性:(1)改变肿瘤细胞生物膜的结构和功能[15];(2)增强脂质过氧化作用[16];(3)影响化疗药物的吸收[17];(4)影响核苷类似物的代谢[18];(5)抑制肿瘤血管生成[19]。以上所述机制均为在肿瘤细胞中的研究结果。n-3 PUFAs是否通过相同的机制与化疗药物协同,发挥抑制CSC的作用,将是我们下一步研究的方向。虽然n-3 PUFAs能够与化疗药物协同抗肿瘤这一点尚未得到大规模临床试验的支持,但n-3 PUFAs良好的预防和治疗潜力已收到广泛关注。相信随着研究的不断深入,n-3 PUFAs在未来肿瘤防治中可能作为标准化疗的有效佐剂而拥有更广阔的应用前景[20]。
综上所述,我们用无血清培养法能成功从SW620细胞中分离出CSCLC。它们具有高克隆形成能力及高致瘤性,对化疗药物相对抗拒。DHA和EPA能够抑制SW620来源CSCLC的生长、促使其发生凋亡,并且能够增加SW620 CSCLC对5-FU或mitomycin C的敏感性。
[1] Siegel R, Desantis C, Jemal A. Colorectal cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(2):104-117.
[2] Reya T, Morrison SJ, Clarke MF, et al. Stem cells, can-cer, and cancer stem cells[J]. Nature, 2001, 414(6859):105-111.
[3] O’Brien CA, Pollett A, Gallinger S, et al. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J]. Nature, 2007, 445(7123):106-110.
[4] Papailiou J, Bramis KJ, Gazouli M, et al. Stem cells in colon cancer: A new era in cancer theory begins[J]. Int J Colorectal Dis, 2011, 26(1):1-11.
[5] 王新颖,黎介寿. ω-3多不饱和脂肪酸影响炎症和免疫功能的基础研究[J]. 肠外与肠内营养, 2007, 14(1):54-58.
[6] Miyagawa N, Okuda N, Kadowaki T, et al. Long-chain n-3 polyunsaturated fatty acids intake and cardiovascular di-sease mortality risk in Japanese: a 24-year follow-up of NIPPON DATA80[J]. Atherosclerosis, 2014, 232(2):384-389.
[7] Zhang H, Zhou L, Shi W, et al. A mechanism underlying the effects of polyunsaturated fatty acids on breast cancer[J]. Int J Mol Med, 2012, 30(3):487-494.
[8] 陈小良,李建忠,曾利娴,等. ω-6不饱和脂肪酸促进结肠癌变的实验研究[J]. 中华胃肠外科杂志, 2010, 13(10):774-777.
[9] Calder PC. Fatty acids and immune function: relevance to inflammatory bowel diseases[J]. Int Rev Immunol, 2009, 28(6):506-534.
[10]Kuan CY, Walker TH, Luo PG, et al. Long-chain polyunsaturated fatty acids promote paclitaxel cytotoxicity via inhibition of the MDR1 gene in the human colon cancer Caco-2 cell line[J]. J Am Coll Nutr, 2011, 30(4):265-273.
[11]Gil J, Stembalska A, Resz KA, et al. Cancer stem cells: the theory and perspectives in cancer therapy[J]. J Appl Genet, 2008, 49(2):193-199.
[12]Qiang L, Yang Y, Ma YJ, et al. Isolation and characterization of cancer stem like cells in human glioblastoma cell lines[J]. Cancer Lett, 2009, 279(1):13-21.
[13]魏 红. 无血清培养法在肿瘤干细胞培养中的应用[J]. 济宁医学院学报, 2010, 33(5):370-372.
[14]Stern MC, Butler LM, Corral R, et al. Polyunsaturated fatty acids, DNA repair single nucleotide polymorphisms and colorectal cancer in the Singapore Chinese Health Study[J]. J Nutrigenet Nutrigenomics, 2009, 2(6):273-279.
[15]Corsetto PA, Cremona A, Montorfano G, et al. Chemical-physical changes in cell membrane microdomains of breast cancer cells after omega-3 PUFA incorporation[J]. Cell Biochem Biophys, 2012, 64(1):45-49.
[16]Germain E, Chajès V, Cognault S, et al. Enhancement of doxorubicin cytotoxicity by polyunsaturated fatty acids in the human breast tumor cell line MDA-MB-231: relationship to lipid peroxidation[J]. Int J Cancer, 1998, 75(4):578-583.
[17]Giamarellos-Bourboulis EJ, Mouktaroudi M, Adamis T, et al. n-6 Polyunsaturated fatty acids enhance the activities of ceftazidime and amikacin in experimental sepsis caused by multidrug-resistantPseudomonasaeruginosa[J]. Antimicrob Agents Chemother, 2004, 48(12):4713-4717.
[18]Yonezawa Y, Hada T, Uryu K, et al. Inhibitory effect of conjugated eicosapentaenoic acid on mammalian DNA polymerase and topoisomerase activities and human cancer cell proliferation[J]. Biochem Pharmacol, 2005, 70(3):453-460.
[19]Wen B, Deutsch E, Opolon P, et al. n-3 Polyunsaturated fatty acids decrease mucosal/epidermal reactions and enhance antitumor effect of ionising radiation with inhibition of tumour angiogenesis[J]. Br J Cancer, 2003, 89(6):1102-1107.
[20]Merendino N, Costantini L, Manzi L, et al. Dietary ω-3 polyunsaturated fatty acid DHA: a potential adjuvant in the treatment of cancer[J]. Biomed Res Int, 2013,2013:310186.
Cultivation and identification of human colon cancer stem cell-like cells and antiproliferative effects of n-3 polyunsaturated fatty acids
FANG Shi1, LONG Jian-ting2, ZHANG Bing3, YANG Ting4, LU Wei1, LI He-ping2, SHI Han-ping5
(1DepartmentofClinicNutrition,2DepartmentofMedicinalOncology,3DepartmentofNuclearMedicine,5DepartmentofSurgery,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China;4IntensiveCareUnit,ZhongshanPeople’sHospital,Zhongshan528400,China.E-mail:yangting_1234@aliyun.com)
AIM: To cultivate stem-like spheres from SW620 cell line in the specific serum-free medium and evaluate the features of the cancer stem cells, and to investigate the effects of docosahexaenoic acid (DHA) and eicosapentaenoic acid (EPA) on the growth of SW620 stem cell-like cells. METHODS: Human colon cancer stem cell-like cells (CSCLC) were obtained from SW620 spheres cultured in serum-free medium. These cells were tested for the expression of SSEA-1 and TRA-1-81 by immunofluorescence staining. The mRNA expression of Sox-2 and Oct-4 was detected by real-time PCR. The efficiency of colony formation on a soft agar gel and tumor formation in the nude mice was compared between SW620 adherent cells and CSCLC. The inhibitory effects of 5-fluorouracil (5-FU) and mitomycin C on both types of cells were measured by MTS assay. MTS assay, Annexin V/PI staining and trypan blue staining were used to determine the effects of DHA and EPA on both types of cells. MTS assay was also used to analyze the combined effect of DHA or EPA with chemotherapeutic drugs on SW620 CSCLC. RESULTS: SW620 cells formed spheres in serum-free culture. The cells from spheres highly expressed SSEA-1 and TRA-1-81, transiently expressedSox-2 andOct-4 genes and were more resistant to 5-FU and mitomycin C treatments. These cells exhibited a greater ability in clone formation and tumorigenicity, indicating that these cells carried stem cell-like features, hence were considered SW620-derived CSCLC. DHA and/or EPA suppressed SW620 CSCLC by inhibiting cell growth, inducing cell apoptosis and sensitizing them to chemotherapeutic drugs. CONCLUSION: The cells with stem cell-like features, such as high efficiency in clonogenicity, tumorigenicity and resistance to chemotherapeutic drugs, can be obtained from SW620 spheres cultured in serum-free condition. DHA and EPA induce apoptosis in SW620-derived CSCLC and sensitize them to chemotherapeutic drugs.
Colonic neoplasms; Neoplastic stem cells; Serum-free culture; n-3 Polyunsaturated fatty acids; Chemotherapy
1000- 4718(2014)12- 2135- 07
2014- 06- 09
2014- 10- 24
国家“十一·五”科技支撑计划(No. 2008BAD91B03); 广东省科技计划社会发展项目(No. 2013B021800284); 广东省教育部产学研结合项目(No. 2011B090400558)
R735.34
A
10.3969/j.issn.1000- 4718.2014.12.004
△通讯作者 Tel: 020-87755766-8179; E-mail: yangting_1234@aliyun.com

