新生兔气管软骨细胞的生物学特性*
陈 亮, 庄 建, 孙云霞, 梁穗新, 刘玉梅, 孙 新, 陈燕玲, 何少茹△
(1广东省人民医院儿科,广东省医学科学院, 2广东省心血管病研究所小儿心脏外科,广东 广州 510080)
·实验技术·
新生兔气管软骨细胞的生物学特性*
陈 亮1, 庄 建2, 孙云霞1, 梁穗新1, 刘玉梅1, 孙 新1, 陈燕玲1, 何少茹1△
(1广东省人民医院儿科,广东省医学科学院,2广东省心血管病研究所小儿心脏外科,广东 广州 510080)
目的: 探讨体外分离培养的新生兔气管软骨细胞的生物学特性。方法: 通过酶消化法体外分离培养新生兔气管软骨细胞;倒置显微镜观察软骨细胞形态及生长状况;电镜观察软骨细胞超微结构;运用real-time PCR、免疫细胞化学染色和甲苯胺蓝染色检测气管软骨细胞分泌的细胞外基质成分。结果: 体外分离、培养的兔气管软骨细胞呈短小三角形或不规则形贴壁生长。超微结构显示细胞较多突起,孔隙较多,胞质丰富,细胞器发达,细胞内可见大量蛋白分泌物。软骨细胞表达I、II型胶原、蛋白聚糖等,以II型胶原和蛋白聚糖表达为主。免疫细胞化学染色II型胶原和SOX9阳性,I型胶原弱阳性。甲苯胺蓝染色阳性。结论: 适宜的酶消化单层培养法获得的新生兔气管软骨细胞具有分泌软骨细胞外基质成分的特性,可初步为体外构建组织工程气管治疗新生兔气管狭窄的实验研究提供种子细胞。
新生兔; 气管软骨细胞; 气管狭窄; 种子细胞; 组织工程气管
气管狭窄被定义为由于不同病变所造成气管腔的狭窄,在新生儿中发生率为1%~8%[1]。严重新生儿气管狭窄的治疗仍以外科手术为主[2-3],但是新生儿气管软骨发育不完善,易受损伤、压迫,术后并发症及死亡率较高[4-5]。对于气管狭窄患儿,保证气管软骨的稳定,对于维持气道通畅具有重要的意义[6]。组织工程气管治疗气管狭窄越来越受到关注[1,7-8]。由于气管的环状结构以软骨为主,组织工程气管种子细胞的研究主要集中在软骨细胞领域。目前生物学修复软骨缺陷的金标准是自体获得的软骨细胞移植[8]。尽管从鼻、关节和耳等部位获得的软骨细胞受到关注,但来源于不同解剖部位的软骨细胞用于组织工程气管移植仍存在争议[9-10]。气管软骨组织中只含一种透明软骨细胞,易于分离、成活,且具有良好的生物相容性及分泌蛋白聚糖(proteoglycans, PG)、II型胶原等细胞外基质成分的特性[11]。目前国内外对于气管软骨细胞生物学特性的研究主要是关于猪和成年兔的,尚未见对新生兔气管软骨细胞的详细报道,因此,我们拟在体外分离、培养新生兔气管软骨细胞,并就获得的新生兔气管软骨细胞进行形态学、细胞超微结构、细胞外基质成分(extracellular matrix, ECM)的mRNA及蛋白表达等分析,初步探讨新生兔气管软骨细胞的基本生物学特性,尝试在再生医学基础上为组织工程气管体外构建的动物实验研究初步提供一种可供选择的种子细胞。
材 料 和 方 法
1 动物
新西兰大白兔6只,出生后25~28 d,体重约0.8~1 kg,雄性,由南方医科大学实验动物中心提供。
2 主要试剂
3 主要方法
3.1 新生兔气管软骨细胞的分离及培养 根据参考文献[12]分离培养细胞的方法, 无菌环境下取新西兰新生大白兔气管约2 cm(沿环状软骨下约0.5 cm),放入含有青霉素和链霉素的PBS缓冲液的培养皿中,去除气管表面异物,放入无菌小烧杯中尽量剪碎,约1 mm×1 mm×1 mm,加入5 mL PBS缓冲液冲洗2次,加入0.25%胰酶-EDTA消化液消化30 min,PBS缓冲液冲洗2次,加入2 g/L II型胶原酶(量约气管软骨体积的3倍),37 ℃水浴箱中孵育4 h,每间隔 0.5 h轻摇晃一次,至大部分气管软骨被消化、液体变浑浊时,加10%的胎牛血清1 mL终止消化,经200目尼龙筛过滤网过滤至另一15 mL离心管,保留滤液,1 500 r/min离心5 mim,去上清,加入5 mL完全培养基(DMEM/F12、10%胎牛血清、双抗)混匀后移入75 cm2培养瓶,放入37 ℃、5% CO2培养箱中培养。每天倒置显微镜下观察细胞形态变化,初始第3天换1次液,随后隔天换1次液,待细胞长至90%以上时传代。
3.2 扫描及透视电镜观察第1代(passage 1,P1)软骨细胞的超微结构 将培养的P1新生兔气管软骨细胞经0.25%胰酶-EDTA消化液消化收集,以PBS溶液清洗,离心成团后加2.5%的戊二醛固定送检。
3.3 气管软骨细胞总RNA提取及real-time PCR 实验组为P1和P6气管软骨细胞,对照组为骨髓间充质干细胞。取各组细胞进行诱导实验 根据我们前期报道的方法[13]用TRIzol提取P1和P6新生兔气管软骨细胞和骨髓间充质干细胞的总RNA,使用逆转录试剂盒PrimeScriptTMRT Master Mix 获得cDNA(反应条件:37 ℃ 15 min×3次,85 ℃ 5 s,4 ℃ 2 h),荧光定量PCR过程使用荧光定量试剂盒SYBR Premix Ex TaqTM(反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s)。引物序列见表1,由Invitrogen公司设计,内参照为GAPDH。在PCR反应中,将正常的骨髓间充质干细胞作为对照组。Real-time PCR由荧光定量PCR仪自动采集目的基因与内参照基因的Ct值,各个基因的基因表达量根据公式2-ΔΔCt计算。

表1 Real-time PCR引物序列
F:forward; R:reverse.
3.4 免疫细胞化学染色检测I、II型胶原及转录因子SOX9表达 将接种于培养皿中的P1和P6气管软骨细胞用PBS洗1 min×3次,用0.25%胰酶消化细胞;将细胞按1×109/L加入到放有无菌盖玻片的6孔板中,待细胞长满,用PBS洗5 min×3次,加入4%多聚甲醛固定20 min;用PBS洗5min×3次,加入0.5% 的Triton X-100作用20 min;PBS洗3次,3%双氧水作用20 min,PBS洗3次;10%正常山羊血清封闭液封闭30 min,加入Ⅰ抗(1∶100),4 ℃过夜,滴加Ⅱ抗37 ℃作用30 min,DAB显色,加入苏木素染色10 min,流水冲洗终止染色;将盖玻片取出,中性树胶封片,共聚焦显微镜下观察。
3.5 甲苯胺蓝染色检测蛋白聚糖 将长满85%以上形成集落的P1和P6气管软骨细胞的培养皿用PBS冲洗2次,勿将细胞冲洗掉,1%甲苯胺蓝染液加入培养孔中,放入5% CO2培养箱中孵育2~3 h,去除甲苯胺蓝染液,用PBS洗3次,倒置显微镜观察。
“先吃一点吧”,黑背心从床下拉出一个包,“等完事了,你想怎么潇洒就怎么潇洒去!”他给我扔来两包锅巴,又甩来一瓶纯净水。
4 统计学处理
用SPSS 13.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,两组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 新生兔气管软骨细胞的分离、培养
原代软骨细胞培养24 h后,部分软骨细胞成短小的多角形或不规则形贴壁生长,胞核清晰,细胞外基质折光性强,第6天细胞聚集形成明显集落,增殖速度加快,约7~10 d细胞融合达90%以上;传代的细胞贴壁迅速,约4~5 h部分贴壁,24 h已大部分贴壁,部分呈集落生长,4~5 d已融合达90%以上,呈鱼群样分布;传代的软骨细胞传至P6,培养3~4 d仍呈多角形或不规则形贴壁且呈集落生长,胞核清晰,见图1。

Figure 1.Culture of chondrocytes (×200). A: P0 chondrocytes, cultured for 24 h; B: P0 chondrocytes, cultured for 6 d; C: P1 chondrocytes, cultured for 24 h; D: P1 chondrocytes, cultured for 4~5 d; E: P6 chondrocytes, cultured for 3~4 d.
图1 新生兔气管软骨细胞的分离、培养结果
2 电镜观察P1软骨细胞的超微结构
扫描电镜示,新生兔气管软骨细胞较多突起,有伪足,孔隙较多,胞质丰富,细胞表面见颗粒状物质,见图2。透射电镜示:胞质丰富,粗面内质网、线粒体等细胞器发达,胞内可见空泡形成,有单个或成对的细胞核,细胞内可见大量蛋白分泌物,见图3。
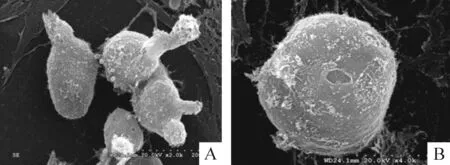
Figure 2.P1 chondrocytes observed by scanning electron micro-scopy (A: ×2 000; B: ×4 000).
图2 第一代软骨细胞扫描电镜观察结果

Figure 3.P1 chondrocytes observed by transmission electron microscopy(A: ×6 000; B: ×10 000).
图3 第一代软骨细胞透射电镜观察结果
3 Real-time PCR检测气管软骨细胞I、II型胶原及蛋白聚糖mRNA的表达
P1和P6气管软骨细胞均表达I、II型胶原和蛋白聚糖,且以II型胶原和蛋白聚糖的表达为主;与对照组骨髓间充质干细胞比较,上述指标达水平明显增高(P<0.05),见表2、3。
表2 Real-time PCR检测P1软骨细胞COL2A、COL1A及PG mRNA的表达
Table 2.The mRNA expression of COL2A, COL1A and PG in the P1 chondrocytes determined by real-time PCR (Mean±SD.n=3)

CellsCOL2ACOL1APGBMMSCs1.0001.0001.000Chondrocytes23.664±1.389**5.416±1.756*7.521±0.303**
TableP<0.05,**P<0.01vsBMMSCs.
表3 Real-time PCR检测P6软骨细胞 COL2A、COL1A及PG mRNA的表达
Table 3.The mRNA expression of COL2A, COL1A and PG in the P6 chondrocytes determined by real-time PCR (Mean±SD.n=3)
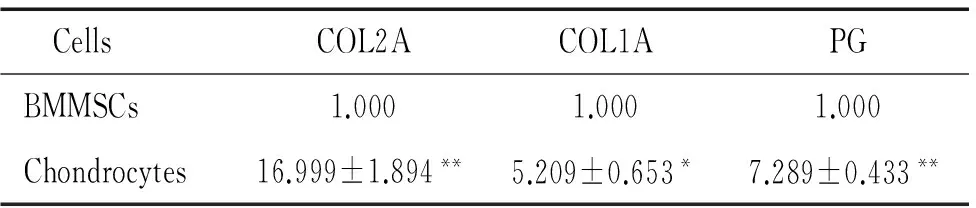
CellsCOL2ACOL1APGBMMSCs1.0001.0001.000Chondrocytes16.999±1.894**5.209±0.653*7.289±0.433**
TableP<0.05,**P<0.01vsBMMSCs.
4 细胞免疫化学染色
P1气管软骨细胞II型胶原、I型胶原和SOX9免疫细胞化学染色后, 细胞胞浆染成红色,核质分界清晰,且与II型胶原染色相比,I型胶原染色仅部分细胞染成红色,部分细胞浅染,见图4;P6气管软骨细胞II型胶原和蛋白聚糖免疫细胞化学染色后胞核呈蓝色,胞浆呈红色,且两者分界清晰,见图5。
5 甲苯胺蓝染色检测气管软骨细胞分泌的蛋白聚糖
经甲苯胺蓝染色,P1和P6气管软骨细胞细胞核染成深蓝色,细胞质及周围组织染成蓝紫色,胞核清晰,见图6、7。

Figure 4.Immunohistochemical staining of the P1 chondrocytes (×200). A: negative control; B: COL1A; C: COL2A; D: SOX9.
图4 第1代软骨细胞免疫细胞化学染色结果

Figure 5.Immunohistochemical staining of the P6 chondrocytes (×400). A: negative control; B: COL2A; C: PG.
图5 第6代软骨细胞免疫细胞化学染色结果

Figure 6.P1 chondrocytes with toluidine blue staining (×100). A: unstained chondrocytes; B: stained chondrocytes.
图6 第1代软骨细胞甲苯胺蓝染色结果

Figure 7.P6 chondrocytes with toluidine blue staining (×200). A: unstained chondrocytes; B: stained chondrocytes.
图7 第6代软骨细胞甲苯胺蓝染色结果
讨 论
再生医学中,种子细胞是构建组织工程气管的三个要素之一[1, 14]。作为组织工程气管种子细胞的软骨细胞主要来源有2个:(1)气管、鼻间隔、肋软骨、关节或耳等软骨组织[9-11];(2)干细胞诱导分化。目前来源于不同解剖部位的细胞用于组织工程气管细胞移植仍存在争议。Kojima等[10]认为耳软骨用于重建气管组织时不能提供理想的机械性能,鼻软骨细胞可用于组织工程气管细胞移植。但是Henderson等[9]通过研究发现关节或鼻的软骨细胞形成的软骨材料缺乏完整的机械性能及硬度,耳软骨却具有一定的机械性能,认为在同等环境下,仅耳软骨细胞在体内喉气管重建中可产生合适的组织工程软骨。经生长因子等不同因素刺激间充质干细胞诱导分化成软骨细胞应用较广泛,但是诱导分化成的软骨细胞产生的软骨质量明显低于正常软骨细胞产生的软骨质量[15-17]。气管是理想的软骨细胞获取部位。气管软骨组织中只含一种透明软骨细胞,易于分离,且细胞氧耗低,易成活,具有良好的物理性质及生物相容性,体外有少量的气管软骨就可以培养出足够的软骨细胞,并在体内环境下形成气管软骨结构,能作为一种细胞来源去构建组织工程气管以替换狭窄的气管[11]。但是成年兔气管软骨细胞在体外随着传代次数的增多,细胞易失去原有的形态和生物学特征,出现去分化现象[18-20]。对于新生兔气管软骨细胞的生物学特性,目前研究仍未见详细的报道。因此,作为新生兔组织工程气管体外构建可选择的种子细胞之一,需要进一步在体外分离培养新生兔气管软骨细胞的情况下,探讨其生物学特性。
从软骨组织中分离培养出软骨细胞最常用的是酶消化贴壁筛选(单层培养)法[9,11-12,21],其次是组织块法。酶消化贴壁筛选法,是利用II型胶原酶和胰蛋白酶-EDTA消化液消化软骨组织,获得软骨细胞,进行单层培养,并通过反复换液去除悬浮细胞而获得纯度较高的软骨细胞,在临床及试验中广泛应用。组织块法是直接取软骨组织进行培养,操作相对简单,但培养时间较长,所获得的软骨细胞纯度不够。因此,本实验采用酶消化贴壁筛选方法成功分离培养新生兔气管软骨细胞,并通过细胞形态学、超微结构和细胞分泌的细胞外基质成分等方面初步明确新生兔气管软骨细胞的生物学特性。
本实验对分离培养的新生兔气管软骨细胞在倒置显微镜下观察发现:所分离培养的新生兔气管软骨细胞为短小三角形或不规则形,生长至一定程度后呈铺路石子样聚集,传代后细胞生长旺盛,短时间内可形成鱼群样聚集,细胞融合达95%以上,传代至第6代时仍保持良好的生长状态。大量文献报道体外培养软骨细胞易受到生长因子[22]、年龄[23]、力学[24]、氧气[25]等多种因素通过物理环境和化学因子之间的相互刺激作用影响。从本实验新生兔气管软骨细胞的生长变化观察发现,在37 ℃、5% CO2环境中培养的早期,软骨细胞生长缓慢,随后生长显著加快,传代后生长旺盛,考虑对于新生兔气管软骨细胞,初期生长缓慢可能与接种的细胞密度低、从活体环境进入体外培养时因其生存环境和生长所需营养物质发生改变而需要一段时间适应新的环境以及细胞内部自分泌、细胞与细胞之间相互作用不充分等有关;随着时间的延长,细胞逐渐适应环境,其数目增多,细胞内部及细胞与细胞之间相互作用增强,细胞生长速度明显加快,这种变化符合正常细胞的生长特性。
软骨细胞的形成是通过软骨细胞外基质标记性基因的表达及蛋白的合成作为其特征[26]。细胞外基质是由一个复杂的网状结构分子组成,包括弹性蛋白、胶原蛋白和蛋白聚糖等多种成分,其通过众多糖蛋白及生长因子、细胞因子及腺体等调节细胞粘附、迁移和发挥功能[27]。细胞外基质可存在于细胞周围、细胞内及细胞间,在固体基质内,50%~75%是胶原(包括I、II型胶原,但以II型胶原为主)、15%~30%是蛋白聚糖[28-29]。软骨细胞的增殖、分化和自身稳态同时受到细胞外基质、可溶性介质及组成这些细胞的基因相互作用调控影响[30]。软骨细胞形成与转录因子SOX9、 COMP、蛋白聚糖和II型胶原(COL2A)等基因的表达上调有关[31]。评估软骨细胞表型常用的2个分子标志物是COL2A基因(编码软骨特异性的Ⅱ型胶原)与蛋白聚糖基因;且所有的软骨及骨祖细胞都来源于SOX9表达的细胞,软骨主要调控因子SOX9上调II型胶原的表达,可促进软骨细胞的形成,并抑制软骨细胞过度增生[32-33];在上呼吸道软骨发育过程中,SOX9募集细胞向软骨细胞系谱生长并表达软骨细胞特异性基因如COL2A,对调节细胞向软骨细胞系谱的表达及正常上呼吸道软骨的发育具有重要作用[6, 18]。本实验发现P1和P6新生兔气管软骨细胞分泌的I型胶原、II型胶原、SOX9和蛋白聚糖等细胞外基质成分在mRNA和蛋白水平均有表达,且以II型胶原和蛋白聚糖表达为主,这与文献关于气管软骨细胞主要分泌II型胶原和蛋白聚糖等细胞外基质成分的报道相一致[19-20, 29]。本实验同时对软骨细胞超微结构观察也显示新生兔气管软骨细胞在培养中会出现伪足,孔隙较多,胞质丰富,细胞表面见颗粒状物质; 且细胞器发达,有单个或成对的细胞核,胞质中可见空泡;细胞内可见大量蛋白分泌物,与文献报道相符[34]。以上结果说明新生兔气管软骨细胞传代至第6代时仍具有分泌细胞外基质成分的生物学特性。
综上所述,本研究通过酶消化单层培养法成功进行新生兔气管软骨细胞体外分离、培养,并对新生兔气管软骨细胞从形态学、超微结构、mRNA表达以及蛋白水平等进行了较全面的生物学特性的探讨,初步认为新生兔气管软骨细胞具有分泌细胞外基质成分的生物学特性,可为组织工程气管体外构建提供一种供选择的种子细胞。
致谢:感谢“十二五”国家科技支撑计划及广东省心血管病研究所研究生经费资助,感谢广东省人民医院医学研究中心实验室及工作人员提供支持和无私的帮助服务。
[1] Kalathur M, Baiguera S, Macchiarini P. Translating tissue-engineered tracheal replacement from bench to bedside[J]. Cell Mol Life Sci, 2010, 67(24):4185-4196.
[2] Toma M, Kamagata S, Hirobe S, et al. Modified slide tracheoplasty for congenital tracheal stenosis[J]. J Pediatr Surg, 2009, 44(10):2019-2022.
[3] Fiore AC, Brown JW, Weber TR, et al. Surgical treatment of pulmonary artery sling and tracheal stenosis[J]. Ann Thorac Surg, 2005,79(1):38-46.
[4] Liu KS, Liu YH, Peng YJ, et al. Experimental absorbable stent permits airway remodeling[J]. J Thorac Cardiovasc Surg, 2011, 141(2):463-468.
[5] Elliott M, Roebuck D, Noctor C, et al. The management of congenital tracheal stenosis[J]. Int J Pediatr Otorhinolaryngol, 2003, 67(11):S183-S192.
[6] Elluru RG, Thompson F, Reece A, et al. Fibroblast growth factor 18 gives growth and directional cues to airway cartilage[J]. Laryngoscope, 2009, 119(6):1153-1165.
[7] Elliott MJ, De Coppi P, Speggiorin S, et al. Stem-cell-based, tissue engineered tracheal replacement in a child: a 2-year follow-up study[J]. Lancet, 2012, 380(9846):994-1000.
[8] McCarthy HE, Bara JJ, Brakspear K, et al. The comparison of equine articular cartilage progenitor cells and bone marrow-derived stromal cells as potential cell sources for cartilage repair in the horse[J]. Vet J, 2012, 192(3):345-351.
[9] Henderson JH, Welter JF, Mansour JM, et al. Cartilage tissue engineering for laryngotracheal reconstruction: comparison of chondrocytes from three anatomic locations in the rabbit[J]. Tissue Eng, 2007, 13(4):843-853.
[10]Kojima K, Bonassar LJ, Roy AK, et al. A composite tissue-engineered trachea using sheep nasal chondrocyte and epithelial cells[J]. FASEB J, 2003,17(8):823-828.
[11]Komura M, Komura H, Tanaka Y, et al. Human tracheal chondrocytes as a cell source for augmenting stenotic tracheal segments: the first feasibility study in aninvivoculture system[J]. Pediatr Surg Int, 2008, 24(10):1117-1121.
[12]Kojima K, Bonassar LJ, Ignotz RA, et al. Comparison of tracheal and nasal chondrocytes for tissue engineering of the trachea[J]. Ann Thorac Surg, 2003, 76(6):1884-1888.
[13]陈 亮,何少茹,庄 建,等. 骨髓间充质干细胞向软骨细胞的分化[J]. 中国组织工程研究, 2013, 17(27):4951-4957.
[14]田 军,王跃建,柯 晖,等. 成年比格犬骨髓间充质干细胞体外软骨方向分化的实验研究[J]. 中国病理生理杂志, 2006, 22(8):1581-1585.
[15]Connelly JT, Wilson CG, Levenston ME, et al. Characterization of proteoglycan production and processing by chondrocytes and BMSCs in tissue engineered constructs[J]. Osteoarthritis Cartilage, 2008, 16(9):1092-1100.
[16]Erickson IE, Huang AH, Chung C, et al. Differential maturation and structure-function relationships in mesenchymal stem cell- and chondrocyte-seeded hydrogels[J]. Tissue Eng, 2009, 15(5):1041-1052.
[17]Huang AH, Stein A, Mauck RL. Evaluation of the complex transcriptional topography of mesenchymal stem cell chondrogenes is for cartilage tissue engineering[J]. Tissue Eng, 2010, 16(9):2699-2708.
[18]Elluru RG, Whitsett JA. Potential role of SOX9 in patterning tracheal cartilage ring formation in an embryonic mouse model[J]. Arch Otolaryngol Head Neck Surg, 2004, 130(6):732-736.
[19]Moreira-Teixeira LS, Georgi N, Leijten J, et al. Cartilage tissue engineering[J]. Endocr Dev, 2011, 21:102-115.
[20]Keeney M, Lai JH, Yang F. Recent progress in cartilage tissue engineering[J]. Curr Opin Biotechnol, 2011, 22(5):734-740.
[21]Lin CH, Hsu SH, Huang CE, et al. A scaffold-bioreactor system for a tissue-engineered trachea[J]. Biomaterials, 2009, 30(25):4117-4126.
[22]Bai X, Li G, Zhao C, et al. BMP7 induces the differentiation of bone marrow-derived mesenchymal cells into chondrocytes[J]. Med Biol Eng Comput, 2011, 49(6): 687-692.
[23]Erickson IE, van Veen SC, Sengupta S, et al. Cartilage matrix formation by bovine mesenchymal stem cells in three-dimensional culture is age-dependent[J]. Clin Orthop Relat Res, 2011, 469(10):2744-2753.
[24]Kelly DJ, Jacobs CR. The role of mechanical signals in regulating chondrogenesis and osteogenesis of mesenchymal stem cells[J]. Birth Defects Res C Embryo Today, 2010, 90(1):75-85.
[25]Buckley CT, Vinardell T, Kelly DJ. Oxygen tension differentially regulates the functional properties of cartilaginous tissues engineered from infrapatellar fat pad derived MSCs and articular chondrocytes[J]. Osteoarthritis Cartilage, 2010, 18(10):1345-1354.
[26]Perrier E, Ronziere MC, Bareille R, et al. Analysis of collagen expression during chondrogenic induction of human bone marrow mesenchymal stem cells[J]. Biotechnol Lett, 2011, 33(10):2091-2101.
[27]Korpos E, Wu C, Sorokin L. Multiple roles of the extracellular matrix in inflammation[J]. Curr Pharm Des, 2009, 15(12):1349-1357.
[28]Schulz RM, Bader A. Cartilage tissue engineering and bioreactor systems for the cultivation and stimulation of chondrocytes[J]. Eur Biophys J, 2007, 36(4-5):539-568.
[29]Mahnoudifar N, Doran PM. Chondrogenesis and cartilage tissue engineering the longer road to technology development[J]. Trends Biotechnol, 2012, 30(3):166-176.
[30]Goessler UR, Hormann K, Riedel F. Tissue engineering with chondrocytes and function of the extracellular matrix (Review)[J]. Int J Mol Med, 2004, 13(4):505-513.
[31]Tan SL, Sulaiman S, Pingguan-Murphy B, et al. Human amnion as a novel cell delivery vehicle for chondrogenic mesenchymal stem cells[J]. Cell Tissue Bank, 2011, 12(1):59-70.
[32]Bobick BE, Chen FH, Le AM, et al. Regulation of the chondrogenic phenotype in culture[J]. Birth Defects Res C Embryo Today, 2009, 87(4):351-371.
[33]Quintana L, zur Nieden NI, Semino CE. Morphogenetic and regulatory mechanisms during developmental chondrogenesis: new paradigms for cartilage tissue engineering[J]. Tissue Eng Part B Rev, 2009, 15(1):29-41.
[34]Xu H, Shi HC, Zang WF, et al. An experimental research on cryopreserving rabbit trachea by vitrification[J]. Cryobiology, 2009, 58(2):225-231.
Biological characteristics of newborn rabbit tracheal chondrocytes
CHEN Liang1, ZHUANG Jian2, SUN Yun-xia1, LIANG Sui-xin1, LIU Yu-mei1, SUN Xin1, CHEN Yan-ling1, HE Shao-ru1
(1DepartmentofNeonatology,GuangdongGeneralHospital/GuangdongAcademyofMedicalSciences,2DepartmentofPediatricCardiacSurgery,GuangdongCardiovascularInstitute,Guangzhou510080,China.E-mail:hsr1605@126.com)
AIM: To investigate the biological characteristics of newborn rabbit tracheal chondrocytesinvitro. METHODS: Newborn rabbit tracheal chondrocytes were obtained by the method of enzyme digestion, and then cultured in monolayerinvitro. Morphological and growth observations were performed under inverted phase contrast microscope. The ultrastructures of the cells were observed under scanning electron microscope and transmission electron microscope. The biological characteristics of secreted extracellular matrix components were detected by real-time PCR, immunocytochemistry staining and toluidine blue staining. RESULTS: Newborn rabbit tracheal chondrocytes isolated and culturedinvitroshowed short triangular or irregular shapes, and adherent growth very well. The ultrastructures of the cells showed pore and abundant cytoplasm and organelles, with a lot of protein secretions in the cells. The chondrocytes expressed the mRNA of collagen I, collagen II and proteoglycans, mainly collagen II and proteoglycans. Immunocytochemistry staining showed collagen II and SOX9 positive, and collagen I weakly positive. Toluidine blue staining was also positive. CONCLUSION: Enzyme digestion and monolayer culture are suitable method to obtain newborn rabbit tracheal chondrocytes. These cells, secreting extracellular matrix components, are able to be selected as seed cells for tissue engineering of tracheainvitro, and used to study the therapeutic method for neonatal rabbit tracheal stenosis.
Newborn rabbits; Tracheal chondrocytes; Tracheal stenosis; Seed cells; Tissue-engineered trachea
1000- 4718(2014)12- 2294- 06
2014- 07- 02
2014- 09- 13
“十二五”国家科技支撑计划(No.2011BAI11B22)
R329.2+1
A
10.3969/j.issn.1000- 4718.2014.12.033
△通讯作者 Tel: 020-83827812; E-mail: hsr1605@126.com

