美沙拉嗪对DSS诱导小鼠溃疡性结肠炎模型Th1、Th17及Treg细胞亚群的影响*
祝 斌, 张寒仙, 曾今诚, 安博然, 徐军发 , 舒建昌△
(1暨南大学第一临床医学院, 广东 广州 510632; 2广东医学院检验医学研究所,广东 东莞 524808;3广东医学院,广东 湛江 524023; 4广东省医学分子诊断重点实验室,广东 东莞 524808)
美沙拉嗪对DSS诱导小鼠溃疡性结肠炎模型Th1、Th17及Treg细胞亚群的影响*
祝 斌1, 张寒仙2,3, 曾今诚2,4, 安博然3, 徐军发2,4, 舒建昌1△
(1暨南大学第一临床医学院, 广东 广州 510632;2广东医学院检验医学研究所,广东 东莞 524808;3广东医学院,广东 湛江 524023;4广东省医学分子诊断重点实验室,广东 东莞 524808)
目的: 观察葡聚糖硫酸钠(DSS)诱导小鼠溃疡性结肠炎(UC)模型中辅助性T细胞(Th1、Th17亚群)及调节性T细胞(Treg)细胞亚群的变化,探讨美沙拉嗪(MSLZ)治疗UC的免疫学机制。方法: 采用流式细胞分析术检测DSS诱导的小鼠UC模型结肠组织及外周血单个核细胞中白细胞介素17(IL-17)、γ-干扰素(IFN-γ)及核转录因子Foxp3的表达,并检测MSLZ预治疗对小鼠UC 模型Th1、Th17和Treg亚群的影响。结果: 在DSS诱导的小鼠UC模型中,其外周血单个核细胞(PBMC)中CD3+T细胞高表达IL-17、IFN-γ及Foxp3,肠黏膜单个核细胞(LPMC)中CD3+T细胞高表达IFN-γ和Foxp3,但IL-17的表达与对照组无差异。进一步发现UC模型小鼠LPMC中Th17、Th1和Treg均显著高于对照组,但PBMC中只有Treg高于对照组。MSLZ预治疗能显著下调UC 模型小鼠PBMC和LPMC中Th17、Th1和Treg细胞亚群。结论: DSS诱导的小鼠 UC模型中CD4+T细胞亚群Th1、Th17及Treg细胞显著升高,提示CD4+T细胞亚群在UC发病中起重要作用,美沙拉嗪可能通过调节Th1、Th17及Treg细胞亚群发挥抗炎及治疗UC作用。
葡聚糖硫酸钠; 溃疡性结肠炎; 美沙拉嗪
溃疡性结肠炎(ulcerative colitis, UC)是炎症性肠病的一种,是一类病因不明的以胃肠道慢性非特异性炎症为主要表现的疾病,近年来成为消化系统常见的疾病,其主要临床表现为腹痛与腹泻[1]。关于其病因目前大多数研究认为与环境、遗传、感染及免疫学因素相关,而免疫学因素被认为与UC的发生发展密切相关,CD4+T细胞亚群在UC发病中尤为重要[2]。本研究通过检测葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠UC模型结肠组织及外周血单个核细胞中CD4+T细胞胞内IL-17、IFN-γ和核转录因子Foxp3的表达,观察UC小鼠模型CD4+T细胞亚群的改变,并研究美沙拉嗪(mesalazine,MSLZ)预治疗对各CD4+T细胞亚群的影响,探讨UC可能的发病机制及美沙拉嗪治疗UC的免疫学机制。
材 料 和 方 法
1 实验材料
无病原环境出生的C57BL/6小鼠(6~8周龄)(购自广东省实验动物中心)。DSS分子量为35 000~40 000,购自MP。抗小鼠CD3-PE-Cy7(BioLegend);抗小鼠CD4- FITC、抗小鼠CD272-APC、抗小鼠 IL-17- PE、抗小鼠 IFN-γ PerCP-Cy5.5和抗小鼠 Foxp3 -PE-Cy5.5均购自eBioscience。流式细胞仪为BD 产品。破膜剂为杭州联科生物公司产品。美沙拉嗪为葵花药业产品。大便隐血试剂盒为南京建成生物工程研究所产品。胶原酶II为Sigma产品。
2 UC模型制作与观察
参阅文献[3-4]制作UC模型,取小鼠16只,随机分为对照组(Con组)和实验组(DSS组),每组8只小鼠,2组小鼠性别比、周龄、健康状况及体重均无统计学差异,可进行后续实验。Con组小鼠给予自来水自由饮用,DSS组给予5% DSS(用水溶解)自由饮用,各组小鼠实验时间为7 d,第8天处死小鼠。造模后每天观察小鼠活动情况、毛色变化、大便性状、颜色及有无出血等情况。
3 美沙拉嗪干预治疗
取小鼠8只,给予5% DSS造模,在造模的同时给予美沙拉嗪治疗,作为美沙拉嗪治疗组(MSLZ组),每天用美沙拉嗪(缓释颗粒;商品名:艾迪莎)灌胃治疗,按实验动物与人体表面积比等效剂量换算比率,将每天剂量折算成小鼠等效剂量作为中剂量用量[小鼠用量(g/kg)=人每天口服药量(g)×0.0026/0.02kg],时间为7 d,同样每天观察小鼠活动情况、毛色变化、大便性状、颜色及有无出血等情况。
4 外周血单个核细胞分离
第8天取小鼠内眦静脉血,用EDTA-K2抗凝,采用Ficoll-Hypaque密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cells,PBMC),对细胞进行活性检测和计数后重悬于含2% 胎牛血清的PBS中,备用。
5 结肠黏膜固有层单个核细胞分离
小鼠结肠黏膜固有层单个核细胞(lamina propria mononuclear cells,LPMC)的分离参阅文献[5]方法进行。取小鼠肛门至盲肠末端结肠,纵切,去内容物,将组织剪碎足够小,于含EDTA和二硫苏糖醇(dithi othreitol, DTT)的PBS液中孵育30 min,离心,重复2次。将组织置于酶液(胶原酶II 含量为0.5 g/L的RPMI-1640)中,37℃水浴消化30 min,离心,过滤,收集滤液,回收滤渣重复消化1次,收集所有滤液加入到含有小鼠淋巴细胞分离液的离心管中离心,采用Ficoll-Hypaque密度梯度离心法分离单个核细胞,2% FBS-PBS洗涤,对细胞进行活性检测和计数后重悬于含2%胎牛血清的PBS中,备用。
6 流式细胞术检测T细胞亚群胞内细胞因子
将分离的单个核细胞分成4份,每份细胞数为1×106,加PMA/Iono Mixture 体外37 ℃、5% CO2培养箱孵育4 h,最后2 h加BFA孵育,洗涤,1份加同型对照抗体,其余3份分别加入CD3-PE-Cy7/CD4-FITC混合抗体和CD3-PE-Cy7/CD8-PE混合抗体,避光孵育25 min,PBS洗涤,加破膜剂A 液100 μL避光孵育15 min,PBS洗涤,加破膜剂B液100μL,同时分别加入IL-17-PE/IFN-γ-PerCp-Cy5.5混合抗体、Foxp3-PE-Cy5.5和IFN-γ-PerCp-Cy5.5,避光孵育25 min,洗涤,固定,上流式细胞仪分析。
7 病理组织分级标准
0级:黏膜固有层无中性粒细胞浸润;Ⅰ级:固有层有少量中性粒细胞浸润(<10 cells/HPF),并累及部分隐窝;Ⅱ级:固有层明显中性粒细胞浸润(10~50 cells/HPF),累及50%以上隐窝;Ⅲ级:固有层大量中性粒细胞浸润(>50 cells/HPF),同时伴有隐窝脓肿;Ⅳ级:固有层明显急性炎症伴有溃疡形成。
8 统计学处理
采用SPSS 16.0软件进行数据分析。计量资料用均数±标准差(mean±SD)表示,组间均数比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 成功建立了小鼠UC模型
DSS诱导的模型组小鼠第4天开始体重出现下降,到第7天体重下降超过15%,MSLZ组小鼠体重自第5天开始出现体重下降,体重下降不超过5%,而对照组体重无明显降低;第4天出现血便,对照组小鼠大便隐血均为阴性,MSLZ组小鼠有2只第5天大便隐血试验阳性;DSS组小鼠7 d内无死亡,MSLZ灌胃治疗组无死亡情况;肠道组织HE染色显示DSS组结肠陷窝消失、腺体减少,大量炎症细胞浸润,对照组结肠结构无明显异常,MSLZ组陷窝、腺体结构清晰,少量炎症细胞浸润,见图1。
各组小鼠病理组织学分级比较:DSS组组织学分级大部分小鼠为Ⅲ级和IV级;MSLZ组0级有5例,Ⅰ级和Ⅱ级分别为2例和1例,无Ⅲ级和Ⅳ级;对照组0级7例,I级1例,见表1。
表1 各组小鼠病理组织学分级比较
Table 1.Comparision of histological grading among the 3 groups (%.n=8)
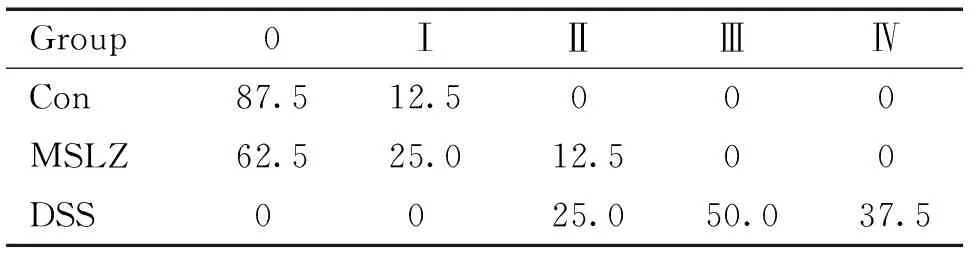
Group0ⅠⅡⅢⅣCon87.512.5000MSLZ62.525.012.500DSS0025.050.037.5

Figure 1.UC animal model establishment and mesalazine. treatment. A: mice body weight loss curve.Mean±SD.n=8.*P<0.05vsCon group;△P<0.05vsDDS group. B: HE staining of colon tissue of each group.
图1 建立小鼠UC模型及美沙拉嗪预治疗模型
2 UC模型小鼠外周血中IL-17、IFN-γ及Foxp3在CD3+T细胞的表达升高
在DSS诱导的小鼠UC模型中,其外周血单个核细胞中CD3+T细胞高表达IL-17、IFN-γ及Foxp3,肠黏膜单个核细胞中CD3+T细胞高表达IFN-γ和Foxp3,但IL-17的表达与对照组无差异,见图2。
3 UC模型小鼠肠组织中Th1、Th17和Treg细胞亚群升高
根据不同CD4+T细胞亚群产生细胞因子的不同,我们进一步分析了UC模型小鼠外周血和肠组织中Th1(CD3+CD4+IFN-γ+)、Th17(CD3+CD4+IL-17+)和Treg(CD3+CD4+Foxp3+)细胞亚群的变化,经流式细胞术胞内细胞因子检测结果显示,DSS组小鼠LPMC中Th1、Th17和Treg细胞亚群较对照组均显著升高(均P<0.05);但DSS组小鼠PBMC中只有Treg细胞亚群较对照组升高(P<0.05),见图3。

Figure 2.Expression of IL-17,IFN-γ and Foxp3 in PBMCs and LPMSs of UC mice. Meam±SD.n=8.*P<0.05,**P<0.01vsCon group.
图2 UC模型小鼠CD3+T细胞IL-17、IFN-γ和Foxp3的表达
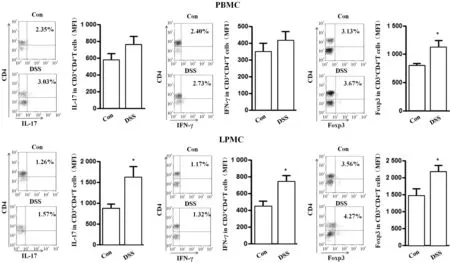
Figure 3.Expression of Th1,Th17 and Tregs in PBMCs and LPMCs of UC mice. Mean±SD.n=8.*P<0.05vsCon group.
图3 UC模型小鼠Th1、Th17和Treg细胞亚群的变化
4 美沙拉嗪对UC模型小鼠CD4+T细胞亚群的影响
为了探讨美沙拉嗪治疗UC的免疫学机制,我们进一步检测了美沙拉嗪对UC模型小鼠CD4+T细胞亚群的影响,见图4,我们发现美沙拉嗪预治疗后UC模型小鼠外周血中CD4+Foxp3+T细胞荧光强度较DSS组降低,提示美沙拉嗪能下调UC模型小鼠外周血中Treg细胞中Foxp3的表达。进一步检测发现,美沙拉嗪能显著下调UC模型小鼠肠组织中Th1、Th17和Treg亚群。
讨 论
溃疡性结肠炎是一种原因不明的直肠和结肠炎症,是危害人类健康的慢性疾病之一,据世界卫生组织报告[6],该病发生率为1/10 000~2/10 000,在我国UC的患病率约为1.16/10 000,实际的病例数更多。因此,对于UC发病的研究及治疗方法的探讨也成为医疗卫生界的重要课题。
以往的研究认为UC的发生发展与IL-4、IL-5、IL-13等介导的Th2型免疫反应密切相关[7],近期研究认为产生IL-17的Th17型细胞[8]、产生IFN-γ的Th1型细胞以及Foxp3+Treg细胞[9]均在UC的发病中发挥重要作用。
IL-17是新近发现的一种促炎症细胞因子,其具有强大的促炎反应活性,在不同的疾病中发挥着不同作用。有文献报道IL-17通过IL-17/IL-23轴参与炎症性肠病的发生[10],研究显示在炎症性肠病患者中IL-17的产生较正常人明显增加,这在小鼠溃疡性结肠炎模型中也得到了证实。IFN-γ是Th1细胞亚群产生的主要细胞因子,这类细胞因子在疾病中的研究及其作用机制都比较明确,在UC发病中IFN-γ起重要作用,本研究结果显示:尽管UC小鼠模型外周血中Th17和Th1细胞与对照组无显著差异,但在肠组织中产生Th17和Th1细胞亚群均显著增高,说明Th17和Th1细胞在UC肠道局部炎症损伤中起重要作用。
调节性T细胞是一组具有免疫负调节作用的T细胞亚群,它在维持机体免疫平衡、形成外周免疫耐受过程中发挥重要作用。Treg细胞可在体外通过细胞接触依赖机制参与炎症反应,另外Treg细胞表达高水平的细胞毒T淋巴细胞相关抗原4与抗原提呈细胞上的B7结合,诱导色氨酸裂解酶-吲哚胺2,3-二加氧酶活化,介导免疫耐受[11]。同时Treg细胞还可通过调节释放抑制性细胞因子(IL-10等)参与UC的发病,其数量较少或者功能异常均可导致疾病的发生。王晓红等[12]在研究大黄、巴豆霜对三硝基苯磺酸诱导的UC大鼠模型中发现在模型组大鼠外周血Treg细胞的百分比显著降低;周红光等[13]在对三硝基苯磺酸诱导的UC大鼠模型研究中发现其模型组外周血及肠系膜淋巴结中CD4+CD25+Treg细胞显著降低;Chao 等[14]在UC患者中发现Treg细胞比例低于健康人;谭至柔等[15]在UC患者外周血中也发现了这一现象。另外在T细胞缺乏的小鼠体内输注CD45RBhighCD4+T细胞可诱导形成炎症性肠病模型,同时可以调节Th1型T细胞产生IFN-γ的效应,这证实了Treg细胞减少或功能异常均可导致UC的发病。但是也有部分研究认为Treg细胞在炎症状态下代偿性增加,与Th17细胞亚群呈现协同状态,参与炎症反应。有报道[11]在活动性溃疡性结肠炎患者外周血中Treg细胞明显高于健康人,且活动性溃疡性结肠炎比慢性溃疡性结肠炎外周血Treg细胞升高。另外也有研究证实[8]在小儿UC和克罗恩病中,Treg细胞数量较正常人升高,Rismo等[16]在UC成年患者中也证实了这点。本组实验研究发现在外周血Treg细胞和病变局部肠道组织中Treg细胞水平均较正常对照组升高,这可能与小鼠体内环境不同,炎症细胞因子数量优势不同相关,在炎症状态下大量淋巴细胞浸润,调节性T细胞也代偿性增加,但是其增加水平无法抗衡促炎因子增加水平,从而发生炎症反应。同时这也提示在溃疡性结肠炎小鼠中,由于Treg细胞的异常,可能导致机体免疫失衡,从而使效应性CD4+T细胞从循环系统向肠道局部炎症部位移行,富集于炎症损伤部位,从而导致消化道黏膜处于高度活化状态,诱发机体肠道免疫反应,从而导致对自身抗原不耐受,损伤性细胞因子释放增加,导致黏膜损伤。因此,我们认为Treg细胞失衡在溃疡性结肠炎发病中发挥重要作用。这与郭敏等[17]在大鼠模型中的研究报道一致。另外国外有文献报道[18]在UC患者外周血、结肠组织及肠系膜淋巴结等检测发现其Treg细胞较正常人升高,其可能的机制是结肠组织或肠系膜淋巴结组织中增加的Treg细胞在体内可能通过某些共刺激分子或Toll样受体信号途径其抑制效应T细胞的功能被抑制,因此,即使在体外实验发现其外周血和病变组织中Treg细胞升高,这种升高仍不能逆转疾病的发生及发展,其具体机制目前暂未明确[19]。因此,我们认为在UC小鼠外周血和病变结肠组织中升高的Treg可能在不同程度上限制疾病的发展,但是不能逆转疾病的发生。
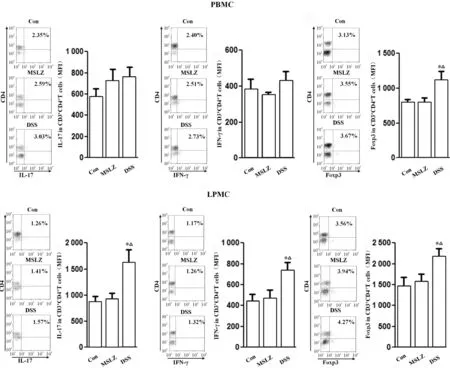
Figure 4.Efflect of MSLZ on CD4+T cell subsets in UC mice. Mean±SD.n=8.*P<0.05,vsCon group;△P<0.05 vs, MSLZ group.
图4 美沙拉嗪对UC模型小鼠CD4+T细胞亚群的影响
美沙拉嗪是一种新型5-氨基水杨酸控释剂,是治疗溃疡性结肠炎的首选药物之一,特别适用于对柳氮磺吡啶不能耐受的患者的急性发作。本组实验采用美沙拉嗪微胶颗粒予小鼠灌胃,结合文献报道[20]采用中剂量用量预治疗小鼠溃疡性结肠炎能有效减轻小鼠肠道炎症,因此本组实验选用中剂量灌胃治疗。结果发现,采用美沙拉嗪治疗小鼠7d后结肠组织炎症渗出较少,隐窝及腺体结构清晰,炎症程度较DSS诱导的UC小鼠组轻,其临床疗效显著。因此,我们认为美沙拉嗪灌胃预治疗能有效降低肠道炎症。而其作用的机制暂未完全明确,有研究认为其主要是通过作用于肠道炎症黏膜,抑制引起炎症的前列腺素的合成和炎症介质白三烯的形成,清除氧自由基,抑制肠黏膜的脂肪酸氧化,降低肠上皮通透性,从而对肠道壁炎症起显著的消炎作用,对发炎的肠壁结缔组织效果尤佳[21]。其免疫学机制研究较少,有报道[22]认为其可能通过抑制结肠组织下调NF-κB的表达,减少结肠局部炎性细胞因子的产生,最终达到治疗溃疡性结肠炎的目的;也可能通过影响其它细胞因子或信号转导途径发挥抗炎作用[23- 24],然而美沙拉嗪对T细胞亚群的研究较少,且机制暂未明确。本组实验研究发现美沙拉嗪预治疗后UC小鼠炎症减轻,且预治疗组小鼠外周血分泌IFN-γ的Th1细胞活性降低,这提示美沙拉嗪可能调节Th1细胞活性。有研究显示[25]美沙拉嗪释放一氧化氮衍生物NCX-456,而这种NCX-456可抑制Th1细胞诱导的细胞因子的释放,同时促进抑炎因子的产生,在UC中发挥重要的抗炎作用,且NCX-456能抑制细胞增殖,导致活化的肠黏膜固有层Th1细胞选择性凋亡,从而达到抗炎作用,但是其具体诱导Th1细胞的调节机制及途径还有待进一步明确。另外本实验研究显示美沙拉嗪预治疗后下调了外周血产生IL-17的Th17细胞活性,但是对组织中Th17的活性无影响。Th17细胞活化可诱导NF-κB信号途径活化,从而产生诱导型一氧化氮合酶、环氧化酶2等,同时产生大量IL-17介导促炎反应,美沙拉嗪预治疗UC下调Th17细胞的活性,从而阻断或减弱NF-κB信号途径,降低促炎因子的分泌,从而达到减轻炎症反应的目的[26]。本组实验美沙拉嗪可降低外周血Th17水平,而局部炎症部位Th17细胞呈下降趋势,但无统计学意义,这可能与局部炎症严重,短时间内美沙拉嗪不能快速影响Th17细胞的功能有关,这也提示在急性炎症严重时治疗周期及治疗剂量可能需要根据病情适当调整。同时,本组实验研究发现美沙拉嗪预治疗能降低外周血及病变组织中Treg细胞活性,但是其水平仍然较对照组升高,这提示美沙拉嗪可能诱导Treg细胞参与其对疾病的治疗。在炎症早期诱导Treg细胞产生,但是炎症缓解后Treg细胞活性迅速下降,这与Requena 等[26]的报道一致。但是其具体调节机制还有待进一步明确。
综上所述,我们在DSS诱导小鼠UC模型中发现效应性CD4+T细胞亚群Th17、Th1和调节性CD4+T细胞亚群都升高,尤其是Treg的代偿性升高可能在UC发病中起重要作用,美沙拉嗪可能通过调节Th1、Th17和Treg细胞亚群的功能从而发挥抗炎作用。
[1] Koller FL, Dozier EA, Nam KT, et al. Lack of MMP10 exacerbates experimental colitis and promotes development of inflammation-associated colonic dysplasia[J]. Lab Invest,2012,92(12): 1749-1759.
[2] Xue X, Ramakrishnan S, Anderson E, et al. Endothelial PAS domain protein 1 activates the inflammatory response in the intestinal epithelium to promote colitis in mice[J]. Gastroenterology,2013,145(4): 831-841.
[3] Sha T, Igaki K, Yamasaki M, et al. Establishment and validation of a new semi-chronic dextran sulfate sodium-induced model of colitis in mice[J]. Int Immunopharmacol,2013,15(1): 23-29.
[4] 李旺林, 曹 杰, 肖焕擎,等. 大肠埃希氏菌在葡聚糖硫酸钠诱导的结肠炎恢复中的作用[J]. 中国病理生理杂志,2012,28(1): 163-167.
[5] Ye Y, Yue M, Jin X, et al. Isolation of murine small intestinal intraepithelial γδΤ cells[J]. Immunol Invest,2010,39(7): 661-673.
[6] El-Tawil AM. Epidemiology and inflammatory bowel diseases[J]. World J Gastroenterol,2013,19(10): 1505-1507.
[7] Matsumura K, Nakase H, Kosugi I, et al. Establishment of a novel mouse model of ulcerative colitis with concomitant cytomegalovirus infection:invivoidentification of cytomegalovirus persistent infected cells[J]. Inflamm Bowel Dis,2013,19(9): 1951-1963.
[8] Holtta V, Klemetti P, Salo HM, et al. Interleukin-17 immunity in pediatric Crohn disease and ulcerative colitis[J]. J Pediatr Gastroenterol Nutr,2013,57(3): 287-292.
[9]Dahlen R, Strid H, Lundgren A, et al. Infliximab inhibits activation and effector functions of peripheral blood T cellsinvitrofrom patients with clinically active ulcerative colitis[J]. Scand J Immunol,2013,78(3): 275-284.
[10]Rafa H, Saoula H, Belkhelfa M, et al. IL-23/IL-17A axis correlates with the nitric oxide pathway in inflammatory bowel disease: immunomodulatory effect of retinoic acid[J]. J Interferon Cytokine Res,2013,33(7): 355-368.
[11]Furuzawa-Carballeda J, Fonseca-Camarillo G, Lima G, et al. Indoleamine 2,3-dioxygenase: expressing cells in inflammatory bowel disease-a cross-sectional study[J]. Clin Dev Immunol,2013,2013: 278035.
[12]王晓红, 侯丽娟,唐 方,等. 大黄、巴豆霜对溃疡性结肠炎大鼠CD4+CD25+Treg的影响[J]. 中药药理与临床,2013,29(2): 127-129.
[13]周红光, 陈海彬, 徐肇敏,等. 溃克灵对溃疡性结肠炎模型大鼠外周血和肠系膜淋巴结CD4+CD25+T细胞亚群的影响[J]. 时珍国医国药,2010,21(7): 1688-1690.
[14]Chao K, Zhong BH, Zhang SH, et al. Imbalance of CD4+T cell subgroups in ulcerative colitis[J]. Zhonghua Yi Xue Za Zhi, 2011,91(23): 1605-1608.
[15]谭至柔, 黄 雪, 黄振宁. 溃疡性结肠炎患者外周血CD4+CD25+Foxp3+T细胞的表达[J]. 实用医学杂志,2010,26(12): 2159-2161.
[16]Rismo R, Olsen T, Cui G, et al. Mucosal cytokine gene expression profiles as biomarkers of response to infliximab in ulcerative colitis[J]. Scand J Gastroenterol,2012,47(5): 538-547.
[17]郭 敏, 王 静, 张 楠. 溃疡性结肠炎大鼠免疫调节性T细胞的改变[J]. 中国煤炭工业医学杂志,2007,10(5): 587-589.
[18]Yu QT, Saruta M, Avanesyan A, et al. Expression and functional characterization of FOXP3+CD4+regulatory T cells in ulcerative colitis[J]. Inflamm Bowel Dis,2007,13(2): 191-199.
[19]Holmen N, Lundgren A, Lundin S, et al. Functional CD4+CD25high regulatory T cells are enriched in the colonic mucosa of patients with active ulcerative colitis and increase with disease activity[J]. Inflamm Bowel Dis,2006,12(6): 447-456.
[20]殷汉华, 张 涛, 李捷壮, 等. 美沙拉嗪干预溃疡性结肠炎相关癌变小鼠的实验研究[J]. 中华中医药学刊,2012,30(1): 29-31,225.
[21]Travis SP, Stange EF, Lemann M, et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: current management[J]. Gut,2006,55 (Suppl 1)∶ i16- i35.
[22]Mbodji K, Charpentier C, Guerin C, et al. Adjunct therapy of n-3 fatty acids to 5-ASA ameliorates inflammatory score and decreases NF-kappa B in rats with TNBS-induced colitis[J]. J Nutr Biochem,2013,24(4): 700-705.
[23]Herrlinger KR. Differences between Treatment Guidelines - Germany[J]. Dig Dis,2013,31(3-4): 357-359.
[24]Al-Rejaie SS, Abuohashish HM, Al-Enazi MM, et al. Protective effect of naringenin on acetic acid-induced ulcerative colitis in rats[J]. World J Gastroenterol,2013,19(34): 5633-5644.
[25]Santucci L, Wallace J, Mencarelli A, et al. Different sensitivity of lamina propria T-cell subsets to nitric oxide-induced apoptosis explains immunomodulatory activity of a nitric oxide-releasing derivative of mesalamine in rodent colitis[J]. Gastroenterology,2005,128(5): 1243-1257.
[26]Requena P, Daddaoua A, Martinez-Plata E, et al. Bovine glycomacropeptide ameliorates experimental rat ileitis by mechanisms involving downregulation of interleukin 17[J]. Br J Pharmacol,2008,154(4): 825-832.
Effect of mesalazine on Th1, Th17 and Treg cells in mice with DSS-induced ulcerative colitis
ZHU Bin1, ZHANG Han-xian2, 3, ZENG Jin-cheng2, 4, AN Bo-ran3, XU Jun-fa2, 4, SHU Jian-chang1
(1FirstClinicalMedicalCollegeofJinanUniversity,Guangzhou510632,China;2InstituteofLaboratoryMedicine,GuangdongMedicalCollege,Dongguan524808,China;3GuangdongMedicalCollege,Zhanjiang524023,China;4GuangdongProvincialKeyLaboratoryofMedicalMolecularDiagnostics,Dongguan524808,China.E-mail:shujc62@hotmail.com)
AIM: To investigate the effect of mesalazine treatment on regulation of Th1, Th17 and Treg cells in mice with dextran sulfate sodium (DSS)-induced ulcerative colitis (UC). METHODS: The expression of IL-17, IFN-gamma and Foxp3 in the peripheral blood mononuclear cells (PBMC) and intestinal mucosa lamina propria mononuclear cells (LPMC) of DSS-induced UC mice was detected by flow cytometry analysis. The effect of mesalazine treatment on regulaiton of Th1, Th17 and Treg cells in the mice with DSS-induced ulcerative colitis was examined.RESULTS: The expression of IL-17, IFN-γ and Foxp3 on CD4+T cells were significantly higher in the PBMC of DSS-induced mice than those in control group. CD4+IFN-γ+T cells and CD4+Foxp3+T cells were higher in LPMC than those in control group, except CD4+IL-17+T cells. Moreover, the Th1, Th17 and Treg cells were higher in DSS group than those in control group in LPMC. However, only Tregs was higher in PBMC. Pre-treatment with mesalazine significantly decreased the number of Th17, Th1 and Treg cells of UC model mice both in PBMC and LPMC.CONCLUSION: The Th1, Th17 and Tregs cells in DSS-induced mice were significantly higher than those in control mice, suggesting that CD4+T cell subsets play an important role in the pathogenesis of UC. Mesalazine may play a role in the treatment of UC by regulating the Th1, Th17 and Tregs cells.
Dextran sulfate sodium; Colitis, ulcerative; Mesalazine
1000- 4718(2014)12- 2219- 07
2014- 01- 27
2014- 09- 12
国家自然科学基金资助项目(No.81273237; No.30972779);广东省科技计划项目(No. 2011B061300098)
R574.62
A
10.3969/j.issn.1000- 4718.2014.12.018
△通讯作者 Tel: 020-34403830; E-mail: shujc62@hotmail.com

