靶向ER-α36的vshRNA真核表达慢病毒载体的构建、鉴定及其对胃癌细胞增殖的影响*
王绪明, 黄 萱, 付政祺, 邹 丰, 张尚昆, 王兆一, 刘丽江△
(江汉大学 1医学院病理学与病理生理学教研室, 2江大病理诊断所组织病理诊断部,湖北 武汉 430056)
·论 著·
靶向ER-α36的vshRNA真核表达慢病毒载体的构建、鉴定及其对胃癌细胞增殖的影响*
王绪明1, 2, 黄 萱1, 2, 付政祺1, 2, 邹 丰1, 张尚昆1, 王兆一1, 刘丽江1, 2△
(江汉大学1医学院病理学与病理生理学教研室,2江大病理诊断所组织病理诊断部,湖北 武汉 430056)
目的: 针对雌激素受体(ER)-α36基因的特异性靶序列, 构建并鉴定靶向ER-α36基因RNAi慢病毒载体,研究ER-α36沉默后对胃癌细胞增殖的影响。方法: 筛选确定的ER-α36 基因RNAi有效靶序列,合成靶序列的Oligo DNA,与慢病毒载体(GV307)连接,测序鉴定。转染293T细胞,包装产生慢病毒,感染胃癌SGC7901细胞株。荧光显微镜下观察SGC7901感染后荧光表达情况,real-time PCR和Western blotting方法检测ER-α36的表达变化。用1×10-10mol/L 的17β-雌二醇处理沉默ER-α36的SGC7901细胞,用细胞计数法观察细胞增殖能力的变化及检测相关下游信号通路分子Src、ERK1/2、cyclin D1表达的变化。结果: 阳性克隆PCR及测序证明成功构建慢病毒载体LV-ER-α36-RNAi,倒置显微镜下观察LV-ER-α36-RNAi慢病毒载体感染率达80%以上。 Real-time PCR和Western blotting方法证实四环素(TeT)诱导下LV-ER-α36-RNAi明显抑制SGC7901细胞内ER-α36 mRNA和蛋白质的表达。与对照组相比,沉默ER-α36的SGC7901细胞增殖能力减弱,Src、ERK1/2、cyclin D1蛋白表达明显降低,Src蛋白活化能力减弱(P<0.05)。结论: 我们构建的TeT诱导靶向ER-α36的vshRNA慢病毒载体LV-ER-α36-RNAi,可明显沉默ER-α36的表达,为研究ER-α36蛋白的作用机理提供实验依据,ER-α36与胃癌细胞等肿瘤细胞的增殖有关。
SGC7901细胞; 雌激素受体α36; 慢病毒载体
雌激素受体α36(estrogen receptor α36,ER-α36)是新近发现的ER-α (又称ER-α66)的亚型,由310个氨基酸组成,分子量35.7 kD,其基因编码序列位于人类染色体6q 24.2~25.3(GenBank ID: BX640939.1),目前的研究发现其蛋白质主要定位于细胞膜。ER-α36与ER-α66不同的是拥有一段特有的氨基酸序列,即在末端有27个氨基酸与ER-α66不同。由此针对这个区段的氨基酸可获得特异性的ER-α36抗体,使得对ER-α36蛋白的研究变得更为容易[1]。
近10年的研究有越来越多的证据显示,雌激素在雌激素依赖性肿瘤(如乳腺癌等)以及雌激素非依赖性肿瘤(呼吸道及消化道肿瘤等)中均发挥着非常重要的作用[2-7],其中ER-α36在乳腺癌的耐药方面和雌激素非依赖性肿瘤的发生与发展方面可能比ER-α66发挥更为重要的介导雌激素信号的作用[2, 8-10]。为了进一步阐明ER-α36蛋白的作用原理以及在肿瘤细胞信号传递中的效应机制,敲减其表达是重要的体外研究手段之一。因此,我们探索构建靶向ER-α36的慢病毒短发夹状RNA (vshRNA)真核表达载体的技术问题,以解决敲减肿瘤细胞内ER-α36的表达,研究其介导雌激素信号的作用机制。
材 料 和 方 法
1 材料和试剂
293T细胞购自中国科学院典型培养物保藏委员会细胞库;人胃癌细胞株SGC7901由华中科技大学同济医学院免疫学教研室馈赠;大肠杆菌菌株DH5α购自天根生化科技(北京)有限公司;XhoI、EcoR I及T4 DNA连接酶购自New England Biolabs;RNA干扰慢病毒载体TetIIP-Turbo-RFP-MCS(MIR30)-Ubi-TetR-IRES-Puromycin(GV307)和病毒包装质粒、GV307重组载体、pHelper 1.0和pHelper 2.0均购自上海吉凯基因化学技术有限公司;感染试剂Lipofectamine 2000(11668019)购自Invitrogen;DMEM液体培养基和胎牛血清购自Hyclone;兔多克隆抗人ER-α36抗体由王兆一教授(美国,Creighton大学医学院)馈赠;兔抗人Src 抗体、p416-Src 抗体、 p527-Src 抗体、兔抗人cyclin D1 抗体、兔抗人ERK1/2 抗体、辣根过氧化物酶标记的羊抗兔IgG及辣根过氧化物酶标记的羊抗鼠IgG购自Santa Cruz;鼠单克隆抗体β-actin购自武汉博士德生物工程有限公司;用于Western blotting检测的增强化学发光试剂ECL和BCA蛋白定量试剂盒为上海碧云天生物技术有限公司产品;PVDF转印膜购自Millipore;One Step Reverse Transcript-PCR试剂盒为Qiagen产品;SYBR Master Mixture 购自TaKaRa;四环素(tetracycline,TeT)粉剂购自中国生物制品研究所;其他生化试剂均为进口分装或国产分析纯;1,5-二甲基-1,5、二氮十一亚甲基聚甲溴化物(polybrene;感染添加剂)由上海吉凯基因化学技术有限公司提供;引物的合成及DNA序列测定均委托上海吉凯基因化学技术有限公司完成。
2 主要方法
2.1 靶向ER-α36的vshRNA设计和构建 根据GenBank数据库获得ER-α36 (BX640939.1)的序列,设计合成多对针对ER-α36基因shRNA的寡核苷酸序列,选择最佳的动力学参数靶点(AGC AGA GTG GTA CGG TTA A)进入后续实验流程。确定针对目的基因shRNA的有效靶点后,合成双链DNA,与GV307载体连接,转化感受态大肠杆菌DH5α,挑取重组阳性克隆行PCR及测序鉴定(ABI公司3730型DNA测序仪进行测序分析)。挑选转化子重悬于10 μL Luria-Bertani(LB)培养基,混匀取1 μL作为模板;使用GV307载体通用引物,进行菌落PCR鉴定实验。PCR鉴定阳性克隆的上游引物为5’-AGA CCT ACG TCG AGC AGC AC-3’, 下游引物为 5’- TCC GTC TCG TGT CTT GTT GC-3’。
2.2 慢病毒包装 胰蛋白酶消化处于对数生长期的293T细胞用于转染,制备慢病毒包装系统中3种质粒的混合溶液[LV-ER-α36-RNAi载体或GV307-NC(GV307-negative control)20 μg,pHelper 1.0(gag/pol元件)载体15 μg,pHelper 2.0(VSVG元件)载体10 μg],与相应体积的Opti-MEM混合均匀。将稀释后的质粒与稀释后的Lipofectamine 2000进行混合,将混合液转移至293T细胞的培养液中,放入37 ℃、5% CO2细胞培养箱中培养。8 h后, PBS洗涤。加入含10%胎牛血清(FBS)的细胞培养基,继续培养48 h。收集转染后48 h的293T细胞上清液。经离心过滤,即可获得病毒浓缩液。将病毒浓缩液移出,测定滴度后,分装-150 ℃保存备用。
2.3 慢病毒感染 选取人胃癌SGC7901细胞,以1×105个数量的细胞接种于6孔板中,含10% FBS的DMEM培养基体积为2 mL,待细胞长至70%。将冻存的LV-ER-α36-RNAi病毒颗粒和GV307-NC病毒颗粒取出冰浴融化,用无血清DMEM培养基稀释病毒滴度至1×1011TU/L,按20 μL/well的用量,将含有LV-ER-α36-RNAi载体的慢病毒感染胃癌SGC7901细胞, 同时以GV307-NC病毒颗粒为对照(vector-control),均加入终浓度为10 mg/L的polybrene以提高病毒感染效率。
2.4 荧光显微镜检查感染效率及实验分组 取LV-ER-α36-RNAi以最适感染复数(multiplicity of infection, MOI)值感染SGC7901胃癌细胞株,置于37 °C、5% CO2培养箱内孵育48 h。根据感染情况将相同时点的SGC7901细胞分为2组感染组:感染LV-ER-α36-RNAi;感染加TeT处理组感染LV-ER-α36-RNAi同时加上2 mg/L TeT处理。在倒置荧光显微镜下观察感染后48 h时荧光表达情况,评价细胞感染效率。
2.5 Real-time PCR方法检测重组质粒对ER-α36 mRNA表达的影响 实验分为未感染组、阴性对照组(vector-control)和感染组(LV-ER-α36-RNAi组)、感染+不同浓度TeT处理组(感染LV-ER-α36-RNAi后采用0.5 mg/L、1 mg/L、2 mg/L和4 mg/L TeT 处理)。SGC7901细胞分别感染LV-ER-α36-RNAi或GV307-NC 48 h后,收集mRNA,逆转录成cDNA后,用特异性引物进行real-time PCR检测。ER-α36的上游引物为5’-ACA AGT GGT TTC CTC GTG TCT AA-3’,下游引物为5’-GGG TGT TGA GTG TTG GTT GC-3’;GAPDH的上游引物为5’-TGA CTT CAA CAG CGA CAC CCA-3’,下游引物为5’-CAC CCT GTT GCT GTA GCC AAA-3’。Real-time PCR的扩增条件为95 ℃30 s;95 ℃5 s,60 ℃ 30 s,35个循环。
2.6 Western blotting法检测重组质粒对ER-α36、Src、ERK、cyclin D1、p416-Src及p527-Src蛋白表达的影响 检测ER-α36、Src、ERK、cyclin D1蛋白的表达,实验分为未感染组、阴性对照组(vector-control)、感染组(LV-ER-α36-RNAi组)和感染+TeT处理组(LV-ER-α36-RNAi+2 mg/L TeT)。将上述分组细胞分别在48 h和72 h后提取总蛋白,进行SDS-PAGE。检测p416-Src及p527-Src蛋白表达,实验分为未感染组和感染+TeT处理组(LV-ER-α36-RNAi+2 mg/L TeT)。细胞经含2%活性炭吸附的FBS(cFBS)的无酚红1640处理2 d,再经无血清无酚红1640处理6 h,目的是去除雌激素的影响,再加入终浓度为0 mol/L和1×10-10mol/L 17β雌二醇(17β-estrodial), 5% CO2、37 ℃孵育10 min和20 min,然后分别将上述分组细胞提取总蛋白。将蛋白定量后进行SDS-PAGE,电泳后湿转至PVDF膜,5%脱脂奶粉37 ℃封闭60 min,抗ER-α36、Src、ERK1/2、cyclin D1、p416-Src及p527-Src蛋白的抗体4 ℃孵育过夜。TBST漂洗5 min×3次, 加入相应的辣根过氧化物酶标记的羊抗鼠或羊抗兔IgG,37 ℃孵育60 min。TBST漂洗5 min×3次,ECL化学发光试剂检测。
2.7 细胞计数法检测雌激素处理下,ER-α36对胃癌细胞增殖能力的影响 实验分为未感染组及感染+TeT处理组(LV-ER-α36-RNAi+2 mg/L TeT)。分别将上述分组细胞经除去雌激素影响处理后,收集对数期细胞,调整细胞悬液浓度,10 cm玻璃平底板每板加入10 000个细胞。分别加入0 mol/L和1×10-10mol/L 17β-estrodial, 5% CO2、37 ℃孵育5 d和7 d。然后收集细胞用手持ScepterTM2.0细胞计数仪计数,实验重复3次。
3 统计学处理
实验数据以均数±标准差(mean±SD)表示,采用SPSS 13.0统计软件进行方差分析或t检验。以P<0.05为差异有统计学意义。
3.让传播对象感到我们是“命运共同体”。说一些共同关注的话题,多一点对重大事件和热点事件的参与,构建出彼此尊重、合作双赢、共同发展的“命运共同体”,使传播内容更具针对性、亲和力和公信力。
结 果
1 重组质粒的鉴定
将阳性克隆进行PCR实验并送测序, 测序结果证实设计序列正确插入载体且无突变,见图1。
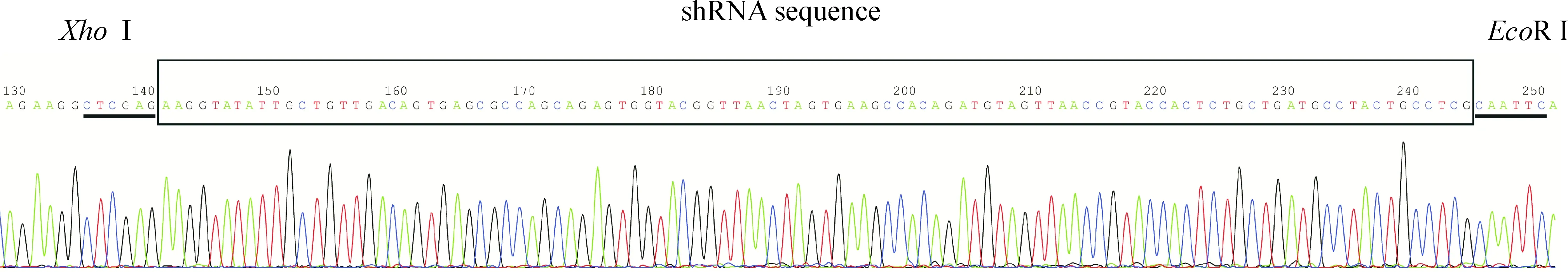
Figure 1.The sequencing result of LV-ER-α36-RNAi was in accordance with the design planning.
图1 慢病毒载体LV-ER-α36-RNAi测序结果
2 LV-ER-α36-RNAi慢病毒感染
未加TeT处理的感染组的SGC7901细胞48 h后未出现红色荧光标记,感染加TeT处理组的SGC7901细胞48 h后, 荧光显微镜观察显示细胞中均表达红色荧光蛋白,提示TeT成功诱导红色荧光蛋白的表达,重组质粒48 h转染效率为80%以上,提示病毒的滴度及转染的效率均比较好,见图2。
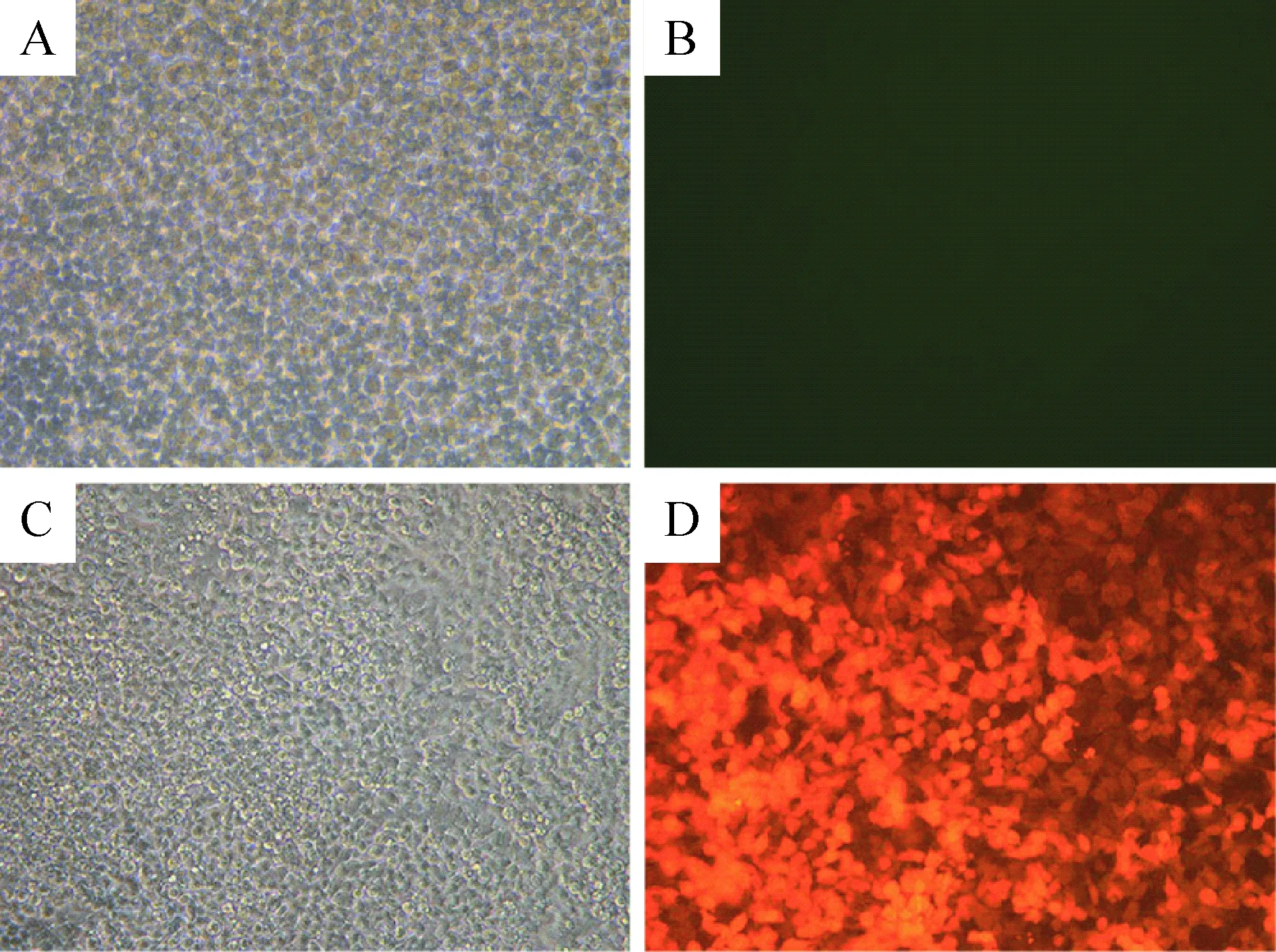
Figure 2.The cell infection rate (48 h after transfection, ×200). A,B: transfected group ;C,D: transfected group with TeT stimulation.
图2 病毒颗粒感染SGC7901细胞48 h后红色荧光蛋白的表达
3 Real-time PCR方法检测结果
相对于未感染组SGC7901细胞(SGC7901)而言,阴性对照组SGC7901细胞(vector-control),ER-α36基因无敲减(P>0.05);感染组SGC7901细胞(Low36),ER-α36基因无敲减(P>0.05);感染加TeT处理组(Low36+TeT),0.5、1、2和4 mg/L TeT分别处理48 h,ER-α36基因敲减效率达到约14.3%、31.3%、65.1%和65.9%; 0.5、1、2和4 mg/L TeT分别处理72 h,ER-α36基因敲减效率达到约24.6%、34.3%、72.9%和73.1%,见图3。上述结果提示,TeT成功诱导Low36细胞沉默ER-α36 mRNA表达,具有时间和剂量依赖性,从量效比来看,2 mg/L TeT是最佳诱导浓度。
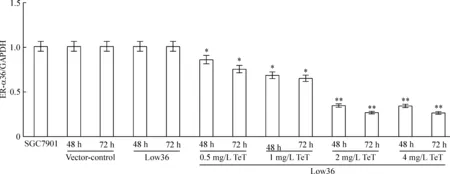
Figure 3.The mRNA expression of ER-α36 detected by real-time PCR. Mean±SD.n=3.*P<0.05,**P<0.01vsSGC7901.
图3 Real-time PCR检测ER-α36 mRNA表达
4 Western blotting方法检测结果
5 细胞计数法及Western blotting方法检测结果
细胞计数法检测结果显示,在浓度为1×10-10mol/L 的17β-estrodial诱导下,沉默ER-α36的SGC7901细胞(Low36),cyclin D1表达降低,增殖能力弱于SGC7901细胞(P<0.05)。在TeT处理下分别沉默ER-α36 48 h和72 h后,与未沉默组相比,Src、ERK1/2及cyclin D1蛋白表达降低(P<0.05),见图5。相对于SGC7901细胞而言,低浓度雌激素在10 min未能诱导Low36细胞Src蛋白416位点磷酸化,在20 min时有微弱的磷酸化,而Src蛋白527位点磷酸化未能明显降低,说明沉默ER-α36以后,雌激素诱导Src的416位点活化能力降低,见图6。上述结果提示,ER-α36与胃癌细胞增殖能力有关,Src、ERK1/2及cyclin D1等可能参与ER-α36介导的胃癌细胞增殖的信号通路转导途径。
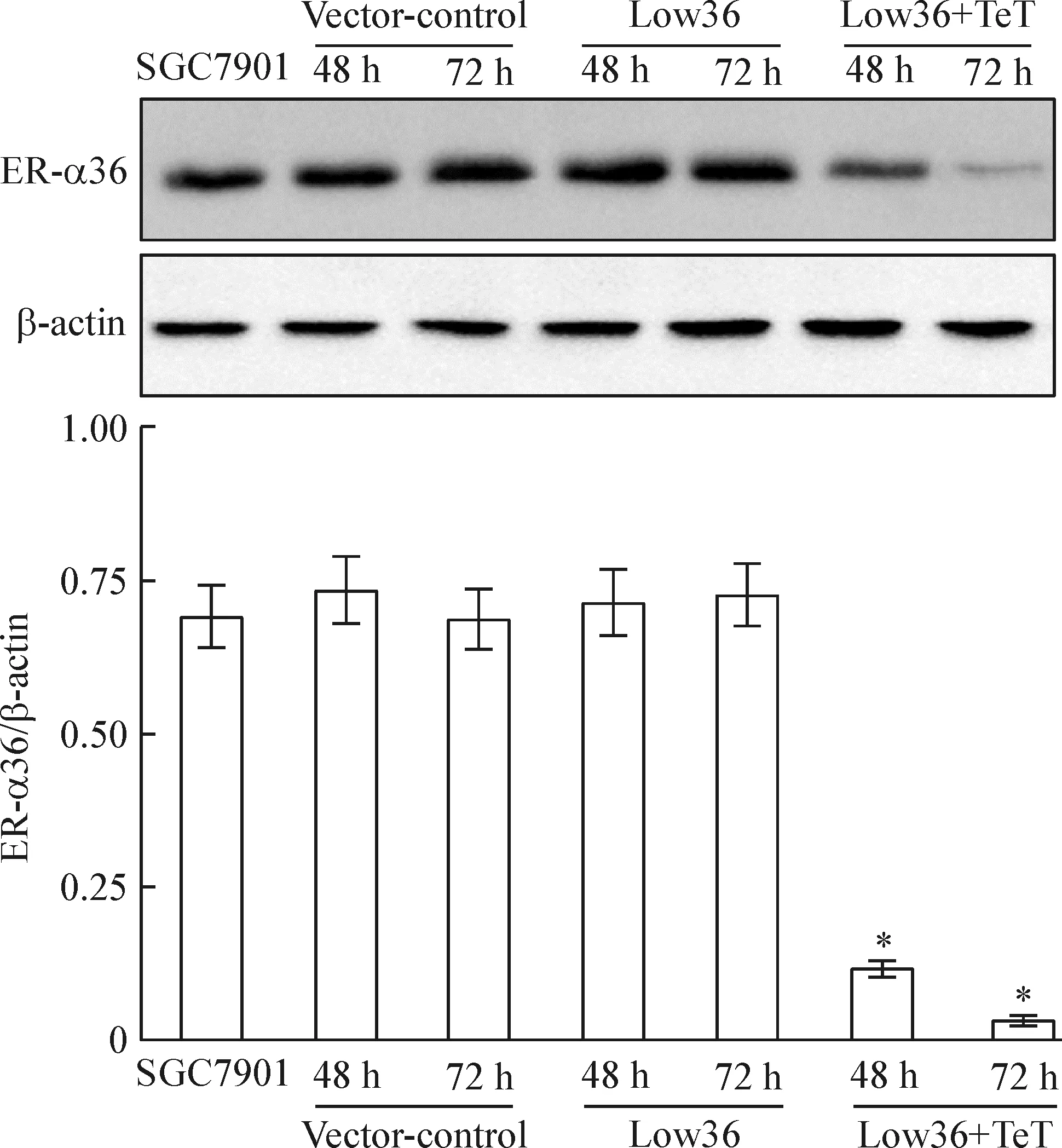
Figure 4.Inhibitory effects of LV-ER-α36-RNAi on the protein expression of ER-α36. Mean±SD.n=3.*P<0.05vsSGC7901.
图4 LV-ER-α36-RNAi对ER-α36蛋白表达的抑制效应
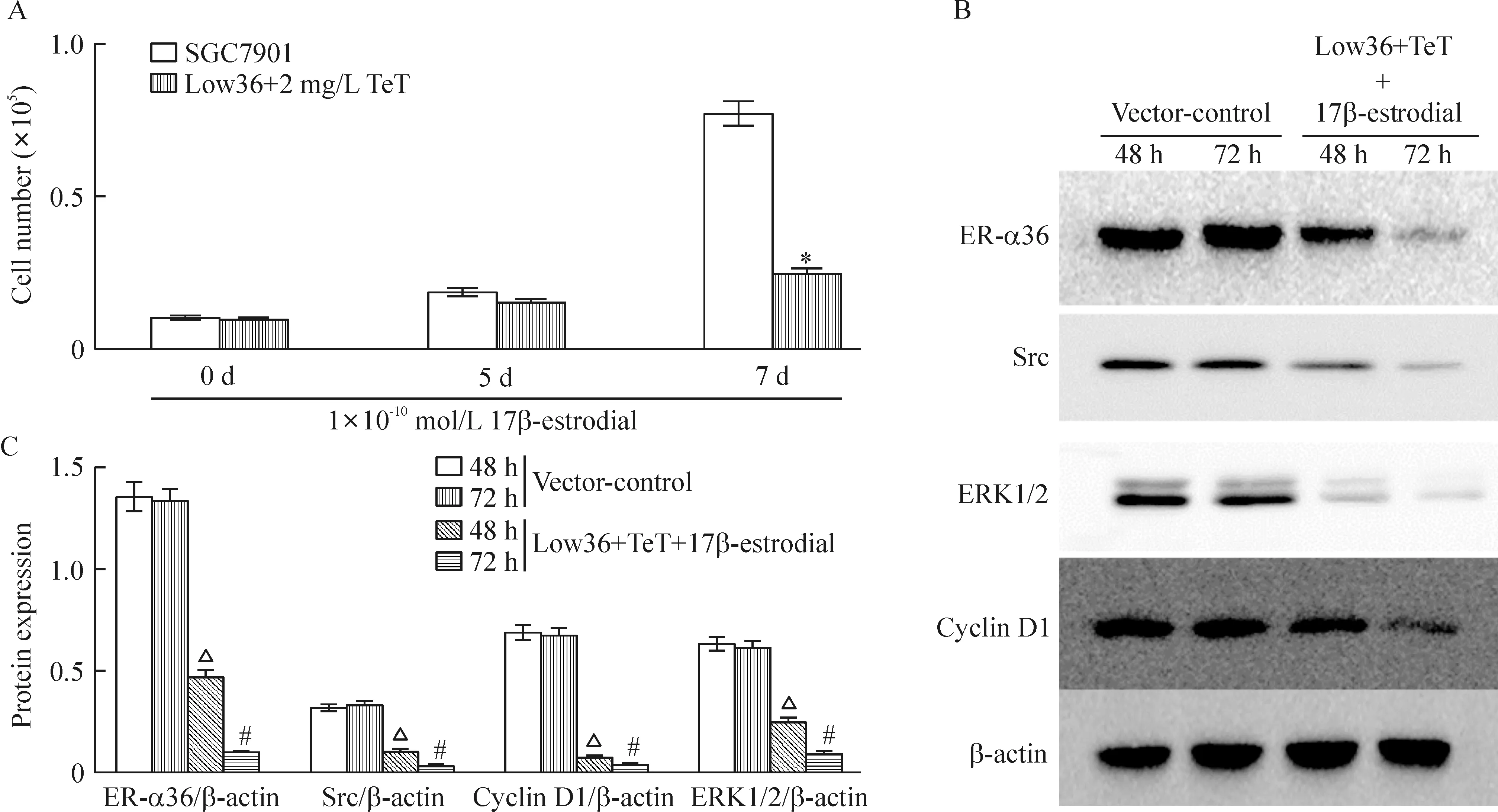
Figure 5.The results of cell counting and Western blotting analysis. A: the results of cell counting; B,C: the results of Western blotting analysis. Mean±SD.n=3.*P<0.05vsSGC7901 at 7 d;△P<0.05vsvector-control at 48 h;#P<0.05vsvector-control at 72 h.
图5 细胞计数法及Western blotting法检测结果
讨 论
逆转录病毒是一种单股正链RNA病毒,核心区域含有编码核心蛋白(gag)、编码逆转录酶(pol)和编码包膜蛋白(env)3种重要基因结构,是一种高效感染病毒,可以感染几乎所有的活细胞[11]。慢病毒(lentivirus)是逆转录病毒的一种,利用慢病毒载体构建的沉默基因表达载体,其效率远远高于物理或化学方法的转染[12]。TeT调控基因表达系统是基于大肠杆菌四环素操纵子基础上建立的可人工调节基因表达的操控系统[13]。TeT调控系统包括TeT-on(激活表达)和TeT-off(关闭表达)2种模式,可以安全有效地调控外源基因在真核细胞的表达水平[14]。
本实验中构建的沉默ER-α36的慢病毒载体选用GV307病毒载体,其载体序列为TetIIP-Turbo-RFP-MCS(MIR30)-Ubi-TetR-IRES-Puromycin。慢病毒的基因组所含的CpG岛更少,降低宿主的免疫反应性,可以更优地发挥其基因沉默的作用,同时又几乎不引起宿主的免疫反应[15,16]。我们的实验结果证实,转染了沉默ER-α36的慢病毒载体后,若不给予TeT处理,ER-α36并没有被敲减,而给予了TeT处理后,ER-α36就被明显敲减了。因此,含有四环素调控位点的GV307病毒载体,不仅携带有沉默ER-α36的片段,还带有控制其表达的开关,这是保证实验研究非常重要的技术手段。
我们构建的沉默ER-α36的慢病毒载体,是深入研究雌激素- ER-α36在胃癌中作用及机制的前提之一。本项研究的结果显示,胃癌SGC7901细胞被感染的第48 h,转染效率在80%以上,测序结果显示,基因设计序列正确插入载体且无突变。Real-time PCR结果显示,ER-α36基因敲减效率达到约73%。Western blotting结果显示,在感染的第48 h和72 h,ER-α36蛋白表达降低且有统计学差异。
胃癌是中国常见高发恶性肿瘤之一,流行病学研究发现,胃癌的发生具有男性明显多于女性的特点,而这种性别的差异在女性绝经后消失[17]。因此,胃癌的发生显然与雌激素有某种关联,但是雌激素信号的转导又与ER-α66的关系不紧密[18]。我们的前期研究发现,胃癌细胞和人体胃癌组织样本中均有ER-α36的表达,并在胃癌组织、癌旁组织及远离胃癌的组织中呈递减的趋势,且与患者的年龄、肿瘤的大小、组织学分级以及淋巴结转移相关[8-9]。
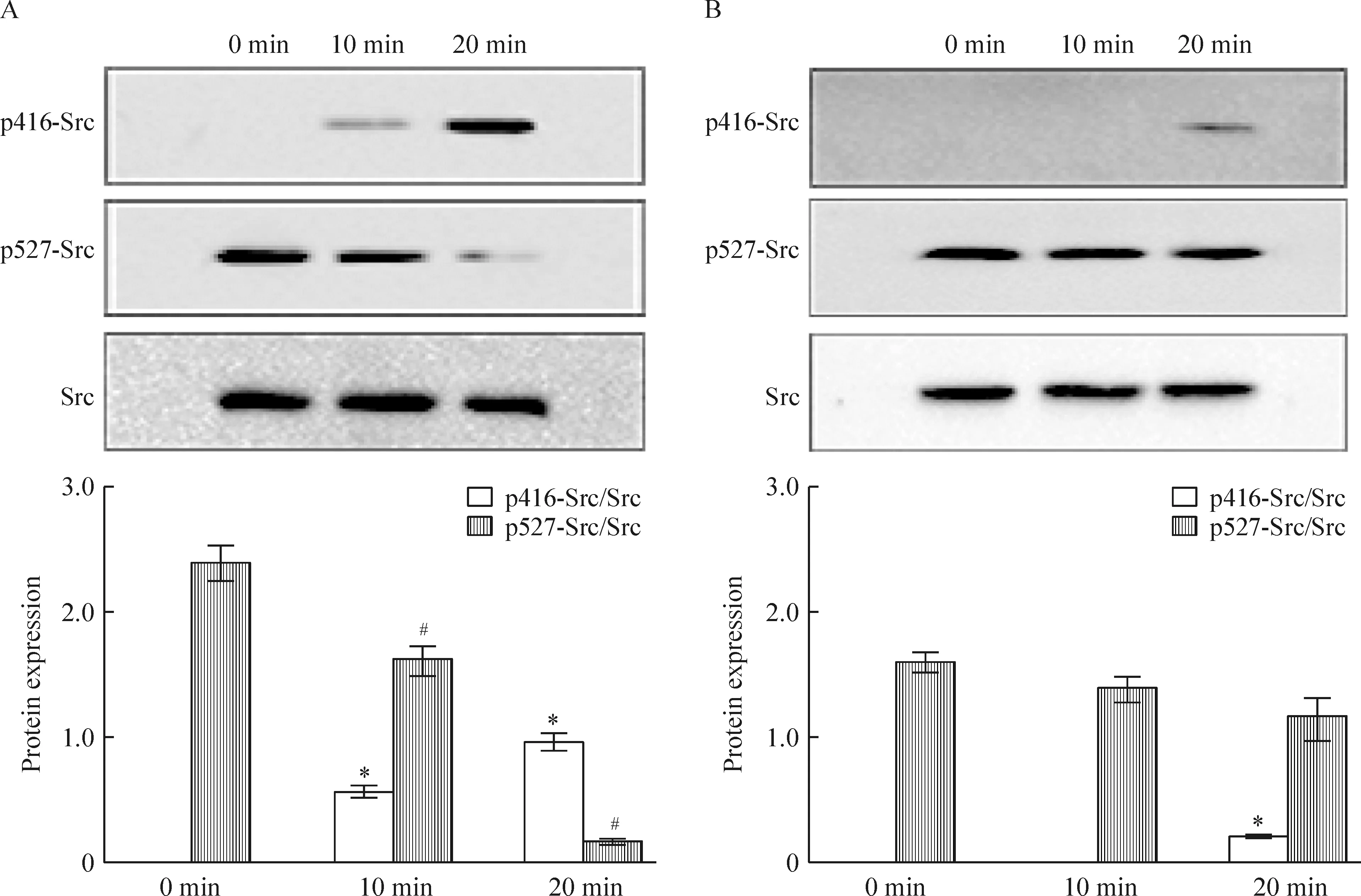
Figure 6.Expression of p416-Src and p527-Src in SGC7901 cells (A) and Low36 cells (B) treated with 1×10-10mol/L 17β-estrodial at different time points. Mean±SD.n=3.*P<0.05vsp416-Src/Src at 0 min;#P<0.05vsp527-Src/Src at 0 min.
图6 Western blotting法检测结果
雌激素通过ER-α36经c-Src信号通路调控胃癌细胞的生长,在正常情况下, Src-SH2结构域与 C 端 Tyr527 结合, 后者被蛋白酸氨酸激酶(protein tyrosine kinase,PTK)磷酸化, 使整个分子呈头尾卷曲状态, 将 Src 激酶活性中心遮盖, 因而 Src 激酶活性处于抑制状态。Tyr527 的去磷酸化就可使 Src 活化, Src 激酶一旦解除了抑制状态, PTK 功能域内一个关键酪氨酸残基就被磷酸化, 其 PTK 活性被激活[3, 19]。Raf/MEK/ERK信号通路调节细胞的增殖、分化和细胞周期进程,是许多上皮性肿瘤增殖的中心调控环节,在许多肿瘤中存在ERK1/2蛋白激活[20-22]。
在本实验中发现,在低浓度 17β-estrodial的诱导下,SGC7901细胞增殖能力增强(P<0.05),沉默ER-α36后,这种增强效应消失(P>0.05)。沉默胃癌细胞中ER-α36的表达后, Src、ERK1/2等与细胞增殖相关的信号分子表达也降低,Src蛋白活化能力降低(P<0.05)。提示可能是通过激活Src激酶及细胞内MAPK(ERK1/2)信号通路促进细胞增殖。研究报道,Src及ERK信号通路可以诱导cyclin D1高表达,参与肿瘤细胞增殖[23-24]。
CyclinD1是一种原癌基因,属于G1细胞周期蛋白家族,通过细胞周期蛋白依赖性激酶4和6的磷酸化和失活Rb蛋白发挥作用,是调控细胞周期G1向S 期转变的关键蛋白,主要功能是促进细胞增殖,同时,研究认为,cyclin D1与雌激素信号通路相关[3, 25]。 在胃癌、食管癌、乳腺癌和尿路上皮癌等多种肿瘤组织中发现有cyclin D1的过表达出现[26-27]。在本实验中发现,沉默ER-α36后, cyclin D1蛋白表达降低,提示cyclin D1可能参与ER-α36促进细胞增殖的信号通路。
[1] Wang ZY, Zhang XT, Shen P, et al. A variant of estrogen receptor-{alpha}, hER-{alpha}36: transduction of estrogen- and antiestrogen-dependent membrane-initiated mitogenic signaling[J]. Proc Natl Acad Sci U S A, 2006, 103(24):9063-9068.
[2] Zhang XT, Wang ZY. Estrogen receptor-α variant, ER-α36, is involved in tamoxifen resistance and estrogen hypersensitivity[J]. Endocrinology, 2013, 154(6):1990-1998.
[3] Wang XM, Deng H, Zou F, et al. ER-α36-mediated gastric cancer cell proliferation via the c-Src pathway[J]. Oncol Lett, 2013, 6(2):329-335.
[4] Jiang HP, Teng RY, Wang Q, et al. Transcriptional analysis of estrogen receptor alpha variant mRNAs in colorectal cancers and their matched normal colorectal tissues[J]. J Steroid Biochem Mol Biol, 2008, 112(1-3):20-24.
[5] Fu ZQ, Zou F, Deng H, et al. Estrogen protects SGC7901 cells from endoplasmic reticulum stress-induced apoptosis by the Akt pathway[J]. Oncol Lett, 2014, 7(2):560-564.
[6] Fu ZQ, Deng H, Wang XM, et al. Involvement of ER-α36 in the malignant growth of gastric carcinoma cells is associated with GRP94 overexpression[J]. Histopathology, 2013, 63(3): 325-333.
[7] 邓 昊, 镇鸿燕, 范 军, 等. 17β-雌二醇可促进胃癌细胞BGC823生长[J]. 武汉大学学报:医学版, 2012, 33(2):150-154.
[8] 王陆佰, 邓 昊, 黄 萱, 等. 胃癌中雌激素受体-α36与α66 mRNA的表达及其临床病理意义[J]. 武汉大学学报:医学版, 2010, 31(1):38-42.
[9] Deng H, Huang X, Fan J, et al. A variant of estrogen receptor-α, ER-α36 is expressed in human gastric cancer and is highly correlated with lymph node metastasis[J]. Oncol Reports, 2010, 24(1):171-176.
[10]Deng H, Zhang XT, Wang ML, et al. ER-α36-mediated rapid estrogen signaling positively regulates ER-positive breast cancer stem/progenitor cells[J]. PLoS One, 2014, 9(2): e88034.
[11]Liu YP, Berkhout B. HIV-1-based lentiviral vectors[J]. Methods Mol Biol, 2014, 1087: 273-284.
[12]陈 舒, 罗 铭, 蔡望青, 等. 靶向MAG基因 shRNA 慢病毒载体的构建及其对MAG基因表达的沉默[J]. 中国病理生理杂志, 2013, 29(9):1725-1728.
[13]Gossen M, Bujard H. Tight control of gene expression in mammalian cells by tetracycline-responsive promoters[J]. Proc Natl Acad Sci U S A, 1992, 89(12):5547-5551.
[14]Stary E, Gaupp R, Lechner S, et al. New architectures for Tet-on and Tet-off regulation in Staphylococcus aureus[J]. Appl Environ Microbiol, 2010,76(3):680-687.
[15]Ghosal A, Kabir AH, Mandal A. RNA interference and its therapeutic potential[J]. Central European J Med, 2011, 6(2):137-147.
[16]Motavaf M, Safari S, Alavian SM. Therapeutic potential of RNA interference: a new molecular approach to antiviral treatment for hepatitis C[J]. J Viral Hepat, 2012,19(11): 757-765.
[17]Jemal A,Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[18]Wang J, Li J, Fang R, et al. Expression of ER-α36 in gastric cancer samples and their matched normal tissues[J]. Oncol Lett, 2012, 3(1):172-175.
[19]王绪明, 刘晶晶, 邓 昊, 等. ER-α36对胃癌SGC7901细胞在裸鼠体内生长的影响[J]. 世界华人消化杂志, 2011, 19(28):2919-2924.
[20]Yeh CB, Yu YL, Lin CW, et al. Terminalia catappa attenuates urokinase-type plasminogen activator expression through Erk pathways in Hepatocellular carcinoma[J]. BMC Complement Altern Med, 2014,14:141.
[21]Chen H, Cheng ZY, Pan Y,et al. RASAL1 influences the proliferation and invasion of gastric cancer cells by regulating the RAS/ERK signaling pathway[J]. Hum Cell, 2014, 27(3):103-110.
[22]Levidou G, Saetta AA, Gigelou F, et al. ERK/pERK expression and B-raf mutations in colon adenocarcinomas: correlation with clinicopathological characteristics[J]. World J Surg Oncol, 2012,10:47.
[23]Sen A, De Castro I, Defranco DB, et al. Paxillin mediates extranuclear and intranuclear signaling in prostate cancer proliferation[J]. J Clin Invest, 2012, 122(7):2469-2481.
[24]Mamidipudi V, Zhang J, Lee KC, et al. RACK1 regulates G1/S progression by suppressing Src kinase activity[J].Mol Cell Biol, 2004,24(15):6788-6798.
[25]Chung J, Noh H, Park KH, et al. Longer survival in patients with breast cancer with cyclin D1 over-expression after tumor recurrence: longer, but occupied with disease[J]. J Breast Cancer, 2014, 17(1):47-53.
[26]Kim JK, Dieh JA. Nuclear cyclin D1: an oncogenic driver in human cancer[J]. J Cell Physiol, 2009, 220(2):292-296.
[27]Shan J, Zhao W, Gu W. Suppression of cancer cell growth by promoting cyclin D1 degradation[J]. Mol Cell, 2009, 36(3):469-476.
Construction of lentiviral vector-mediated siRNA knockdown ofER-α36 and its action on gastric cancer cell growth
WANG Xu-ming1, 2, HUANG Xuan1, 2, FU Zheng-qi1, 2, ZOU Feng1, ZHANG Shang-kun1, WANG Zhao-yi1, LIU Li-jiang1, 2
(1DepartmentofPathologyandPathophysiology,SchoolofMedicine,2DepartmentofHistopathology,JiangdaPathologyInstitute,JianghanUniversity,Wuhan430056,China.E-mail:liulijiang@163.com)
AIM: To construct a lentiviral vector for stable delivery of theER-α36 gene and to detect its effect on SGC7901 cell growth. METHODS: The efficient RNAi targeting sequences identified for theER-α36 gene were screened. The Oligo DNA was synthesized with target sequences and annealed to form double-stranded DNA. Then it was digested byXhoI andEcoR I and connected with GV307 vector to produce LV-ER-α36-RNAi lentiviral vector. PCR was used to screen the positive clones and sequence. The LV-ER-α36-RNAi, pHelper 1.0 and pHelper 2.0 plasmids were co-transfected into 293T cells for producing lentiviral vector and infecting SGC7901 cell line. Fluorescence microscopy, real-time PCR and Western blotting were used to detect the transfection efficiency and gene silencing effect. 17β-estrodial at concentration of 1×10-10mol/L was used to stimulate the recombinant cell line, and the action on the growth of gastric cancer cells and the expression of Src, ERK1/2 and cyclin D1 were determined. RESULTS: DNA sequencing analysis confirmed the identity of recombinant shRNA expression vectors. Immunofluorescence assay demonstrated that transfection efficiency was above 80%. Transfection of LV-ER-α36-RNAi significantly knocked down the expression of ER-α36 at mRNA and protein levels with tetracycline (TeT) simulating as revealed by real-time PCR and Western blotting. Compared with control group, the growth of the recombinant cell line declined and the expression of Src, ERK1/2 and cyclin D1 and the activation of Src decreased (P<0.05).CONCLUSION: Lentiviral vectors that silenceER-α36 expression are constructed successfully and can be used to study the role of ER-α36 in gastric cancer. TheER-α36 is related with many kinds of cancer cell growth, including gastric cancer cells.
SGC7901 cells; Estrogen receptorα 36; Lentivirus vector
1000- 4718(2014)12- 2113- 07
2014- 06- 25
2014- 07- 28
国家自然科学基金资助项目(No. 30870981; No. 812727754)
R393; R730.23
A
10.3969/j.issn.1000- 4718.2014.12.001
△通讯作者 Tel: 027-84226503; E-mail: liulijiang@163.com

