大豆异黄酮对脑缺血/再灌注诱导的线粒体损伤和脑细胞凋亡的影响*
赵士弟, 陈 耀, 姜丽娜, 董银凤, 陈前芬△
(蚌埠医学院 1病理生理学教研室, 2第一附属医院,安徽 蚌埠 233000)
大豆异黄酮对脑缺血/再灌注诱导的线粒体损伤和脑细胞凋亡的影响*
赵士弟1, 陈 耀2, 姜丽娜1, 董银凤1, 陈前芬1△
(蚌埠医学院1病理生理学教研室,2第一附属医院,安徽 蚌埠 233000)
目的: 研究大豆异黄酮(SI)对全脑缺血/再灌注大鼠脑组织线粒体超微结构、细胞凋亡和细胞色素C(Cyt-C)、caspase-3及caspase-9表达的影响,探讨大豆异黄酮对脑缺血/再灌注损伤的作用及机制。方法: 60只健康成年SD 大鼠随机分为假手术组(sham)、缺血再灌注组(I/R)和大豆异黄酮预处理组(SI)。SI组给予SI 120 mg·kg-1·d-1连续灌胃21 d,其余2组用等体积生理盐水灌胃,每天1次,第22天I/R组和SI组行手术阻断三血管制备全脑缺血/再灌注模型。缺血1 h,再灌1 h后处死,取大脑皮层,光镜观察脑细胞形态学变化,透射电镜观察线粒体超微结构变化,流式细胞术检测细胞凋亡率,半定量RT-PCR法和免疫组织化学法测定脑组织中Cyt-C、caspase-9及caspase-3的表达。结果: I/R组线粒体膜崩解、嵴消失,脑细胞大量凋亡。与I/R组相比,大豆异黄酮预处理能明显改善线粒体超微结构的损伤,减少脑细胞凋亡率(P<0.01)。I/R组Cyt-C、caspase-9和caspase-3 mRNA的表达和蛋白的含量高于sham 组(P<0.01),与I/R组相比,SI组Cyt-C、 caspase-9及caspase-3 mRNA 和蛋白的表达显著降低(P<0.01)。结论: 大豆异黄酮可能通过稳定线粒体结构,减少线粒体释放Cyt-C,降低caspase-9和caspase-3的表达,抑制细胞凋亡,从而减轻脑缺血/再灌注损伤。
大豆异黄酮; 缺血/再灌注; 细胞凋亡; 线粒体损伤; Caspase-9; Caspase-3
缺血性脑中风已成为成年患者致死或致残的最常见原因之一。恢复血供是治疗缺血脑组织的最有效方法,却可诱发缺血的脑组织进一步损伤[1]。因此,探索缺血-再灌注损伤机制及寻找防治新途径一直备受关注。流行病学研究表明:食用含黄酮类食物,尤其是异黄酮食物,与脑中风的发生率呈负相关[2]。大豆异黄酮(soybean isoflavones, SI)是大豆中的异黄酮类化合物的总称,与雌激素具有相似的结构与分子量,却少有动物雌激素临床上的一些毒负作用,被称为“植物雌激素”,具有抗肿瘤、防治心血管疾病等生理活性[3]。近来研究发现,SI能提高脑缺血大鼠的抗氧化能力、减少缺血脑细胞线粒体释放细胞色素C(cytochrome C,Cyt-C)、阻止脑细胞凋亡[4],但SI对脑缺血再灌注诱导的脑皮层神经元线粒体超微结构及凋亡蛋白酶活性的变化报道较少。本研究利用SI预处理,观察大鼠全脑缺血再灌注模型脑细胞形态及线粒体超微结构变化、脑组织Cyt-C、caspase-9及caspase-3表达、脑细胞凋亡发生率等,探讨SI对脑缺血再灌注损伤的保护作用及其机制。
材 料 和 方 法
1 材料、动物及分组
低温离心机(Eppendorf);TGradient梯度 PCR 仪(Biometra); DY-A型电泳仪(上海生化所申华生化技术公司);Tanon GIS-1000凝胶成像系统(上海天能科技有限公司);JEM-1230透射电镜;流式细胞仪(BD)。大豆异黄酮(陕西宝鸡中药饮片加工有限公司,纯度40%);Annexin V-FITC/PI试剂盒(晶美生物工程有限公司);PCR试剂盒(Fermentas);免疫组化试剂盒(北京博奥森生物技术有限公司)。
健康成年雄性SD大鼠60只,体重180~220 g,由蚌埠医学院实验动物中心供应。实验动物随机分为假手术组(sham)、脑缺血再灌注组(I/R)和大豆异黄酮预处理组(SI)。
2 主要方法
2.1 动物给药方法 用超纯水配制成12 g/L的大豆异黄酮溶液,SI组按照120 mg/kg BW的剂量给予>大豆异黄酮灌胃,每天1次,连续21 d。Sham组和I/R组灌胃等体积的生理盐水。
2.2 动物模型的制备 灌胃21 d后于第22天进行手术。Sham 组仅手术不缺血,I/R组及SI组术后用三血管阻断法复制大鼠全脑缺血再灌注损伤模型[5]。取鼠称重,10%水合氯醛(3.5 mL/kg) 腹腔注射麻醉,颈部正中切开,分离双颈总动脉,暴露基底动脉,夹闭上述三支血管,监测脑电图(EEG),EEG在几秒内成一直线时,全脑缺血模型复制成功,缺血1 h 后再恢复灌流1 h,将大鼠处死并迅速断头取脑。
2.3 HE 染色及线粒体超微结构的观察 大脑浸泡于10%甲醛溶液中固定24 h,固定后的脑组织以冠状切面选取最大截面积上下各1 mm共切取2 mm脑组织,常规脱水、透明、石蜡包埋、切片(4 μm)干燥,HE染色,光镜下观察脑皮层病理学变化。另取1 mm × 1 mm × 1 mm 组织后固定于2.5%戊二醛,缓冲液固定6 h,1%锇酸后固定1 h,浓度梯度乙醇脱水,环氧树脂包埋、烘烤, 半薄切片(70 nm)醋酸铀浸泡及枸橼酸铅染色,冲洗、干燥等处理后,用日产JEM-1230 型透射电镜摄片观察大脑皮层细胞线粒体超微结构。
2.4 细胞凋亡检测 脑缺血再灌注1 h后取脑组织制备脑细胞悬液(浓度1×109/L),取100 μL细胞悬液于流式检测管中,依次加入Annexin V/ FITC 2.5 μL和PI 5 μL,避光作用15 min,再加入结合缓冲液400 μL,流式细胞仪检测细胞凋亡率,每个样品计数10 000个细胞。
2.5 半定量RT-PCR法检测Cyt-C、caspase-9及caspase-3 mRNA的表达 Trizol法提取总RNA,参照试剂盒说明书逆转录合成cDNA,在PCR 仪中将引物按步骤加入cDNA 中进行序列扩增,取5 μL各扩增产物在1%琼脂糖(含溴化乙啶 0.5 mg /L)凝胶上电泳(电压100 V,电流45 mA),溴化乙啶显色。采用天能GIS 系统分析软件测定各条带灰度值,计算目的条带Cyt-C、caspase-9及caspase-3与β-actin 灰度的比值。RT-PCR实验所用扩增Cyt-C、caspase-9, caspase-3及β-actin的引物序列见表1。

表1 引物序列
2.6 免疫组织化学染色法检测Cyt-C、caspase-9及caspase-3蛋白的表达 石蜡切片常规脱蜡水化,3% H2O2灭活内源性过氧化物酶,微波修复抗原,山羊血清封闭,滴加Ⅰ抗(兔抗Cyt-C、caspase-3和caspase-9多克隆抗体)及生物素抗兔Ⅱ抗IgG,加入链霉亲和素-生物素-酶复合物液孵育,DAB显色,苏木素轻度复染,脱水透明封片。显微镜下观察阳性显色为棕黄色。阴性对照以PBS代替Ⅰ抗。阳性细胞计数分析:每组取2张切片,在400倍显微镜下观察,大脑皮质区随机取6个视野,计数每个视野中阳性细胞,取平均值。
3 统计学处理
数据应用SPSS 13.0 统计软件处理,实验数据以均数±标准差(mean±SD)表示,多组间比较用单因素方差分析(ANOVA),组间两两比较采用SNK-q检验。
结 果
1 各组脑皮层神经元HE染色形态变化
光镜下,sham组的神经元细胞数目基本正常,细胞完整,胞体饱满,胞核圆形,核仁清晰;I/R组的神经元数量减少,间质水肿,胞体肿胀,细胞呈圆形或三角形,胞膜有溶解,胞核固缩、边集,呈新月形、块状小体甚至核碎片消失;SI组的多数神经细胞形态结构基本完整,胞核清晰可见,部分神经元轻度肿胀,部分细胞核固缩,细胞间隙略宽,见图1。
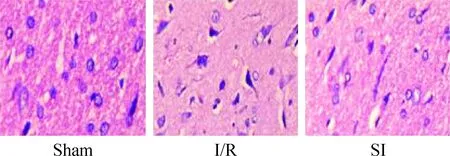
Figure 1.Morphological changes of the cortex cells after cerebral ischemia/reperfusion in the rats (HE staining, ×400).
图1 缺血再灌注皮层神经细胞形态学的变化
2 各组脑皮层神经元线粒体的形态变化
透射电镜下,sham组的神经元细胞形态规则,线粒体膜完整,嵴清晰可见;I/R组的细胞外形不规则,多数线粒体水肿,线粒体膜崩解,嵴消失;SI组的神经细胞结构基本完整,线粒体膜基本完整,嵴突少许破坏,见图2。

Figure 2.The ultra-microstructure of the cortex cells after cerebral ischemia/reperfusion in the rats observed under transmission electronic microscope (× 15 000).
图2 脑缺血再灌注后脑皮层细胞超微结构的透射电镜观察
3 各组脑皮层神经元Cyt-C、caspase-9及caspase-3 mRNA的表达
经PCR扩增,1%琼脂糖凝胶电泳后,凝胶成像可见Cyt-C、caspase-9和caspase-3条带亮度,sham组微弱,I/R组最亮,SI组的亮度比I/R组明显减弱,内参照β-actin在各组亮度较一致,见图3。
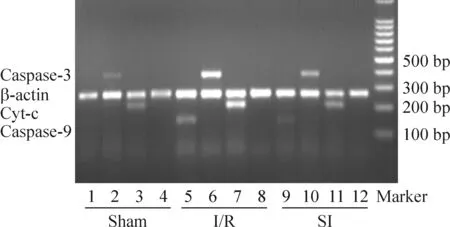
Figure 3.The mRNA expression of Cyt-C, caspase-9 and caspase-3 in different groups.
图3 各组Cyt-C、caspase-9和caspase-3 mRNA的表达结果
电泳图谱经天能GIS 系统分析软件分析(以目的基因与内参照β-actin的吸光度比值作为半定量指标),可见I/R组的Cyt-C和caspase-9 mRNA的表达较sham组明显增多(P<0.01);SI组的Cyt-C和caspase-9 mRNA的表达较sham组也增多,但无显著差异(P>0.05),但较I/R组显著降低(P<0.01);I/R组、SI组的caspase-3 mRNA的表达较sham组明显增多(P<0.01),但SI组caspase-3 mRNA的表达较I/R组显著降低(P<0.05),见表2。

表2 各组Cyt-C、caspase-9和caspase-3 mRNA表达的比较
*P<0.01vssham group;#P<0.05,# #P<0.01vsI/R group.
4 各组脑皮层神经元Cyt-C、caspase-9及caspase-3 蛋白的表达
免疫组化染色阳性细胞胞质呈棕黄色,阴性对照细胞呈淡蓝色,胞浆中无棕黄色颗粒物。Sham组可见少数散在的弱阳性细胞,I/R组细胞呈片状强阳
性表达,SI组阳性细胞表达介于sham组和I/R组之间,见图4~6。 与sham组比较,I/R组和SI组Cyt-C、caspase-9及caspase-3 蛋白表达的阳性细胞数明显增多(P<0.01),但SI组较I/R组阳性细胞数明显减少(P<0.01),见图4~6。

Figure 4.The protein expression of Cyt-C of the cortex cells after cerebral ischemia/reperfusion in the rats. A: immunohistochemical staining (× 400); B: statistical analysis of positive cells. Mean±SD.n=10.**P<0.01vssham group;# #P<0.01vsI/R group.
图4 脑缺血再灌注大鼠皮层Cyt-C蛋白的表达
5 流式细胞术检测脑细胞凋亡结果
凋亡早期,胞内磷脂酰丝氨酸外翻,与Annexin-V有高度亲合力;凋亡晚期细胞和坏死细胞可以被PI染色。实验对缺血再灌注1 h后的脑细胞进行Annexin V-FITC 和PI染色,流式细胞术检测细胞凋亡率的结果发现,IR组的Annexin V 阳性细胞率明显高于sham组(P<0.01),而SI组的Annexin V 阳性细胞率明显低于IR组(P<0. 01),见图7。
讨 论
我们目前的研究结果表明,大豆异黄酮通过减轻神经元凋亡来保护缺血再灌注诱导损伤的脑细胞。抑制神经元的凋亡与大豆异黄酮减轻缺血再灌注诱导的线粒体结构的损伤、减少线粒体内Cyt-C释放到胞浆有关。大豆异黄酮也降低了缺血再灌注后脑组织caspase-9及caspase-3的表达。

Figure 5.The protein expression of caspase-9 of the cortex cells after cerebral ischemia/reperfusion in the rats. A: immunohistochemical staining (×400); B: statistical analysis of positive cells. Mean±SD.n=10.**P<0.01vssham group;# #P<0.01vsI/R group.
图5 脑缺血再灌注大鼠皮层 caspase-9蛋白的表达
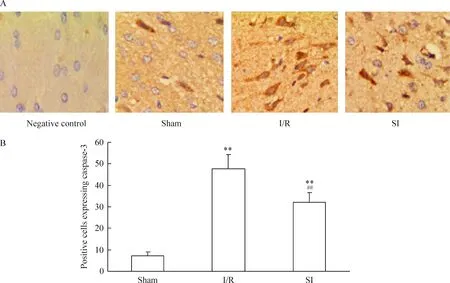
Figure 6.The protein expression of caspase-3 of the cortex cells after cerebral ischemia/reperfusion in the rats. A: immunohistochemical staining (×400); B: statistical analysis of positive cells. Mean±SD.n=10.**P<0.01vssham group;# #P<0.01vsI/R group.
图6 脑缺血再灌注大鼠皮层 caspase-3蛋白的表达
脑缺血再灌注最严重的损伤性变化是脑细胞死亡,凋亡是细胞死亡的重要形式。哺乳动物细胞凋亡有2种主要的途径。一是死亡受体介导的细胞外凋亡途径,二是线粒体介导的细胞内凋亡途径[6]。以往人们认为线粒体是能量生成和储存的场所,自人们发现线粒体膜上具有调控凋亡的Bcl-2的家族成员[7],线粒体功能和结构的变化便成为研究细胞凋亡的热点,线粒体内的Cyt-C在凋亡调控中的作用也引起学者的关注[8]。Cyt-C是线粒体呼吸链中传递电子功能的载体,位于线粒体内膜外侧呼吸链复合酶体Ⅲ~Ⅵ之间。各种原因导致线粒体受损,线粒体膜通透性转换孔(membrane permeability transi-tion pore,MPTP)开放,线粒体内多种蛋白释放到胞浆,其中最关键的是Cyt-C,其进入胞浆与胞浆内凋亡蛋白酶激活因子1及dATP结合引发caspases 级联反应,诱导细胞凋亡[9]。Caspase家族是一组对底物天门冬氨酸部位有特异水解作用、活性中心富含半胱氨酸的蛋白酶家族。在细胞凋亡分子机制中,caspase呈不可逆性水解底物的级联放大反应,其中caspase-3在细胞凋亡中起着关键性的作用,激活的caspase-3进一步裂解下游的DNA依赖性蛋白激酶等,促进细胞凋亡[10]。Caspase-3的激活在线粒体凋亡途径中依赖于线粒体Cyt-C的释放和caspase-9的激活[11]。本研究发现,全脑缺血1 h、再灌注1 h后,大鼠大脑皮层神经元部分线粒体膜崩解,嵴消失,线粒体结构的完整性被破坏。对胞浆内Cyt-C、caspase-9和caspase-3活性行RT-PCR扩增检测提示脑组织Cyt-C、caspase-9和caspase-3的mRNA表达均增加,免疫组织化学检测Cyt-C、caspase-9和caspase-3蛋白表达的阳性细胞数也明显增加。利用流式细胞仪对大脑皮层细胞凋亡率检测发现,Annexin V 阳性细胞凋亡率明显增高。这些均提示线粒体结构的损伤、线粒体内Cyt-C的释放、caspase-9和caspase-3活性增强参与了缺血再灌注早期脑组织损伤,与大脑皮层细胞凋亡率增加密切相关。这也同Christophe 等[12]的实验结果相一致,因此,寻求有效保护线粒体结构的完整性、减少Cyt-C的释放 、抑制caspase-9和caspase-3活性的药物成为降低缺血再灌注脑组织损伤的靶点之一。
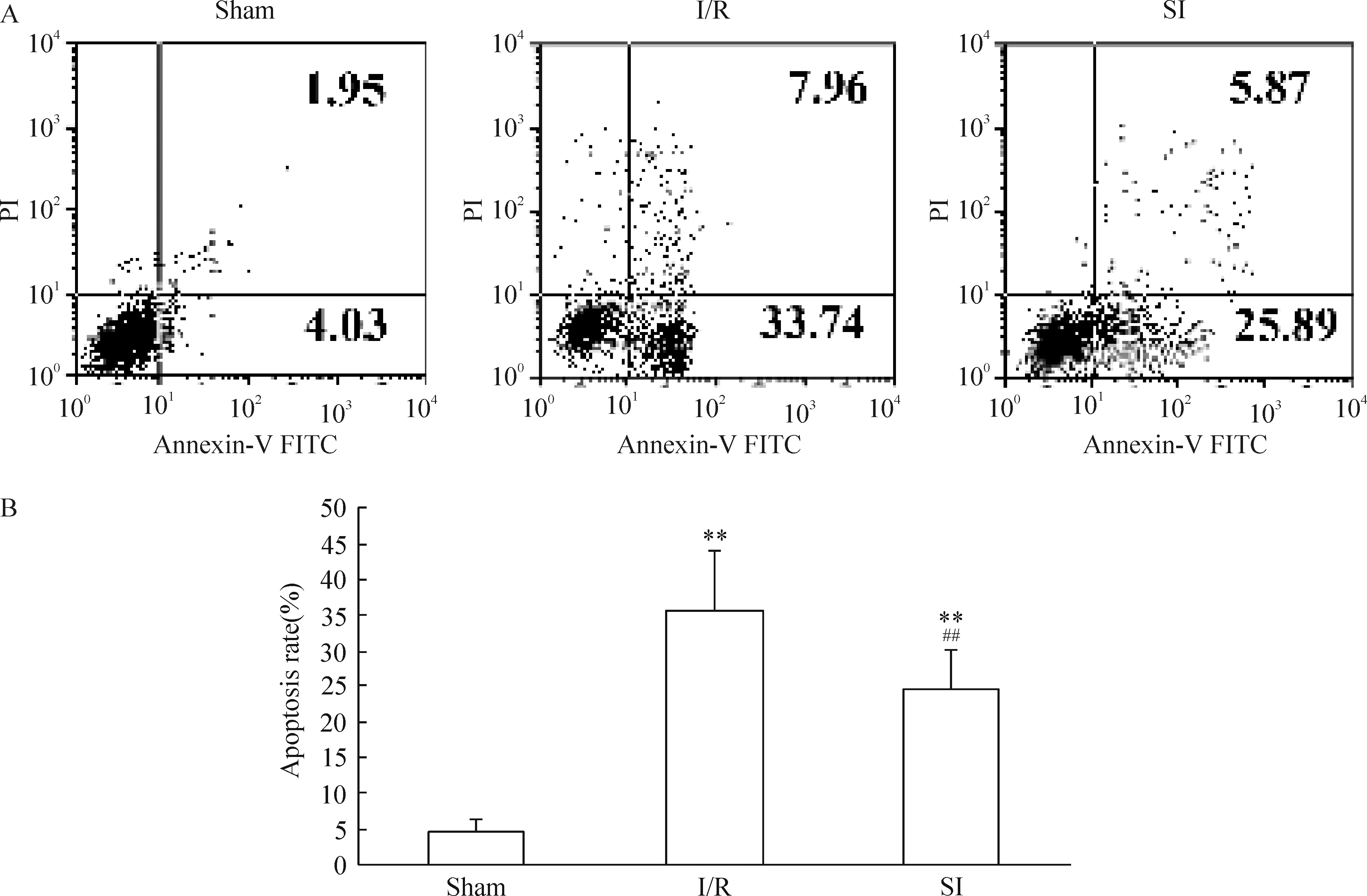
Figure 7.Flow cytometry analysis of apoptotic rate of the cortex cells. A: Flow cytometry analysis; B: statistical analysis. Mean±SD.n=6.**P<0.01vssham group;# #P<0.01vsI/R group.
图7 各实验组脑皮层细胞凋亡率情况
大豆异黄酮是大豆和大豆制品中发现的化合物,作为雌激素的类似物目前已知有多种生理特性,如抗肿瘤、抗女性绝经后的骨质疏松症和抗衰老,还具有提高学习、记忆能力和防治心脏病、糖尿病及川崎病等功能[13]。随着人们对大豆异黄酮药理作用的深入研究,发现大豆异黄酮能减少大脑中动脉阻塞引起的脑组织梗死面积[14],降低细胞浆中Cyt-C的含量、减少细胞凋亡[4]。体外实验研究也发现,大豆异黄酮能减轻由谷氨酸和毒胡萝卜素诱导的大脑皮层培养细胞的凋亡[15]。在大豆异黄酮对抗缺血性脑损伤作用机制研究中Huang 等[16]发现,大豆异黄酮可通过激活Notch信号途径降低脑缺血再灌注诱导的皮层细胞的凋亡率,并认为大豆异黄酮从10 mg·kg-1·d-1增至50 mg·kg-1·d-1,其脑保护作用具有剂量依赖性。我们在研究大豆异黄酮对缺血再灌注后脑组织NF-κB和TNF-α表达影响的实验中所选取大豆异黄酮灌胃的剂量分别为60 mg·kg-1·d-1、120 mg·kg-1·d-1和240 mg·kg-1·d-1,发现120 mg·kg-1·d-1的剂量在脑保护作用中效果相对较好(尚未发表),故本研究按照大豆异黄酮120 mg·kg-1·d-1的剂量给予大鼠灌胃进行药物预处理,观察大豆异黄酮对大鼠全脑缺血再灌注后大脑皮层细胞凋亡的影响,这也与其它文献所选取的药物应用剂量相一致[17]。本实验研究利用120 mg·kg-1·d-1剂量的大豆异黄酮灌胃观察其对脑缺血1 h、再灌注1 h脑细胞凋亡率的影响,由于实验条件的限制,我们并未进一步延长缺血再灌注的时间。在缺血再灌注早期,发现大豆异黄酮减轻了大脑皮层细胞形态损伤性变化并降低了脑细胞的凋亡率。为探讨大豆异黄酮减轻细胞凋亡的机制,我们进一步观察细胞线粒体的超微结构的变化及胞浆Cyt-C的活性,发现大豆异黄酮预处理大鼠缺血再灌注后脑细胞线粒体结构基本保持完整,部分轻度水肿,嵴少许破坏。与单纯缺血再灌注的脑组织相比,脑组织Cyt-C mRNA表达也明显降低,免疫组织化学检测Cyt-C蛋白表达的阳性细胞数也显著下降。进一步对线粒体凋亡途径中Cyt-C蛋白的下游信号蛋白caspase-9和caspase-3活性的研究发现,脑组织caspase-9和caspase-3的mRNA表达明显降低,蛋白表达的阳性细胞数也显著下降。尽管Cyt-C能激活caspase-9进而活化caspase-3,但大豆异黄酮是抑制线粒体内Cyt-C释放到胞浆间接抑制caspase-9和caspase-3活性,还是直接抑制胞浆中caspase-9和caspase-3活性,仍有待进一步研究。
综上所述,大豆异黄酮可能通过减轻脑缺血再灌注后线粒体结构损伤进而减少线粒体内Cyt-C的释放,并下调胞浆中caspase-9和caspase-3的表达,减轻缺血再灌注诱导的脑细胞凋亡,保护受损脑细胞,这可能是大豆异黄酮抗缺血再灌注脑损伤的机制之一。
[1] Kirino T. Delayed neuronal death in the gerbil hippocampus following ischemia[J]. Brain Res, 1982, 239(1):57-69.
[2] Kokubo Y, Iso H, Ishihara J, et al. Association of dietary intake of soy, beans, and isoflavones with risk of cerebral and myocardial infarctions in Japanese populations: the Japan Public Health Center-based (JPHC) study cohort I[J]. Circulation, 2007, 116(22):2553-2562.
[3] Messina M. A brief historical overview of the past two decades of soy and isoflavone research[J]. J Nutr, 2010, 140(7):1350S-1354S.
[4] Qian Y, Guan T, Huang M, et al. Neuroprotection by the soy isoflavone, genistein, via inhibition of mitochondria-dependent apoptosis pathways and reactive oxygen induced-NF-κB activation in a cerebral ischemia mouse mo-del[J]. Neurochem Int, 2012, 60(8):759-767.
[5] 董银凤,陈前芬. 大豆异黄酮对大鼠脑缺血再灌后ATP 酶及bcl-2 和bax 的影响[J]. 蚌埠医学院学报, 2012, 37(1):8-11.
[6] Rao VK, Carlson EA, Yan SS. Mitochondrial permeability transition pore is a potential drug target for neurodegeneration[J]. Biochim Biophys Acta, 2014, 1842(8):1267-1272.
[7] Hockenbery D, Nuez G, Milliman C,et al. Bcl-2 is an inner mitochondrial membrane protein that blocks programmed cell death[J]. Nature, 1990, 348(6299):334-336.
[8] 张闻多,丁文惠. 细胞凋亡与凋亡诱导因子[J]. 中国病理生理杂志, 2006, 22(9): 1858- 1862.
[9] 熊 燕,张 梅,陈 菲,等. 线粒体功能障碍与心血管疾病[J]. 中国病理生理杂志, 2013, 29(2):364-370.
[10]Friedlander RM. Apoptosis and caspases in neurodegene-rative diseases[J]. N Engl J Med, 2003, 348(14):1365-1375.
[11]Slee EA, Harte MT, Kluck RM, et al. Ordering the cytochrome c-initiated caspase cascade: hierarchical activation of caspases-2, -3, -6, -7, -8, and -10 in a caspase-9-dependent manner[J]. J Cell Biol, 1999, 144(2):281-292.
[12]Christophe M, Nicolas S. Mitochondria: a target for neuroprotective interventions in cerebral ischemia-reperfusion[J]. Curr Pharm Des, 2006, 12(6):739-757.
[13]Wang Q, Ge X, Tian X, et al. Soy isoflavone: the multipurpose phytochemical (Review) [J]. Biomed Rep, 2013, 1(5):697-701.
[14]Schreihofer DA, Do KD, Schreihofer AM. High-soy diet decreases infarct size after permanent middle cerebral artery occlusion in female rats[J]. Am J Physiol Regul Integr Comp Physiol, 2005, 289(1):R103-R108.
[15]Schreihofer DA, Redmond L. Soy phytoestrogens are neuroprotective against stroke-like injuryinvitro[J]. Neuroscience, 2009, 158(2):602-609.
[16]Huang G, Cao X, Zhang X, et al. Effects of soybean isoflavone on the notch signal pathway of the brain in rats with cerebral ischemia[J]. J Nutr Sci Vitaminol (Tok-yo), 2009, 55(4):326-331.
[17]么晓轶,于纪珠,李 颖. 大豆异黄酮对去势雌大鼠缺血再灌注脑组织细胞凋亡及calpain 表达的影响[J]. 中国病理生理杂志, 2011, 27(12):2333-2337.
Effects of soybean isflavones on mitochondrial damage and neuronal apoptosis induced by cerebral ischemia/reperfusion
ZHAO Shi-di1, CHEN Yao2, JIANG Li-na1, DONG Yin-feng1, CHEN Qian-fen1
(1DepartmentofPathophysiology,2TheFirstAffiliatedHospital,BengbuMedicalCollege,Bengbu233000,China.E-mail:cqf14621@126.com)
AIM: To study the effects of soybean isoflavones on mitochondrial ultrastructure, neuronal apoptosis and expression of cytochrome C, caspase-9 and caspase-3 in the rats with cerebral ischemia/reperfusion.METHODS: Adult healthy SD rats (n=60) were randomly divided into 3 groups: sham group, ischemia/reperfusion injury (I/R) group and soybean isoflavone (SI) pretreatment group. Soybean isoflavones (120 mg·kg-1·d-1) were fed by gastric lavage for 21 d. The global ischemia/reperfusion model of the rats was established by blocking 3 vessels, and then reperfused for 1 h after 1 h of ischemia. The morphological change of the cerebral cortex cells was observed under light microscope. The mitochondrial ultrastructure of the cerebral cortex cells was determined by transmission electron microscope. The apoptotic rate of the cerebral cortex cells was detected by flow cytometry. The expression of cytochrome C, caspase-9 and caspase-3 in the cerebral cortex cells was determined by semi-quantitative RT-PCR and immunohistochemical techniques.RESULTS: Disintegration of mitochondria membrane and disappearance of the mitochondrial cristae were seen in I/R group. Compared with I/R group, the change of ultrastructure of mitochondria was significantly improved by soybean isoflavone pretreatment, and the neuronal apoptotic rate was also significantly decreased (P<0.01). The mRNA expression and protein content of cytochrome C, caspase-9 and caspase-3 in I/R group were obviously higher than those in sham group (P<0.01). Compared with I/R group, the mRNA expression and protein content of cytochrome C, caspase-9 and caspase-3 in SI group were significantly decreased (P<0.01).CONCLUSION: Soybean isoflavones attenuate cerebral ischemia/reperfusion injury by stabilizing the structure of mitochondria, preventing cytochrome C release to the cytoplasm, inhibiting the activation of caspase-9 and caspase-3 and decreasing cell apoptosis.
Soybean isoflavones; Ischemia/reperfusion; Apoptosis; Mitochondrial damage; Caspase-9; Caspase-3
1000- 4718(2014)12- 2172- 07
2014- 07- 11
2014- 09- 01
安徽省自然科学基金资助项目(No. 1408085MH185);安徽省教育厅自然科学研究基金资助项目(No. KJ2012B102)
R363.2;R743.3
A
10.3969/j.issn.1000- 4718.2014.12.010
△通讯作者 Tel: 0552-3175283; E-mail: cqf14621@126.com

