胰岛素抗性对肝癌HepG2细胞生物学功能及顺铂敏感性的影响*
刘 鹏, 黄美松, 胡阳黔△
(1湖北医药学院附属东风医院消化内科,湖北 十堰 442008;2十堰市中西医结合医院内分泌科,湖北 十堰 442011)
胰岛素抗性对肝癌HepG2细胞生物学功能及顺铂敏感性的影响*
刘 鹏1, 黄美松2, 胡阳黔1△
(1湖北医药学院附属东风医院消化内科,湖北 十堰 442008;2十堰市中西医结合医院内分泌科,湖北 十堰 442011)
目的: 研究胰岛素抗性在原发性肝癌细胞中的生物学功能及对顺铂抗癌药物的抗药敏感性的影响。方法: 利用高浓度的胰岛素连续培养HepG2细胞72 h获得抗胰岛素的HepG2细胞(HepG2/IR),检测HepG2/IR细胞的黏附、迁移和侵袭的能力改变以及对顺铂的敏感性;同时利用流式细胞术测定HepG2和HepG2/IR中胰岛素受体和葡萄糖转运蛋白2的表达情况。结果: 胰岛素抗性HepG2/IR细胞中葡萄糖消耗量显著降低;胰岛素受体和葡萄糖转运蛋白2表达下调;而HepG2/IR细胞的黏附、迁移和侵袭能力明显增强;同时HepG2/IR细胞对顺铂的敏感性降低;但用吡格列酮处理HepG2/IR细胞后其黏附、迁移和侵袭能力显著减弱。结论: 胰岛素抗性与HepG2细胞的耐药性、细胞黏附、迁移和侵袭能力密切相关。这有助于解释具有胰岛素抗性的癌症患者对化疗失敏的临床现象。
HepG2细胞; 胰岛素抵抗; 细胞凋亡; 细胞迁移; 顺铂
胰岛素抗性(insulin resistance,IR)通常指机体、器官、组织或细胞对胰岛素的敏感性降低[1]。IR可由一系列上游或下游事件诱导发生,如减少胰岛素受体数量,降低胰岛素与其受体的亲和力,编码胰岛素或胰岛素受体基因的突变,减少葡萄糖转运蛋白的数量以及胰岛素信号转导通路的失活等[2-4]。而肝脏在糖、脂代谢中具有重要的地位,是IR的三大靶器官之一。大量研究结果表明IR是原发性肝细胞癌(hepatocellular carcinoma,HCC)发生和发展过程中的一个重要风险指标和术后复发的重要预后因子[5-6]。HCC细胞复杂的抗药性机制是传统的化疗方法难以将其彻底消除的重要因素,但关于IR与HCC多种抗药性之间的关系尚未见研究;同时肿瘤细胞的黏附、侵袭和转移的生物学功能与肿瘤的恶性程度也密切相关[7],但IR对HCC生物学功能的影响研究也少见。因此本研究以肝癌细胞系HepG2为HCC的研究对象,建立胰岛素抗性的肝癌细胞HepG2/IR,检测细胞黏附、迁移和侵袭能力等细胞功能的改变及与常用抗癌药物顺铂抗药性之间的关系,从而明确IR与HCC细胞生物学功能的关系,以进一步验证IR在HCC肿瘤发生发展及产生耐药性中的重要地位。
材 料 和 方 法
1 试剂
HepG2细胞购自ATCC;DMEM高糖培养基购自Gibco;澳洲特级胎牛血清(fetal bovine serum,FBS)购自天津康源生物技术有限公司;MTT试剂、抗生素(青霉素和链霉素)购自北京金博益生物技术有限公司;胰岛素、胰岛素受体抗体和葡萄糖转运蛋白2抗体购自R&D;顺铂(cisplatin)和吡格列酮(pioglitazone,PIO)购自Sigma;Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;Transwell板购自Millipore。
2 方法
2.1 胰岛素抗性HepG2/IR细胞模型的建立 人肝癌细胞HepG2培养于含有10%FBS、1%青霉素和1%链霉素的高糖型DMEM培养基中,当细胞密度达到80~90%左右时进行细胞传代,细胞置于37 ℃、5% CO2的完全湿度培养箱中。胰岛素抗性HepG2细胞株(HepG2/IR)的建立参考文献中方法[10-11],先用无血清的DMEM培养基培养HepG2细胞6 h,再将0.5和1 μmol/L 胰岛素分别处理 HepG2细胞48 h和72 h,随后用无胰岛素的DMEM培养基继续培养72 h之后弃掉培养基,加入无酚红的DMEM培养基培养24 h。在倒置显微镜下观察HepG2/IR 细胞在不同时期的形态变化。收集细胞培养液,采用GOD-POD法借助Hitachi 7600-020自动生化分析仪测定细胞培养液中的葡萄糖含量。为了消除活细胞代谢对检测结果的影响,我们运用MTT法校正细胞对葡萄糖的消耗量,计算方式为葡萄糖消耗量/A值。
2.2 HepG2/IR细胞胰岛素耐药性稳定性检测 实验组的HepG2/IR细胞和对照组的HepG2细胞经消化计数后分别接种于24孔板中培养24 h,弃掉培养基后加入终浓度为0.5 μmol/L 胰岛素的DMEM培养基,细胞置于37 ℃、5% CO2的完全湿度培养箱中继续培养72 h,收集细胞上清,按上述方法测定细胞培养液中葡萄糖的消耗量,计算实验组的HepG2/IR细胞和对照组的HepG2细胞的葡萄糖消耗量的比例,判定HepG2/IR细胞对胰岛素耐药性的稳定性。
2.3 HepG2和HepG2/IR细胞胰岛素受体和葡萄糖转运蛋白2含量的测定 将对数生长期的HepG2和HepG2/IR细胞经消化处理后接种24孔板,培养24 h后弃掉培养基,在不同组中各加入胰岛素受体抗体(1∶50,1% BSA稀释)和葡萄糖转运蛋白受体的抗体(1∶50,1% BSA稀释),37 ℃孵育1 h,PBS洗涤,再加入含终浓度为0.5 μmol/L胰岛素DMEM培养基,对照组为无胰岛素的DMEM培养基,继续培养72 h后收集细胞,加入荧光素标记的Ⅱ抗(1∶200,1% BSA稀释),37 ℃避光孵育30 min。用流式细胞仪测定2种细胞中胰岛素受体和葡萄糖转运蛋白2阳性细胞的比例和平均荧光强度。
2.4 Annexin V/PI染色测定细胞凋亡 将对数生长期的HepG2细胞,HepG2/IR细胞和PIO处理的HepG2/IR细胞经消化后接种到24孔板中,培养24 h后弃掉培养基,加入含终浓度为16 mg/L顺铂的DMEM培养基作用48 h后收集细胞,PBS洗涤,按照Annexin V试剂盒说明书操作,先加入500 μL的binding buffer重悬细胞,再加入5 μL FITC标记的Annexin V和5 μL PI混匀,室温下避光孵育15 min,运用流式细胞仪检测细胞凋亡。
2.5 MTT实验测定细胞对顺铂的敏感性 将对数生长期的HepG2细胞,HepG2/IR细胞和PIO处理的HepG2/IR细胞经消化计数后,以细胞密度为1×108/L接种到96孔板中,培养24 h后弃掉培养基,每孔加入含终浓度为16 mg/L顺铂,对照组不加顺铂,置于37 ℃、5% CO2的完全湿度条件下继续培养44 h和68 h。每孔加入20 μL 5 g/L MTT,37 ℃继续培养4 h,弃掉培养液,每孔加入150 μL DMSO,置于摇床上室温振荡5 min,用酶标仪测定490 nm处的A值。按下式计算细胞增殖抑制率:
细胞增殖抑制率(%)
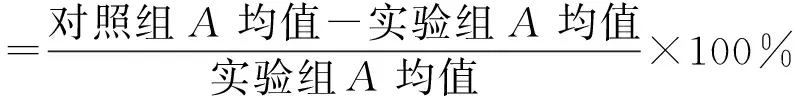
由公式计算出顺铂对细胞的半数抑制浓度(IC50)。
2.6 细胞黏附实验 向96孔板中加入25 μL 200 mg/L人纤维连接蛋白,将96孔板置于37 ℃ 静置1 h,PBS洗涤3次,室温下晾干,再加入1% BSA (20 μL/well)。将96孔板置于37 ℃ 静置1 h,PBS洗涤3次,室温下晾干备用。将对数生长期的HepG2细胞、HepG2/IR细胞和PIO处理的 HepG2/IR细胞经0.25%的胰蛋白酶消化,以5×105cells/well接种于处理好的96孔板中(100 μL/well),分别培养30 min和1 h后用PBS冲洗去未贴壁的细胞,运用MTT法测定490 nm处每孔细胞的A值,重复3次以上独立重复试验。按下式计算细胞黏附率:

2.7 细胞迁移和侵袭实验 将生长良好的HepG2细胞、HepG2/IR细胞和PIO处理的HepG2/IR细胞用0.25%的胰酶消化,用含0.1% BSA的DMEM培养基重悬细胞,然后在Transwells每个培养孔上室中加入2.5×104个细胞(100 μL/well),置于37 ℃、5% CO2的完全湿度条件下继续培养24 h。下室中加入600 μL含10% FBS的DMEM完全培养基,37 ℃继续培养6 h后用4%多聚甲醛固定、乙醇脱水、结晶紫染色和洗涤。用棉签轻轻擦去上室的贴壁细胞。每组细胞在Transwell实验中设置3个重复孔。在显微镜下(×200倍)观察每组从Transwell上室迁移至微孔膜下层的细胞。同时每个孔在显微镜下随机选择3个视野进行拍照,对迁移的细胞进行计数。细胞侵袭实验参照文献方法[12],Transwell板不用包被人工基底膜,以细胞密度为5×108/L接种于上室中,后续步骤同细胞迁移实验。
3 统计学处理
采用SPSS 17.0软件进行统计学分析,数据用均数±标准误(mean±SEM)表示,组间均数比较分析采用t检验或方差分析,以P<0.05为差异有统计学意义。
结 果
1 HepG2/IR细胞株的建立
观察HepG2/IR细胞模型建立过程中细胞形态学的变化发现,胰岛素最初作用于HepG2细胞时出现少部分死亡,部分细胞脱落且出现不规则状态,随后细胞形态趋于稳定,细胞变小贴壁变牢固出现克隆生长,见图1。测定细胞对葡萄糖的消耗量,结果显示葡萄糖的消耗量随着胰岛素浓度的增加逐渐降低,并呈时间依赖效应,实验组葡萄糖的消耗量与对照组比较有显著差异(P<0.05),这一作用在细胞暴露于胰岛素72 h时最大,与对照组比较有显著差异(P<0.01),见图2。我们通过计算相对葡萄糖的消耗量来观察HepG2/IR细胞对胰岛素耐药性的稳定性,以判断HepG2/IR细胞是否发生对胰岛素耐药性失敏。结果表明HepG2/IR细胞在含有或不含有胰岛素的DMEM培养基中培养72 h后,相对葡萄糖的消耗量无明显变化,与对照组比较无统计学差异,见图3。根据实验结果,选择0.5 μmol/L胰岛素处理细胞72 h作为后续实验作用条件。

Figure 1.The morphological changes of HepG2/IR cell model (HepG2 cells were treated with 0.5 μmol/L insulin) (×100).
图1 HepG2/IR细胞模型建立过程中细胞形态学变化

Figure 2.Glucose consumption of the HepG2 cells. The cells were treated for 48 h and 72 h with different concentrations of insulin. Mean±SEM.n=5.*P<0.05,**P<0.01vscontrol group.
图2 HepG2细胞经不同浓度胰岛素处理48 h和72 h时的葡萄糖消耗量

Figure 3.Relative glucose consumption of HepG2/IR cells in DMEM medium with or without insulin. Mean±SEM.n=5.
图3 HepG2/IR细胞在含胰岛素和不含胰岛素的DMEM培养基的相对葡萄糖消耗量
2 HepG2/IR细胞中胰岛素受体和葡萄糖转运蛋白2表达下调
HepG2/IR细胞和HepG2细胞在无胰岛素的DMEM完全培养基中培养72 h后运用流式细胞术测定细胞中胰岛素受体和葡萄糖转运蛋白2的表达情况,与HepG2细胞相比,HepG2/IR细胞中胰岛素受体和葡萄糖转运蛋白2的表达量分别降低了(80.12±2.54)%和(25.60±3.73)%,见图4。进一步研究结果表明HepG2/IR细胞对胰岛素耐药性至少能维持72 h。
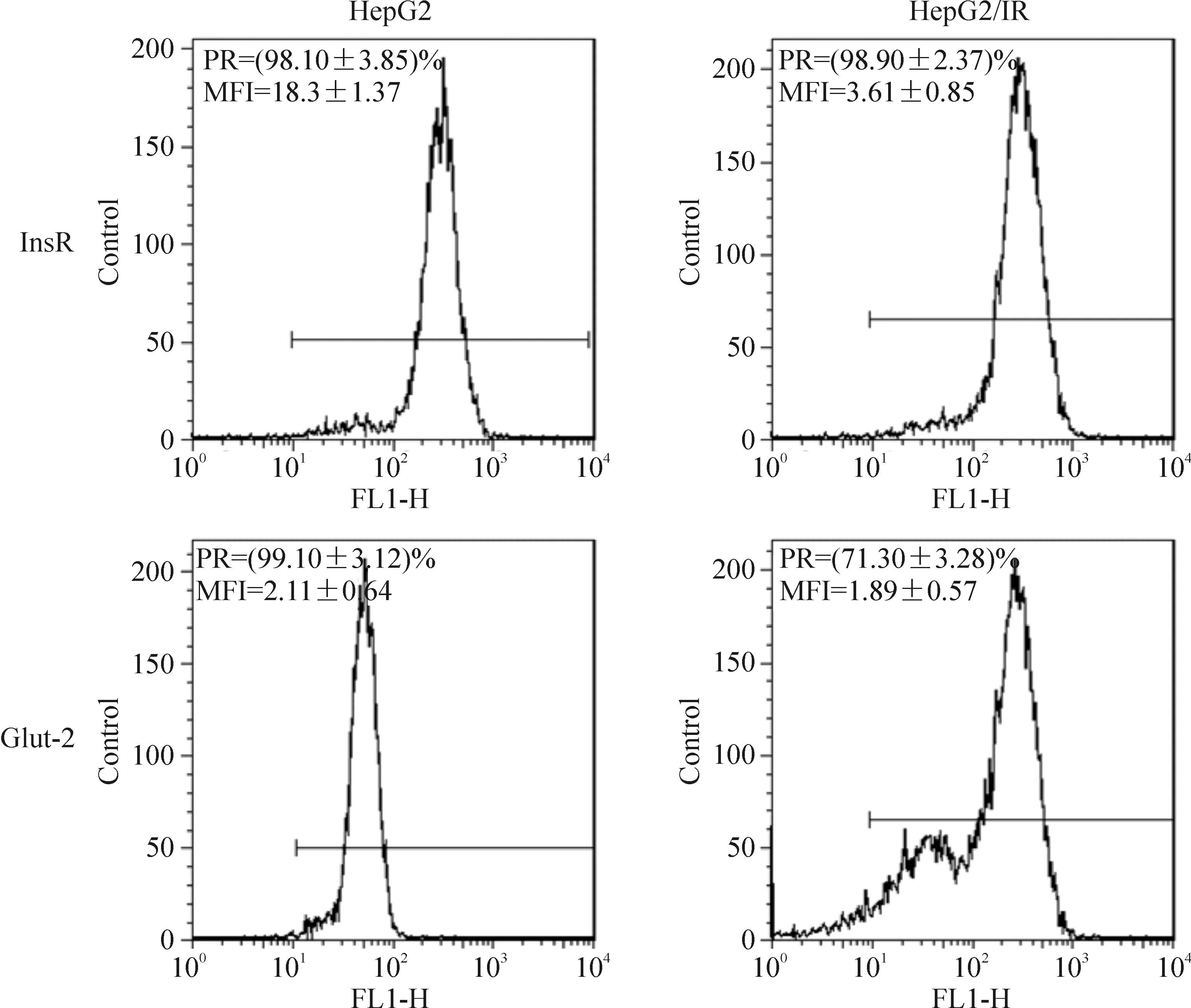
Figure 4.The expression of glucose transporter 2 (Glut-2) and insulin receptor (InsR) in the HepG2/IR cells and HepG2 cells. Mean±SEM.n=5. PR: positive rate; MFI: mean fluorescence intensity.
图4 HepG2/IR细胞和HepG2细胞中胰岛素受体和葡萄糖转运蛋白受体2的表达情况
3 HepG2/IR细胞对顺铂的敏感性降低
MTT结果显示HepG2/IR细胞对顺铂的敏感性显著降低,顺铂分别处理HepG2/IR细胞48 h和72 h后,HepG2/IR细胞对顺铂的半数抑制浓度分别为(17.80±0.37)mg/L和(11.35±0.66)mg/L,明显高于HepG2细胞(P<0.01),提示当HepG2/IR细胞产生胰岛素耐药性之后对顺铂表现出抗性。当HepG2/IR细胞暴露于10 mmol/L吡格列酮24 h时,HepG2/IR细胞对顺铂的敏感性恢复到HepG2细胞的水平,这时HepG2/IR细胞暴露于吡格列酮48 h和72 h时的半数抑制浓度分别为(12.68±0.37)mg/L和(7.10±0.36)mg/L,明显低于HepG2/IR细胞,见图5。用16 mg/L顺铂作用HepG2/IR细胞和HepG2细胞48 h后,流式细胞术的检测结果显示HepG2/IR细胞的凋亡率为(14.20±1.04)%,明显低于HepG2细胞的凋亡率[(30.17±2.89)%,P<0.01]。当HepG2/IR细胞的胰岛素耐药性被吡格列酮中和后, HepG2/IR细胞的凋亡率增加为(26.00±2.06)%,与HepG2/IR细胞的凋亡率比较有显著差异(P<0.01),见图6。研究结果表明HepG2/IR细胞对胰岛素产生耐药性之后,HepG2/IR细胞对顺铂也同样产生抗性。因此,我们推断HepG2细胞产生胰岛素抗性是HepG2细胞对化疗失敏的原因之一。

Figure 5.IC50of cisplatin for HepG2 cells, HepG2/IR cells and HepG2/IR cells treated with pioglitazone (PIO). Mean±SEM.n=5.**P<0.01vsHepG2;&&P<0.01vsHepG2/IR.
图5 顺铂对HepG2细胞、HepG2/IR细胞和PIO处理的HepG2/IR细胞的半数抑制浓度
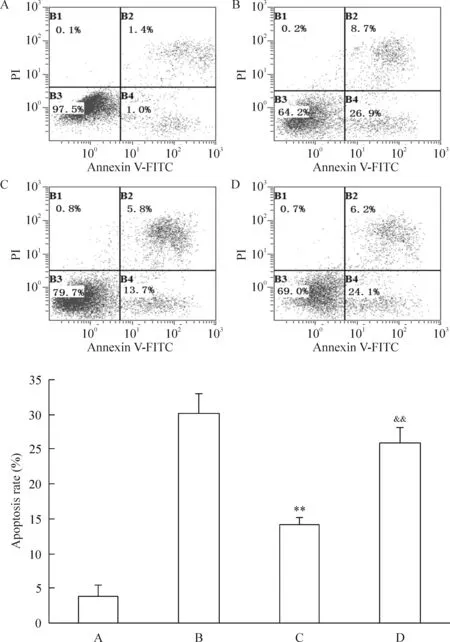
Figure 6.The cell apoptotic rate detected by flow cytometry after cisplatin treatment for 48 h.A: HepG2 cells; B: HepG2 cells treated with cisplatin; C: HepG2/IR cells treated with cisplatin; D: HepG2/IR cells treated with cisplatin and PIO. Mean±SEM.n=5.**P<0.01vsB;&&P<0.01vsC.
图6 流式细胞术检测细胞经顺铂处理48 h后的细胞凋亡率
4 HepG2/IR细胞的黏附力显著增强
HepG2和HepG2/IR细胞培养于人工基质膜蛋白的96孔板中,MTT结果显示HepG2/IR细胞的黏附力显著增强,与HepG2细胞相比HepG2/IR细胞分别培养30 min和1 h时的细胞黏附率分别提高到了(71.50±3.46)%和(72.80±5.37)%。相反,当用吡格列酮处理HepG2/IR细胞后,HepG2/IR细胞的黏附率显著降低,HepG2/IR细胞经PIO分别作用30 min和1 h时,HepG2/IR细胞的黏附率分别降低了(22.40±2.58)%和(25.70±3.24)%(P<0.01),结果证实HepG2/IR细胞的黏附力显著增强,见图7。
5 胰岛素抗性促进HepG2/IR细胞的迁移和侵袭
Transwell迁移实验证明胰岛素抗性能促进HepG2/IR细胞的迁移和侵袭,与HepG2细胞比较,HepG2/IR细胞的迁移和侵袭能力显著增加。经过计数统计发现HepG2/IR细胞的迁移和侵袭数量比HepG细胞的迁移和侵袭数量增加(1.67±0.23)倍和(1.58±0.31)倍(P<0.01)。但胰岛素的耐药性被吡格列酮中和后,HepG2/IR细胞的迁移和侵袭能力显著降低,分别降低(33.15±2.34)% 和(35.21±3.21)%(P<0.05)。研究结果表明胰岛素耐药性能增强HepG2/IR细胞的迁移和侵袭能力,见图8。
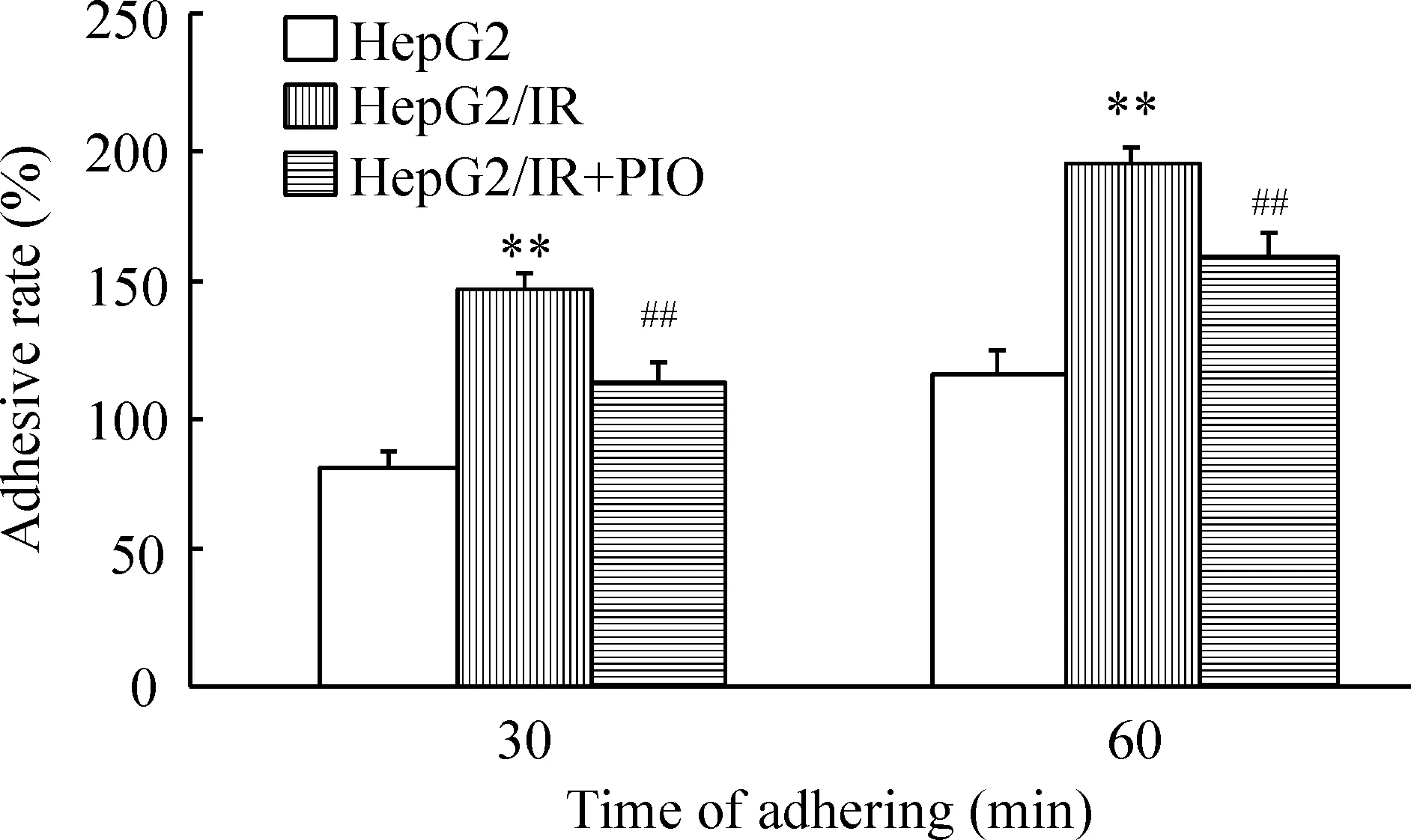
Figure 7.The adhesion of HepG2 cells and HepG2/IR cells. Mean±SEM.n=5.**P<0.01vsHepG2;##P<0.01 vsHepG2/IR.
图7 HepG2细胞、HepG2/IR细胞和PIO处理的HepG2/IR细胞的黏附实验
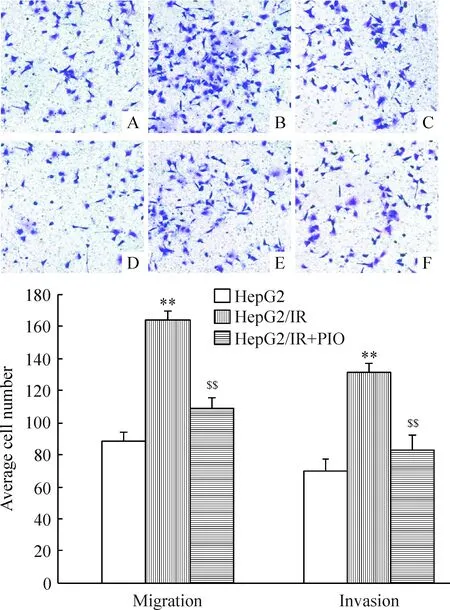
Figure 8.The migration and invasion of HepG2 cells and HepG2/IR cells detected by Transwell assay (×100). A: migration of HepG2 cells; B: migration of HepG2/IR cells; C: migration of PIO-treated HepG2/IR cells; D: invasion of HepG2 cells; E: invasion of HepG2/IR cells; F: invasion of PIO-treated HepG2/IR cells. Mean±SEM.n=5.**P<0.01vsHepG2;$$P<0.01vsHepG2/IR.
图8 Transwell检测HepG2细胞、HepG2/IR细胞和PIO处理的HepG2/IR细胞的迁移和侵袭实验
讨 论
机体活动能影响肿瘤形成过程中的所有阶段[8]。葡萄糖代谢紊乱是恶性肿瘤的特征之一,机体或细胞中葡萄糖代谢紊乱导致机体或细胞胰岛素的敏感性降低,进而产生胰岛素抗药性。因此,有学者提出将胰岛素抗药性视为多种恶性肿瘤的风险指标,控制机体或细胞对胰岛素的抗药性是降低肿瘤术后复发的一项重要手段[9]。大量研究证实胰岛素抗药性可促进肿瘤细胞增殖,值得注意的是机体或细胞对胰岛素产生抗药性之后对化疗或化疗药物也产生抗性。研究证实[10]胰高血糖素能促进胰岛素抗性细胞的增殖和抑制细胞凋亡,提示胰岛素抗药性作为新抗癌药物研发和升级的参考依据。然而,癌细胞对胰岛素抗药性的生物学作用还不完全清楚。已有研究证实肝癌细胞对胰岛素的敏感性降低是肝癌发生的病理学特征之一[11]。HepG2细胞是一种原发性肝癌细胞,具有正常肝细胞的一些特征,例如高表达胰岛素受体。本研究将HepG2细胞暴露于高浓度的胰岛素连续培养72 h后,成功建立胰岛素抗性细胞株——HepG2/IR细胞株。结果显示HepG2/IR细胞对葡萄糖的消耗量显著偏低,胰岛素受体和葡萄糖转运蛋白受体的表达量显著下调,这些特征即为胰岛素抗药性典型的特征。
由于肝癌细胞本身对一些抗癌药物敏感性低以及复杂的抗药性机制使得传统的化疗方法难以将其彻底消除。本研究发现胰岛素抗性能降低HepG2细胞对顺铂的敏感性,从而抑制细胞凋亡。吡格列酮是一种胰岛素增敏剂,常用来增强脂肪细胞,骨骼肌细胞和肝脏组织对胰岛素的敏感性。研究发现中和胰岛素抗性之后,肿瘤细胞对葡萄糖的消耗量显著增加[12]。我们的研究发现HepG2/IR细胞可诱导其对顺铂产生抗药性,而这一作用可通过吡格列酮得以消除。
肿瘤细胞的黏附、迁移和侵袭是癌症复发和转移最直接的原因,研究发现肿瘤细胞的黏附、迁移和侵袭性与肝癌患者术后差有密切相关[13-14]。肝癌患者对胰岛素产生抗性后,胰岛素抗性能促进组织的纤维化,加速肝硬化和高瘦素血症进程,进而促进肿瘤坏死因子的表达,最终导致肝癌患者的预后差[15]。我们的研究首次发现胰岛素抗性直接影响肝癌细胞的迁移,结果显示胰岛素抗性能增强HepG2/IR细胞的黏附、迁移和侵袭能力,从而降低HepG2/IR细胞对顺铂的敏感性。然而,当HepG2/IR细胞对胰岛素的抗性被吡格列酮消除之后,HepG2/IR细胞的黏附、迁移和侵袭能力显著被抑制。因此,本研究结果显示胰岛素抗药性与肝癌患者对化疗或化疗药物失敏以及预后性差存在密切关系,提示肝癌细胞对胰岛素的抗性可作为预测肝癌发展的指标之一,给患者提供最佳的治疗时间和方法。
综上所述,本研究成功建立了胰岛素抗性肝癌细胞株HepG2/IR,肝癌细胞对胰岛素产生抗性之后,对一些化疗药物也同样产生抗药性。我们的研究结果显示HepG2细胞对胰岛素产生抗性后,细胞的黏附、迁移和侵袭能力显著增强。基于我们的研究结果,胰岛素抗性是肝癌患者对化疗失敏的重要原因。因此,降低胰岛素抗性将提高肝癌细胞对化疗药物的敏感性,进而抑制肝癌细胞发生转移,最终实现治疗肝癌的目的。
[1] Hazlehurst JM, Gathercole LL, Nasiri M, et al. Glucocorticoids fail to cause insulin resistance in human subcutaneous adipose tissueinvivo[J]. J Clin Endocrinol Metab, 2013, 98(4):1631-1640.
[2] Ruderman NB, Carling D, Prentki M, et al. AMPK, insulin resistance, and the metabolic syndrome[J]. J Clin Invest, 2013, 123(7):2764-2772.
[3] Yamaoka M, Maeda N, Nakamura S, et al. Gene expression levels of S100 protein family in blood cells are associated with insulin resistance and inflammation (Peripheral blood S100 mRNAs and metabolic syndrome)[J]. Biochem Biophys Res Commun, 2013, 433(4): 450-455.
[4] 张 金, 邢 燕, 王新利, 等. 宫内发育迟缓致大鼠肝细胞胰岛素敏感性降低及体外胰岛素抵抗模型的建立[J]. 北京大学学报:医学版, 2014, 46(3): 464-468.
[5] Yu J, Shen J, Sun TT, et al. Obesity, insulin resistance, NASH and hepatocellular carcinoma[J]. Semin Cancer Biol, 2013, 23(6 Pt B): 483-491.
[6] Montesi L, Mazzotti A, Moscatiello S, et al. Insulin resistance: mechanism and implications for carcinogenesis and hepatocellular carcinoma in NASH[J]. Hepatol Int, 2013, 7(2):814-822.
[7] 张承彦, 谢 鑫, 张春喜, 等. 糖蛋白非转移性黑色素瘤蛋白 B 对人肝癌细胞增殖、 凋亡和侵袭能力的影响及其分子机制[J]. 中国病理生理杂志, 2013, 29(8):1441-1446.
[8] Ledoux S, Yang R, Friedlander G, et al. Glucose depletion enhances P-glycoprotein expression in hepatoma cells role of endoplasmic reticulum stress response[J]. Cancer Res, 2003, 63(21):7284-7290.
[9] Cho N, Momose Y. Peroxisome proliferator-activated receptor γ agonists as insulin sensitizers: from the discovery to recent progress[J]. Curr Med Chem, 2008, 8(17):1483-1507.
[10]Knowles LM, Gurski LA, Engel C, et al. Integrin αvβ3 and fibronectin upregulate slug in cancer cells to promote clot invasion and metastasis[J]. Cancer Res, 2013, 73(20):6175-6184.
[11]Leclercq IA, Da Silva Morais A, Schroyen B, et al. Insulin resistance in hepatocytes and sinusoidal liver cells: mechanisms and consequences[J]. J Hepatol, 2007, 47(1):142-156.
[12]Martens-de Kemp SR, Nagel R, Stigter-van Walsum M, et al. Functional genetic screens identify genes essential for tumor cell survival in head and neck and lung cancer[J]. Clin Cancer Res, 2013, 19(8):1994-2003.
[13]Chen H, Suo K, Cheng Y, et al. Vascular endothelial growth factor C enhances cervical cancer migration and invasion via activation of focal adhesion kinase[J]. Gynecol Endocrinol, 2013, 29(1):20-24.
[14]Wang Z, Li Y, Banerjee S, et al. Down-regulation of Notch-1 and Jagged-1 inhibits prostate cancer cell growth, migration and invasion, and induces apoptosis via inactivation of Akt, mTOR, and NF-κB signaling pathways[J]. J Cell Biochem, 2010, 109(4):726-736.
[15]Gupta SP, Mittal A, Sathian B, et al. Elevated serum insulin is an independent risk factor for hepatocellular carcinoma: a case control study from Nepal[J]. Asian Pac J Cancer Prev, 2013, 14(12):7331-7333.
Effect of insulin resistance on biological function of HepG2 cells and sensitivity to cisplatin
LIU Peng1, HUANG Mei-song2, HU Yang-qian1
(1DepartmentofGastroenterology,TheAffiliatedDongfengHospital,HubeiUniversityofMedicine,Shiyan442008,China;2DepartmentofEndocrinology,ShiyanHospitalofIntegratedTraditionalandWesternMedicine,Shiyan442011,China.E-mail:huyangqian999@163.com)
AIM: To investigate the effect of insulin resistance (IR) on the biological function of hepatocellular carcinoma (HCC) and sensitivity to cisplatin. METHODS: IR was induced in HepG2 cells via incubation with a high concentration of insulin. Afterwards, the effects of IR on adhesion, migration, invasion and sensitivity to cisplatin of the cells were detected.RESULTS: The results indicated that glucose consumption was reduced in the IR cells. The expression of the insulin receptor and glucose transporter 2 was down-regulated. Furthermore, HepG2/IR cells displayed markedly enhanced adhesion, migration, and invasion. These cells exhibited a lower sensitivity to cisplatin. On the contrary, HepG2/IR cells exhibited decreased adhesion and invasion after treatment with the insulin sensitizer pioglitazone hydrochloride.CONCLUSION: IR is closely related to drug resistance, adhesion, migration and invasion in HepG2 cells. These findings may help explain the clinical observation of the limited efficacy of chemotherapy on a background of IR.
HepG2 cells; Insulin resistance; Apoptosis; Cell migration; Cisplatin
1000- 4718(2014)12- 2148- 07
2014- 07- 14
2014- 09- 02
湖北省教育厅指导项目(No. B2014054)
R73-3
A
10.3969/j.issn.1000- 4718.2014.12.006
△通讯作者 Tel: 0719-8272546; E-mail: huyangqian999@163.com

