Src酪氨酸激酶抑制剂Ⅱ对膀胱移行细胞癌T24细胞生长、增殖的影响
龙永其, 阳新华, 谌 磊, 杨罗艳, 欧阳曙光, 刘劲戈, 刘文进
(1湖南省株洲市中心医院泌尿外科, 湖南 株洲 412000; 2中南大学湘雅二医院泌尿外科, 长沙 410008; 3湖南计划生育委员会研究所, 长沙 410000)
Src是最早报道的癌基因,c-Src在许多上皮和非上皮恶性肿瘤都出现过度表达和活性异常,c-Src的蛋白产物在众多信号传导通路中起着关键作用,影响着细胞的增殖、分化、迁移和存活,与肿瘤的发生发展、转移及预后密切相关, Src蛋白在调控细胞的生长(生存和增生)、粘附、运动和细胞信号传导等方面发挥重要作用。Src蛋白可以通过生长因子受体与细胞外的生长因子相互作用,或者通过整和素与细胞外基质相互作用,通过信号传导通路调控细胞周期,影响细胞增殖。其作用一是激活Ras/MEK/ERK/cyclin/cdks通路,促进G1期到S期的转换;二是激活STAT3/c-Myc,促进有丝分裂。在这2个信号传导通路中,活化的Src蛋白可以使p38 MAPK三肽区的苏氨酸、酪氨酸双磷酸化而激活。激活后细胞浆中的p38 MAPK即移位到细胞核, 影响细胞内多种基因的转录、蛋白的合成及细胞表面受体表达和细胞骨架结构改变,导致细胞生长、增殖、分化发生变化,从而抑制肿瘤发生、增长、侵袭和转移。
本研究使用半定量RT-PCR法检测加入Src酪氨酸激酶抑制剂Ⅱ后的人膀胱癌细胞T24各浓度组的c-Src、p38MAPK基因表达的变化情况,使用Western blot检测Src酪氨酸激酶抑制剂Ⅱ后处理T24细胞内的c-Src蛋白(包括其磷酸化类型与非磷酸化类型)表达情况。探讨Src酪氨酸激酶抑制剂Ⅱ对Src蛋白及其下游信号的作用,论证Src蛋白作为膀胱移行细胞癌分子靶向治疗的潜在靶点的可能性。
1 材料与方法
1.1主要试剂与仪器人膀胱癌T24细胞购至上海细胞典藏物中心,Src酪氨酸激酶抑制剂Ⅱ: Src Kinase Inhibitor II(Cat. No. 567806),购自Merck Calbiochem 公司。
1.2方法
1.2.1 引物设计 根据c-Src, p38MAPK、β-actin的mRNA序列(genebank序列号NM-005417、NM-004360、NM-139012),应用在线引物设计软件primer3设计相关引物(表1)。
1.2.2 方法 合成第一链cDNA后行PCR扩增,电泳及分析结果,PCR产物测序及BLAST比较分析-制备标本总蛋白,制备SDS-聚丙烯酰胺凝胶(SDS-PAGE),将PVDF膜上的目的蛋白条带在Gel DoC 2000 凝胶成像系统中进行分析处理,用目的基因与内参照β-actin的光密度比值来衡量表达情况。
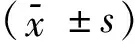

表1 c-Src、 P38MAPK、β-actin引物设计
2 结果
2.1半定量RT-PCR法检测Src酪氨酸激酶抑制剂Ⅱ对T24细胞c-SrcmRNA、P38mRNA的表达加入Src酪氨酸激酶抑制剂Ⅱ后,人膀胱癌细胞T24各浓度组的c-Src mRNA的表达比值(c-Src/β-actin)在0、0.2、1.0、5.0 μmol/mL浓度组分别为(0.750±0.030)、(0.680±0.020)、(0.670±0.042)、(0.065±0.030),显示人膀胱癌细胞T24的c-Src基因的mRNA表达水平在加入Src酪氨酸激酶抑制剂Ⅱ后有下调,同时显示人膀胱癌细胞T24的c-Src基因在mRNA表达水平上随加入Src酪氨酸激酶抑制剂Ⅱ浓度的增长表达呈逐渐降低趋势,但是表达下降不明显,各浓度组间差异无统计学意义(P>0.01),见表2。
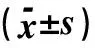
表2 半定量RT-PCR法检测Src酪氨酸激酶抑制剂Ⅱ对T24细胞c-SrcmRNA,P38mRNA的表达
2.2加入Src酪氨酸激酶抑制剂Ⅱ后的人膀胱癌细胞T24各浓度组的p38mRNA的表达比值p38/β-actin在0、0.2、1.0、5.0 μmol/mL浓度组分别为(0.913±0.031)、(0.920±0.030)、(0.657±0.056)、(0.383±0.045),显示人膀胱癌细胞T24的p38基因的mRNA表达水平在加入Src酪氨酸激酶抑制剂Ⅱ后有下调,同时显示人膀胱癌细胞T24的p38基因在mRNA表达水平上随加入Src酪氨酸激酶抑制剂Ⅱ浓度的增长表达呈逐渐下调趋势,并且0.2、1.0、5.0 μmol/mL浓度组与0 μmol/mL浓度组相比表达明显减少,组间差异有统计学意义(P<0.01),见表2。
2.3T24细胞内的c-Src蛋白表达结果T24细胞内c-Src基因在蛋白表达水平上其磷酸化类型随Src酪氨酸激酶抑制剂Ⅱ浓度的增高表达逐渐下降,并且呈剂量-效应关系,T24细胞内c-Src基因在蛋白表达水平上其非磷酸化类型随Src酪氨酸激酶抑制剂Ⅱ浓度的增高表达无明显变化,与剂量无关。各组细胞c-Src蛋白表达比值分别为:磷酸化组:0、1.0、5.0 μmol/mL组表达比值分别为(0.737±0.044)、(0.423±0.038)、(0.234±0.045),1.0 μmol/mL及5.0 μmol/mL组明显低于对照组(P<0.05),10 μmol/mL及20 μmol/mL组间比较差异有统计学意义(P<0.05)。非磷酸化组0、1.0、5.0 μmol/mL组表达比值分别为(0.805±0.019)、(0.777±0.028)、 (0.826±0.048),组间差异无统计学意义(P>0.05),见表3。
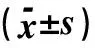
表3 Western blot检测不同浓度Src酪氨酸激酶抑制剂Ⅱ处理后T24细胞c-Src蛋白的表达
注:与0 μmol/mL组比较,△P<0.05; 与1.0 μmol/mL比较,△P<0.05。
3 讨论
Src蛋白可以通过生长因子受体与细胞外的生长因子相互作用,或者通过整和素与细胞外基质相互作用,通过数个信号转导通路调控细胞周期,影响细胞增殖。Src蛋白在膀胱移行细胞癌的作用包括以下几个方面:(1)激活Ras/MEK/ERK/cyclin/cdks通路,促进G1期到S期的转换;(2)激活STAT3/c-Myc,促进有丝分裂[1-4];(3)Src蛋白能激活P13-K/Akt通路,抑制细胞调亡,调节细胞存活[1-6];(4)Src蛋白可以通过p 190 RhoGAP和锚着斑激酶的磷酸化调控细胞骨架的重组,调节细胞粘附和运动[1-2]。
本研究首先运用半定量RT-PCR检测加入Src酪氨酸激酶抑制剂Ⅱ后的人膀胱癌细胞T24各浓度组的c-Src基因的表达,发现人膀胱癌细胞T24的c-Src基因的mRNA表达水平在加入Src酪氨酸激酶抑制剂Ⅱ后虽有下调,但是表达下降不明显,各浓度组间差异无统计学意义(P>0.01)。再设计应用选择性Src蛋白酪氨酸激酶抑制剂Ⅱ后使用Western blot法分别检测T24细胞内的Src蛋白的磷酸化类型与非磷酸化类型,蛋白凝胶电泳分析结果显示: T24细胞内c-Src基因在蛋白表达水平上其磷酸化类型(即活化型)随Src酪氨酸激酶抑制剂Ⅱ浓度的增高表达逐渐下降,并且呈剂量-效应关系;而其非磷酸化类型则不被Src酪氨酸激酶抑制剂Ⅱ所抑制。因此,认为Src酪氨酸激酶抑制剂Ⅱ能通过竞争Src蛋白磷酸化位点,使其不能激活,导致下游的细胞传导途径失活,使得T24细胞增殖得到抑制,迁移能力消弱。认为Src蛋白具有作为膀胱移行细胞癌分子靶向治疗的潜在靶点的可能性。
细胞凋亡是在特定时空中发生的受机体严密调控的细胞“自杀”现象。诱导凋亡的因素能启动细胞内的一系列反应,最终导致双位点特异激酶MAPK/EPK激酶磷酸化激活p38 通路,再移位于相应的转录因子,启动基因转录。 丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase, MAPK)是细胞内一类丝氨酸/苏氨酸蛋白激酶,包括ERKl/2、JNK和p38,激活的MAPK家族可诱导许多重要应激蛋白的生成,再作用于相同或不同的靶蛋白,产生复杂的生物学作用。p38是MAPK家族的重要成员,也是MAPK家族中目前被研究得最为广泛的一员。研究己经发现, p38蛋白主要在细胞外环境发生变化时被激活,主要通过影响caspase家族上游和下游蛋白来调控细胞的凋亡进程,并且可以通过下调cyclin Dl和CDK4来阻止细胞从Gl期向S期过渡[7-8]。
Src蛋白可以激活Ras/MEK/ERK/cyclin/cdks通路和STAT3/c-Myc 2个信号通路[1-4]。在这2个信号转导通路中, 活化的Src蛋白可以使p38 MAPK三肽区的苏氨酸、酪氨酸双磷酸化而激活。激活后细胞浆中的p38 MAPK即移位到细胞核, 影响细胞内多种基因的转录、蛋白的合成及细胞表面受体表达和细胞骨架结构改变,导致细胞生长、增殖、分化变化,抑制肿瘤发生、增长、侵袭和转移[9-10]。
p38在凋亡中至少通过以下途径调控凋亡:(1)增强c-myc表达。转染质粒后的Hela细胞、MKK6被激活,途径下游的p38 作用可提高内部核糖体进入位点介导的c-myc基因翻译水平,c-myc此时表现抑癌基因功能,诱导细胞凋亡[11];(2)磷酸化p53。用紫外线照射人乳腺癌细胞系MCF-7细胞时,p38 发生活化,进而使p53的第33和46位丝氨酸发生磷酸化,诱导细胞凋亡,阻止p38 的活化则可减少第33、34和15位丝氨酸磷酸化,消弱紫外线诱导的凋亡[12]。(3)参与Fas/Fasl介导的凋亡。在诱导体内及培养的胰腺癌细胞凋亡时,检测到Fas/Fasl的表达,同时亦可见p38的活性增强,提示Fas介导的凋亡信号转导有p38通路参与[13]。(4)激活c-jun和c-fos。c-jun和c-fos形成异二聚体激活蛋白1,Ras和MAPK参与对激活蛋白1的激活[14]。(5)诱导Bax转位。在NO通过刺激Bax流入线粒体而导致神经元细胞死亡的过程中,p38 的活化起到关键作用[15]。(6)p38 可增强TNF-α表达,进而TNF-α活化p38 诱导凋亡。LPS通过磷酸化激活p38,再通过转录因子而增加TNF-α基因的转录活性,这是中毒性休克时TNF-α生成增加的机制。此外,p38 促进凋亡或抑制凋亡与p38 激活的性质有关,如短期p38的激活可引起造血肿瘤细胞SKT6分化,而长时间的激活则可促进其凋亡;在TNF-α处理的中性粒细胞中,早期p38的激活可延迟凋亡,而晚期p38的激活可加速凋亡[16]。Src蛋白经磷酸化激活后可以通过调控ERK1/2和p38表达,直接和间接地阻止或减少T24细胞凋亡的发生。本研究发现人膀胱癌细胞T24的p38基因的mRNA表达水平在加入Src酪氨酸激酶抑制剂Ⅱ后有下调,其下调程度上随加入Src酪氨酸激酶抑制剂Ⅱ浓度的增长而增长,推测可能为Src酪氨酸激酶抑制剂Ⅱ可以特异性地阻止Src蛋白磷酸化后阻断其下游的Ras/Raf/MEK/MAPK(ERK1/2或p38)通路和ERK1/2和p38信号通道,调控ERK1/2和p38表达,从而直接和/或间接地诱导T24细胞凋亡的发生。
Src蛋白还可以通过p38激酶的磷酸化调控细胞骨架的重组,调节细胞粘附和运动。p38被磷酸化激活后,可转而激活多种转录因子、细胞骨架相关蛋白及酶类等不同底物来调节多种细胞生理过程。MAPK激活蛋白激酶2被p38磷酸化激活后,能通过激活低分子量热休克蛋白(small heat shock protein,sHSP27)来介导细胞骨架重塑。研究发现p38的另一个下游底物——p38调节/激活蛋白激酶(p38 regulated/activated protein kinase,PRAK)在被p38磷酸化激活后也能激活HSP27,说明p38信号通路对细胞骨架具有重要调控作用[17]。细胞迁移过程实际上就是一个细胞骨架发生周期性变化的过程,而p38参与细胞骨架重塑调控也就参与细胞迁移的调节[18-19]。
p38可以激活其下游激酶MK2从而激活HSP27。而Singh等[20]研究表明,MK2可与肌动蛋白相关蛋白2/3 (actin-related protein 2/3,Arp2/3)复合体中的一个亚单位p16相互作用,而该复合体在肌动蛋白的核化和装配中具有至关重要的作用。因此MK2可能通过与p16的相互作用来介导细胞迁移。本研究发现在p38基因敲除的细胞中,PDGF诱导的细胞迁移被阻断。说明p38确实在细胞迁移过程中起作用。推测可能为Src酪氨酸激酶抑制剂Ⅱ可以特异性地阻止Src蛋白磷酸化后阻断ERK1/2和p38信号通道,向下调控p38表达,从而抑制或减弱人膀胱癌T24细胞的迁移/侵袭/转移的能力。因此认为Src酪氨酸激酶抑制剂Ⅱ可以通过影响其下游的Ras/Raf/MEK/MAPK(ERK1/2或p38)通路和ERK1/2和p38细胞信号传导通路,下调p38表达,不仅直接和间接地诱导T24细胞凋亡,而且可以阻止或减少T24细胞的迁移、扩散和穿膜侵袭的发生。
参考文献:
[1] Frame MC. Src in Cancer:deregulation and Consequences for cell behaviour[J]. Biochim Biophys Acta,2002,1602(2):114-130.
[2] Abram CL, Courtneidge SA. Src family tyrosine kinases and growth factor signaling[J]. Exp Cell Res, 2000, 254(1):1-13.
[3] Riley D, Carragher NO, Frame MC, et al. The mechanism of cell cycle regulation by v-Src[J]. Oncogene, 2001, 20(42):5941-5950.
[4] Bowman T, Broome MA, Sinibaldi D, et al. Stat3-mediated Myc expression is required for Src transformation and PDGF-induced mitogenesis[J]. Proc Natl Acad Sci U S A, 2001, 98(13):7319-7324.
[5] Alioua A, Mahajan A, Nishimaru K, et al. Coupling of c-Src to large conductance voltage- and Ca2+-activated K+channels as a new mechanism of agonist-induced vasoconstriction[J]. Proc Natl Acad Sci U S A, 2002, 99(22):14560-14565.
[6] Reddy EP, Korapapi A, Chaturvedi P, et al. IL-3 signaling and the role of Src kinases,JAKs and STATs:a convert liaison unveiled[J]. Oncogene,2000, 19(21):2532-2547.
[7] Johnson GL,Lapadat R.Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases[J]. Science, 2002, 298(560):1911-1912.
[8] Cardone MH, Salvesen GS, Widmann C, et al. The regulation of anoikis:MEKK-1 activation requires cleavage by caspases[J]. Cell, 1997, 90(2):315-323.
[9] Obata T, Brown GE, Yaffe MB. MAP kinase pathways activated by stress:the p38 MAPK pathway[J]. Crit Care Med, 2000, 28(4 Suppl):67-77.
[10] Zhang XQ, Pang ZJ, Chen SL, et al. p38MAPK inhibitor SB203580 in inhibition of in vitro invasion of human choriocarcinoma JAR cells[J]. Proc Oncol, 2003, 18(2):95-97.
[11] Stoneley M, Chappell SA, Jopling CL, et al. c-Myc protein synthesis is initiated from the internal ribosome entry segment during apoptosis[J]. Mol Cell Biol, 2000, 20(4):1162-1169.
[12] Bulavin DV, Saito S, Hollander MC, et al. Phosphorylation of human p53 by p38 kinase coordinates N-terminal phosphorylation and apoptosis in response to UV radiation[J]. EMBO J, 1999, 18(23):6845-6854.
[13] Kornmann M, Ishiwata T, Kleeff J, et al. Fas and Fas-ligand expression in human pancreatic Cancer[J]. Ann Surg, 2000, 231(3):368-379.
[14] Han J, Jiang Y, Li Z, et al. Activation of the transcription factor MEF2C by the MAP kinase p38 in inflammation[J]. Nature, 1997, 386(6622):296-299.
[15] Ghatan S, Larner S, Kinoshita Y, et al. p38 MAP kinase mediates bax translocation in nitric oxide-induced apoptosis in neurons[J]. J Cell Biol, 2000, 150(2):335-347.
[16] Nagata Y, Todokoro K. Requirement of activation of JNK and p38 for environmental stress-induced erythroid differentiation and apoptosis and of inhibition of ERK for apoptosis[J]. Blood, 1999, 94(3):853-863.
[17] New L, Jiang Y, Zhao M, et al. PRAK, a novel protein kinase regulated by the p38 MAP kinase[J]. EMBO J, 1998, 17(12):3372-3384.
[18] Dechert M, Holder JM. Gerthoffer WT. p21-activated kinase1 participates in tracheal smooth muscle cell migration by signaling to p38 MAPK[J]. Am J Physiol Cell Physiol, 2001, 281(1):C123.
[19] Bakin AV, Rinehart C, Tomlinson AK. et al. p38 mitogen-activated protein kinase is required for TGF-mediated fibroblastictrans differen-tiation and cell migration[J]. J Cell Sci, 2002, 115(15):3193.
[20] Singh S, Powell DW, Rane MJ, et al. Identification of the p16-Arc subunit of the Arp 2/3 complex as a substrate of MAPK-activated protein kinase 2 by proteomic analysis[J]. J Biol Chem, 2003, 278(38):36410-36417.

