甲状腺乳头状癌与基质金属蛋白酶抑制因子3(TIMP3)基因启动子甲基化的关系研究
阿布来提·麦麦提艾力, 哈德提·别克米托夫, 哈力木拉提·木尔提扎, 艾力·塞丁,西尔扎提·苏来曼, 夏米西努尔·伊力克
(新疆医科大学1基础医学院生物学教研室, 乌鲁木齐 830011; 2第一附属医院病理科, 3第一附属医院血管甲状腺外科, 乌鲁木齐 830054;4新疆维吾尔自治区人民医院肿瘤外一科, 乌鲁木齐 830000; 5新疆医科大学基础医学院生物化学教研室, 乌鲁木齐 830011)
甲状腺癌是常见的内分泌恶性肿瘤,在过去几十年里其发病率在全世界范围呈增长的趋势,2010年男性和女性甲状腺癌的发病率分别为4/100 000和12/100 000,成为第8个最常见的肿瘤,第5位女性常见肿瘤[1-3]。常见的甲状腺癌有乳头癌(papillary thyroid carcinoma,PTC)、滤泡癌(follicular thyroid carcinoma,FTC)、髓样癌(medullary thyroid carcinoma,MTC)等,其中乳头癌(PTC)为最多,占甲状腺恶性肿瘤的90%[4]。新疆人群甲状腺癌发病率快速上升[5]。人体恶性肿瘤中甲状腺癌的存活率相当高,其中乳头状癌的存活率最高,虽然甲状腺癌发病率持续性增高,但随着医学检验技术的发展,甲状腺癌的死亡率逐渐下降,生存率升高[6]。甲状腺癌常以无痛性甲状腺结节为主要临床表现。临床上主要通过触诊、甲状腺彩色B超、同位素造影及细针穿刺细胞学检查( fine needle aspirationbiopsy,FNAB) 等方法进行诊断,但这些方法均不能明确区分结节性甲状腺肿良、恶性的情况[7]。因此探索新的早期诊断方法,以提高甲状腺癌的诊断效率成为本领域的研究热点,找出一种早期诊断的分子标志物是早期诊断以及提高恶性肿瘤患者存活率的一项重要措施。本课题组在前期研究中,通过蛋白表达分析发现基质金属蛋白酶抑制因子3(TIMP3)等基因在甲状腺癌中低表达,筛选出它们可能为甲状腺癌特异性高甲基化候选基因[8]。本研究拟选TIMP3基因,利用亚硫酸氢盐修饰(bisulfite sequencing,BSP)测序法和Sequenom Mass ARRAY 甲基化DNA定量分析平台检测该基因CpG岛屿在甲状腺乳头状癌组织的甲基化状态,研究其启动子区CpG位点甲基化水平与甲状腺乳头状癌发生的内在联系。对比2种测序方法的结果,并评价TIMP3基因启动子甲基化作为甲状腺乳头状癌分子标志物的可能性和应用价值。
1 材料与方法
1.1临床材料收集2011-2013年在新疆维吾尔自治区人民医院和新疆医科大学第一附属医院住院治疗并确诊的甲状腺病变患者的新鲜手术切除组织标本46例,其中甲状腺乳头状癌29例,结节性甲状腺肿17例。
1.2仪器与试剂主要仪器:微型离心机(Eppendorf公司),紫外分光光度计(Thermo公司),PCR仪、Gel Doc XR凝胶成像仪(BIO-RAD公司),Mass ARRAY Compact System、恒温培养箱振荡器(上海一恒公司),电热恒温水槽(宁阳公司)。主要试剂:亚硫酸氢盐修饰试剂盒(EpiTect Fast DNA Bisulfite KIT),热启动DNA聚合酶(HotStartTaq DNA polymerase),dNTP mix(QIAGEN生物公司), TA克隆试剂盒(TA Cloning kit),One shot top10化学感受态细胞(Invitrogen),质粒提取试剂盒(TIANGEN),IPTG, X-gal,氨苄青霉素(Amp, BioSharp生物公司)。
1.3方法
1.3.1 亚硫酸氢盐修饰测序分析TIMP3基因启动子甲基化水平
1.3.1.1 基因组DNA的制备及亚硫酸氢盐修饰 取甲状腺组织标本约50 mg ,在盛有液氮的研钵里研磨组织标本,并用微量移液器头快速移入已标并记盛有600 μL组织裂解液 (TET)的1.5 mL EP管里。充分混匀,放于37℃水浴锅65 min后,加入蛋白酶K 40 μL,颠倒混匀,56℃过夜。经典酚氯仿法提取基因组DNA[9],并质量检测,采用 EpiTect Fast DNA Bisulfite Kit亚硫酸氢盐修饰组织DNA。
1.3.1.2 BSP引物设计 登录 GenBank,检索TIMP3基因DNA序列,用Methyl primer express 软件扫描上游DNA序列的CpG岛,设计BSP引物。TIMP3基因上游引物序列:5′TTTTGGTTTGGGTTAGAGATATT 3′,下游引物序列:5′CCTCAAACCAATAACAAAACC 3′,产物长度:273 bp;该片段在启动子区位点定位于-343~-71 bp。
1.3.1.3 PCR扩增 采用25 μL的PCR反应体系,其中含2.5 μL 10×PCR 缓冲液、2 μL 20 mM MgCl2、0.5 μL 10 mM dNTP、0.1 μL 热启动酶、上下引物各0.75 μL、5.0 μL DNA模板、13.4 μL无菌水。以水代替DNA为空白对照。设PCR仪程序为预变性95℃ 15 min,45 个循环(95℃ 40 s,52℃ 40 s,72℃ 1 min),总延伸72℃ 10 min。用 2% 琼脂糖凝胶电泳鉴定PCR产物。
1.3.1.4 克隆测序 连接:在200 μL的 PCR管里建立10 μL链接反应体系,含有1 μL 5×Ligation buffer、2 μL PCR2.1载体(30 ng/μL)、1 μL新鲜PCR产物(约20 ng)、1 μL T4 DNA Ligase、5 μL DNA/RNAse free water等。将各组成成分加完后轻轻离心混匀,在PCR仪中14℃连接过夜。转化:取连接反应液和One shot top10 化学感受态细胞,按照感受态细胞说明书上的操作步骤进行转化,取150 μL转化液涂布在含有100 μg/mL Amp、100 μL 20 mg/mL的X-gal和100 μL 25 mg/mL的IPTG溶液的LB固体平板上,将培养板在室温放置60 min后倒置于37℃培养箱里,培养过夜13 h。准备 20 μL 的菌落PCR反应液、含有2.0 μL 10×PCR 缓冲液、1.0 μL 20 mM MgCl2、0.4 μL 10 mM dNTP、15 μL ddH2O、0.1 μL热启动DNA聚合酶及上下引物各0.75 μL,菌落为模板,以没有转化质粒的感受态细胞为模板的体系设为阳性对照,设PCR仪程序为15 min预变性,40个循环(95℃ 35 s,52℃ 35 s,72℃ 1 min),总延伸72℃ 10 min进行 PCR 扩增。用2%琼脂糖凝胶电泳鉴定PCR产物。37℃、170 r/min震荡培养10 h含有目的片段的8 mL菌液,用TIANGEN质粒提取试剂盒提取质粒,送上海生物工程公司测序。
1.3.2 Sequenom Mass ARRAY甲基化定量分析TIMP3基因启动子甲基化水平 以TIMP3基因启动子区CpG岛为目的片段,依托Sequenom MassARRAY 甲基化DNA定量分析平台(北京博奥生物公司),对甲状腺病变组织DNA进行单一CpG位点甲基化定量检测TIMP3基因启动子区 CpG位点甲基化水平。数据通过EpiTYPER软件分析TIMP3基因甲基化程度,整理数据进行统计学分析。
1.4统计学处理采用SPSS19.0 软件分析实验数据,高甲基化克隆数百分比用χ2检验,独立样本比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1TIMP3基因启动子甲基化水平的亚硫酸氢盐测序法分析结果根据GenBank提供的TIMP3基因DNA序列,利用Methyl primer express 软件设计BSP 引物。通过PCR 扩增、PCR产物琼脂糖凝胶电泳分析,现扩增出的目的片段与预期大小一致(273 bp)(图1)。亚硫酸氢盐修饰测序结果显示,TIMP3基因启动子在甲状腺乳头状癌组织中共有12个CpG位点出现甲基化,其中5个CPG位点(CpG-10、CpG-13、CpG-14、CpG-16、CpG-17)呈高度的甲状腺乳头状癌特异性(图2、表1)。TIMP3 基因在结节性甲状腺肿的高甲基化克隆数为0,低甲基化克隆数为9,高甲基化克隆百分比为0%。而甲状腺乳头状癌组织中的高甲基化克隆数为28,低甲基化克隆数为12,高甲基化克隆百分比为70%,显著高于结节性甲状腺肿的0%,差异有统计学意义(χ2=14.7,P=0.000)。
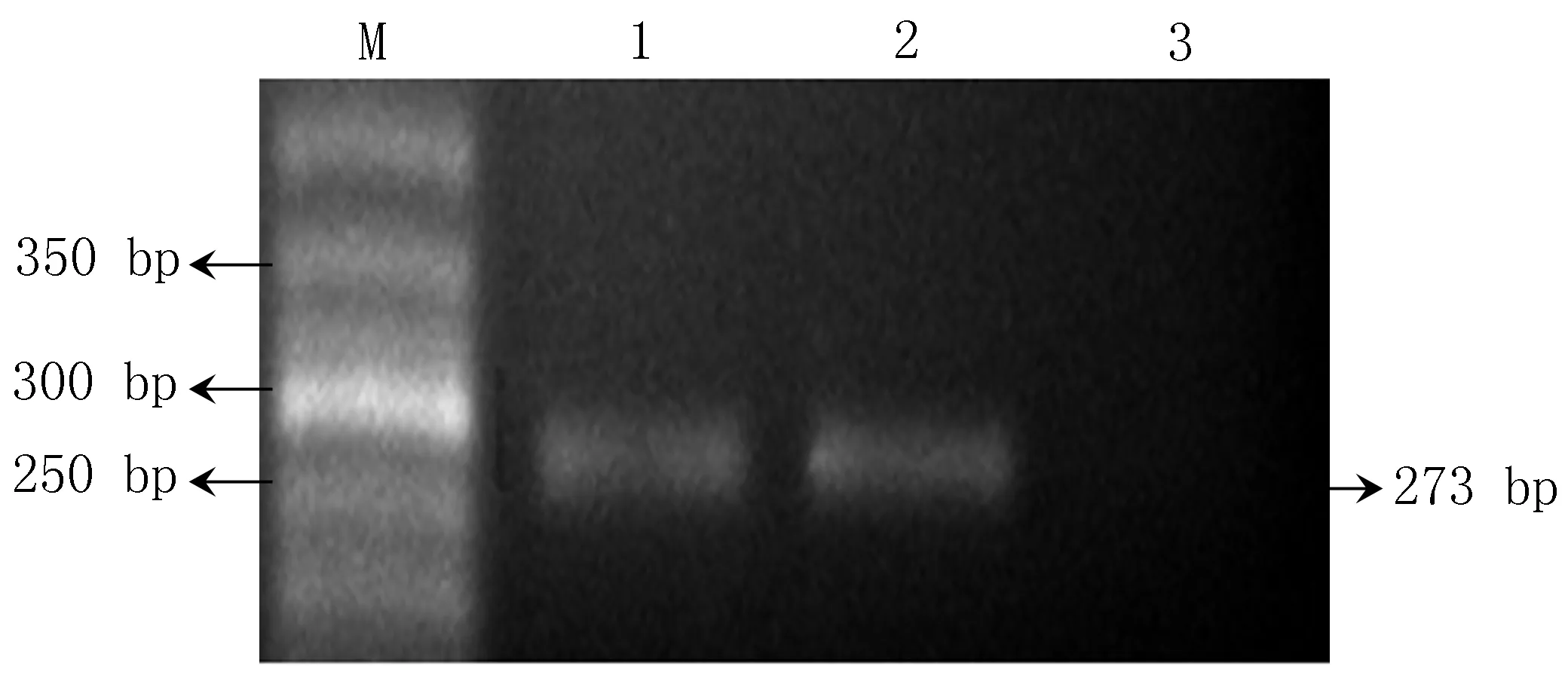
M: Marker; 1~3: 甲状腺乳头状癌、甲状腺肿、空白对照组
图1TIMP3基因PCR产物2%的琼脂糖凝胶电泳图
2.2TIMP3基因启动子甲基化水平的SequenomMassARRAY定量分析结果分析Sequenom Mass ARRAY 提供的单一CpG位点甲基化定量数据显示, TIMP3基因在甲状腺乳头状癌组织的总体甲基化率均值(0.28)与结节性甲状腺肿的总体甲基化率均值(0.15)差异有统计学意义(P<0.05)。TIMP3基因启动子区3个位点(CpG-1、CpG-16、CpG-17)在甲状腺乳头状癌组织中的甲基化率均值与结节性甲状腺肿相比差异有统计学意义(P<0.05)(表2)。

注:Initial seq为原序列,中间有竖杠是说明相同碱基,无竖杠表示碱基不相同,Y表示该碱基为CpG位点,Y与C配对说明该位点是甲基化状态。
图2TIMP3基因在甲状腺乳头状癌组织的BSP片段测序及序列对比结果
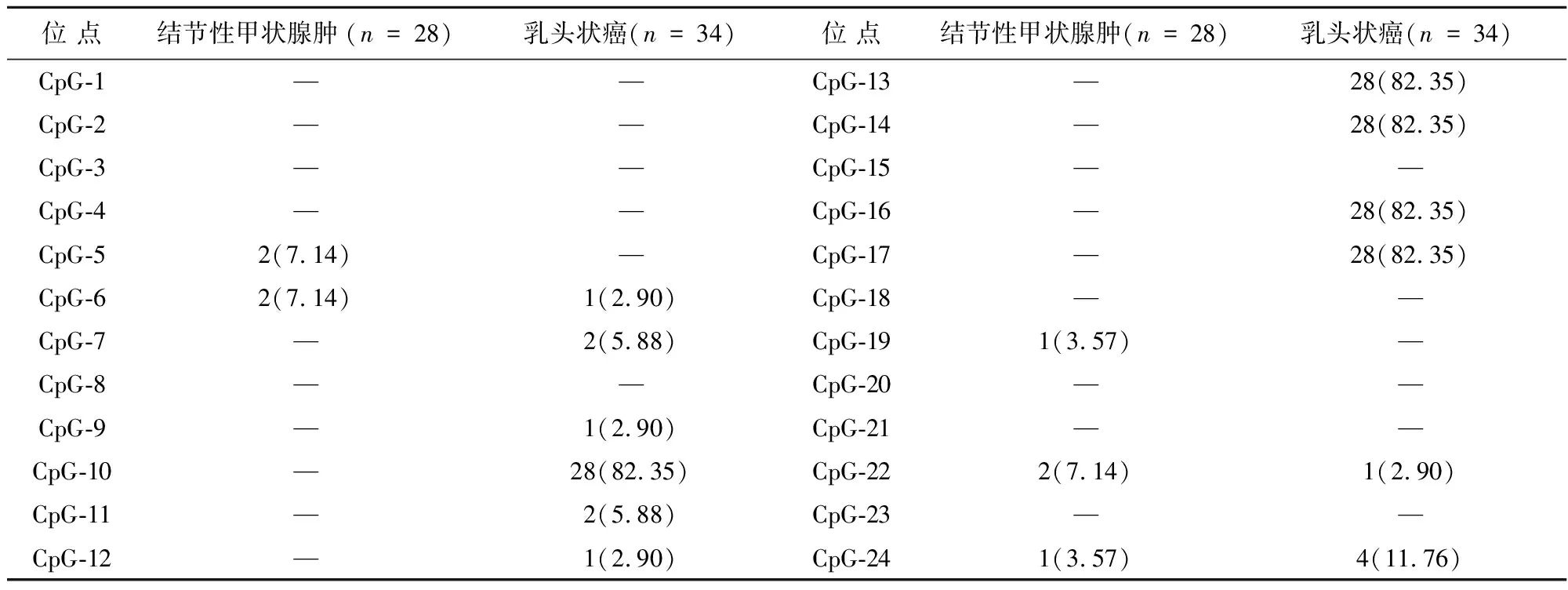
表1 TIMP3基因甲基化克隆单一CpG位点的甲基化百分比比较/个(%)
3 讨论
DNA甲基化是指在DNA甲基转移酶(DNA methyltransferases,DNMTs)的催化作用下,将甲基从SAM转移并添加到胞嘧啶的第5位碳原子的过程[10]。肿瘤相关抑癌基因启动子异常甲基化引起的基因沉默、转录表达缺失是恶性肿瘤早期诊断研究的热点[11]。TIMP3是一种基质金属蛋白酶组织抑制剂(tissue inhibitor of matrix metalloproteinases,TIMPs),是属于TIMPs家族,与其他TIMPs不同,TIMP3是一种结合ECM的非可溶性蛋白。TIMP3抑制肿瘤的生长、侵袭和转移血管生成,以防止由基质金属蛋白酶促进间质基质的破坏(MMP)-3和阻断VEGF结合的血管内皮生长因子受体,因此甲基化介导的基因沉默的TIMP3基因可能在PTC侵袭和进展中发挥独特的作用[12]。TIMP3的蛋白失活与肿瘤发生有关[13],在胃癌和结肠癌中已被证实[14],在甲状腺乳头癌中该基因启动子高甲基化率为53%,这与甲状腺侵染(38%)、淋巴结转移(43%)和多灶性(49%)有关[15]。Hu等[16]发现TIMP3基因异常甲基化和基因沉默可能在乳头状甲状腺癌的发生和发展中起到重要作用。国外已有研究证明TIMP3在甲状腺癌中呈低表达,在许多常见的肿瘤中出现该基因的缺失、5’端CpG的甲基化[17-18]。
表2 Sequenom MassARRAY定量分析 TIMP3基因启动子在不同甲状腺组的CpG位点甲基化状况
甲基化分析方法众多,其中亚硫酸氢盐测序PCR法虽然技术复杂、费时、资金消耗大且快速大样本检测难度大,但是其为能够准确地检测到单个甲基化位点的最可靠的一种方法。该法首先对DNA进行亚硫酸盐修饰,再通过PCR扩增和测序,即可发现未发生甲基化的胞嘧啶会转化成胸腺嘧啶,而存在甲基化的胞嘧啶仍表现为胞嘧啶[19]。BSP法能明确目的片段中每一个CpG位点的甲基化情况,并可对特定片段内每个碱基的甲基化状态进行分析,为甲基化分析中最为直接和彻底的方法之一[20-22]。MassARRY Epityper DNA甲基化定量分析技术,结合了碱基特异性酶切反应和MALDI-TOF质谱检测原理, 性能高,能够分析长达500 bp的多个CpG位点,灵敏度高,能够检测值为5%的甲基化水平[23]。亚硫酸氢盐修饰测序结果显示TIMP3基因在甲状腺癌组织中的高甲基化克隆百分比为70%,显著高于结节性甲状腺肿的比例(P<0.05)。TIMP3基因启动子在甲状腺乳头状癌组织中共有12个CpG位点出现甲基化,其中5个CpG位点呈高度的甲状腺乳头状癌特异性。Sequenom Mass ARRY提供的单一CpG位点甲基化定量数据显示TIMP3基因在甲状腺乳头状癌组织的总体甲基化率均值高于结节性甲状腺肿的总体甲基化率均值,差异有统计学意义(P<0.05)。TIMP3基因启动子3个CpG位点在甲状腺乳头状癌组织中的甲基化率均值与结节性甲状腺肿相比差异有统计学意义(P<0.05)。据BSP测序结果和Sequenom Mass ARRAY甲基化定量分析结果,认为TIMP3基因CpG-16及CpG-17位点可能为甲状腺乳头状癌的启动子甲基化检测的关键位点,有望成为甲状腺癌早期诊断的分子标志物。
TIMP3基因启动子甲基化可能是甲状腺癌的分子机制之一。TIMP3基因的肿瘤特异性甲基化可能是在恶性进展的关键一步。TIMP3基因的甲基化后沉默失活可能阻碍细胞凋亡,促进乳头状甲状腺癌的生长和血管生成、侵袭及转移。因此,影响到乳头状甲状腺癌恶性进展的各个阶段。TIMP3基因启动子区CpG-16及CpG-17位点可能为甲状腺乳头状癌的启动子甲基化检测的关键位点,亦可作为甲状腺癌早期诊断的一种辅助性诊断指标,可能对早期诊断、预后判断及病情观察有一定的临床参考价值,是其表达缺失的关键因素,也是甲状腺乳头状癌干预基因表达调控的重要表观遗传学分子机制。TIMP3基因启动子区CpG-16及CpG-17位点作为甲状腺癌早期诊断的分子标志物工作有待进一步研究。
参考文献:
[1] Andrade LJO,Melo PRS,Neto WA,et al. Molecular markers in thyroid cancer[J]. Revista Argentina de Endocrinologíay Metabolismo,2013,50(2):84-89.
[2] Harris PJ, Bible KC. Emerging therapeutics for advanced thyroid malignancies: rationale and targeted approaches[J]. Expert Opin Investig Drugs, 2011,20(10):1357-1375.
[3] Jemal A . Cancer statistics, [J]. CA Cancer J Clin,2010,60:277-300.
[4] Stephen JK, Chitale D, Narra V, et al. DNA Methylation in thyroid tumorigenesis[J].Cancers,2011,3:1732-1743.
[5] 夏米西努尔·伊力克,热莎来提·吐尔逊,阿布力孜·阿不都拉,等.新疆人群中199 例甲状腺癌临床病理分析[J].现代肿瘤学,2008,16(6):937-939.
[6] Ming ZX. Gene Methylation in thyroid tumor genesis[J]. Endocrinology, 2007,148:948-953.
[7] 董林,沈佐君.DNA甲基化与肿瘤的侵袭和转移[J].国际检验医学杂志, 2009,30(2):132-134.
[8] 杨曦.甲状腺癌特异性高甲基化基因蛋白水平筛查研究[D].新疆医科大学,2010.
[9] Sambrook J, Russell DW. Molecular cloning: a laboratory manual[M].北京:科学出版社,2002:468-469.
[10] 韩竞男,鲁昊骋,梁静,等.DNA甲基化与癌症[J].中国生物化学与分子生物学,2012,2(2):108-114.
[11] Delpu Y, Cordelier P, William C, et al.DNA Methylation and cancer diagnosis[J].Int J Mol Sci,2013, 14:15029-15058.
[12] Anand-Apte B,Bao L,Smith R, et al.A review of tissue inhibitor of metalloproteinases-3(TIMP-3)and experimental analysis of its effect on primary tumorgrowth[J].Biochem Cell Biol,1996,74:853-862.
[13] Yu XB,Ji LY,Jian FL,et al.Clinicopathologic significance of BAG1 and TIMP3 expression in colon carcinoma[J].World J Gastroenterol,2007, 13(28):3883-3885.
[14] Lindsey JC,Lusher ME,Anderton JA,et al.Identifieation of tumour-specifiec pigenetie events in medulloblastoma development by hypermethylation profiling[J].Carcinogenetics,2004, 25:661-668.
[15] Bachman KF,Herman JG,Corn PG,et al.Methylation-associated silencing of the tissue inhibitor of matalloproteinase gene suggest a suppressor role in kidney, brain and other human cancers[J].Cancer Res,1999,59:798-802.
[16] Hu S,Liu D,Tufano RP,et al.Association of aberrant methylation of tumor suppressor genes with tumor aggressiveness and BRAF mutation in papillary thyroid cancer[J].Int J Cancer,2006,15,119(10):2322-2329.
[17] Feng H,Cheung AN,Xue WC,et al.Down-regulation and promoter methylation of tissue inhibitor of metalloproteinase 3 in choriocarcinoma[J].Gynecol Oncol,2004,94:375-382.
[18] Brueckl WM,Grombach J,Wein A,et al.Alterations in the tissue inhibitor of metalloproteinase-3(TIMP-3)are found frequently in human colorectal tumors displaying either microsatellite stability(MSS)or instability(MSI)[J].Cancer Letters, 2005,223:137-142.
[19] Darnton SJ,Hardie LJ,Muc RS,et al.Tissue inhibitor of metalloproteinase-3(TIMP-3) gene is methylated in the development of esophageal adenocarcinoma:loss of expression correlates with poor prognosis[J].Cancer,2005,115:351-358.
[20] Tetzner R,Dietrich D,Distler J, et al.Control of carry-over contamination PCR.based DNA methylation quantification using bisulfite treated DNA[J].Nucleic Acids Res,2007,35:e4.
[21] Li LC.Designing PCR primer for DNA methylation mapping[J].Methods Mol Biol,2007,40(2):371-384.
[22] Lind GE,Thorstensen L,Lovig T,et al.A CpG island hypermethylation profile ofprimary colorectal carcinoma and colon cancer cell lines[J].Mol Cancer,2004,3(1):28-31.
[23] 张海燕,赵洪斌,田亚平,等.DNA甲基化检测技术与应用前景[J].标记免疫分析与临床,2013,10,20(5):348-351.

