纳米氧化铝致大鼠肺部急性损伤研究
马继轩, 陈 艳, 苏德奇, 乔佩环, 张林媛, 余 再, 唐仕川, 马 龙, 常 兵
(1新疆医科大学公共卫生学院, 乌鲁木齐 830011; 2中国疾病预防控制中心职业卫生与中毒控制所, 北京 100050;3北京市劳动保护科学研究所, 北京 100054)
纳米材料是指至少一维空间的粒径≤100 nm的材料。当物质细分到纳米尺度时,其理化性质会发生很大变化,如小尺寸效应、表面效应、量子效应等,从而导致它们对生物体的作用可能与常规物质有很大的不同[1]。纳米氧化铝材料作为一种新型材料,常用于电子、化学化工、航天、医药、催化剂等领域。纳米氧化铝已广泛应用到人们的日常生活中,因此其对机体可能产生的潜在影响不容忽视[2]。本研究选用在纳米氧化铝作业场所空气中检测到的颗粒的平均浓度的40、200、1 000 倍,对Wistar大鼠肺部进行滴注染毒,研究纳米氧化铝颗粒对肺部组织的毒性效应,为纳米氧化铝安全生产评估提供参考依据。
1 材料与方法
1.1主要试剂、材料与仪器Fresco低温冷冻离心机(Thermo),722分光光度计, SB-5200DTN超声清洗仪,丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(南京建成生物工程研究所),乙醚(分析纯,上海实验试剂公司),瑞士吉姆萨染液(南京建成生物工程研究所)。纳米氧化铝粉末由苏州华微特粉体技术有限公司提供,透射电镜下纳米氧化铝颗粒中状态如图1所示,X射线衍射仪结果显示,此纳米氧化铝为γ相(图2)。BET比表面积仪测得纳米氧化铝的比表面积为200.4 m2/g;激光粒度仪检测溶于生理盐水中的纳米氧化铝颗粒平均粒径为90 nm,说明纳米颗粒在生理盐水中发生了一定程度的团聚。

图1 透射电镜下的纳米氧化铝颗粒
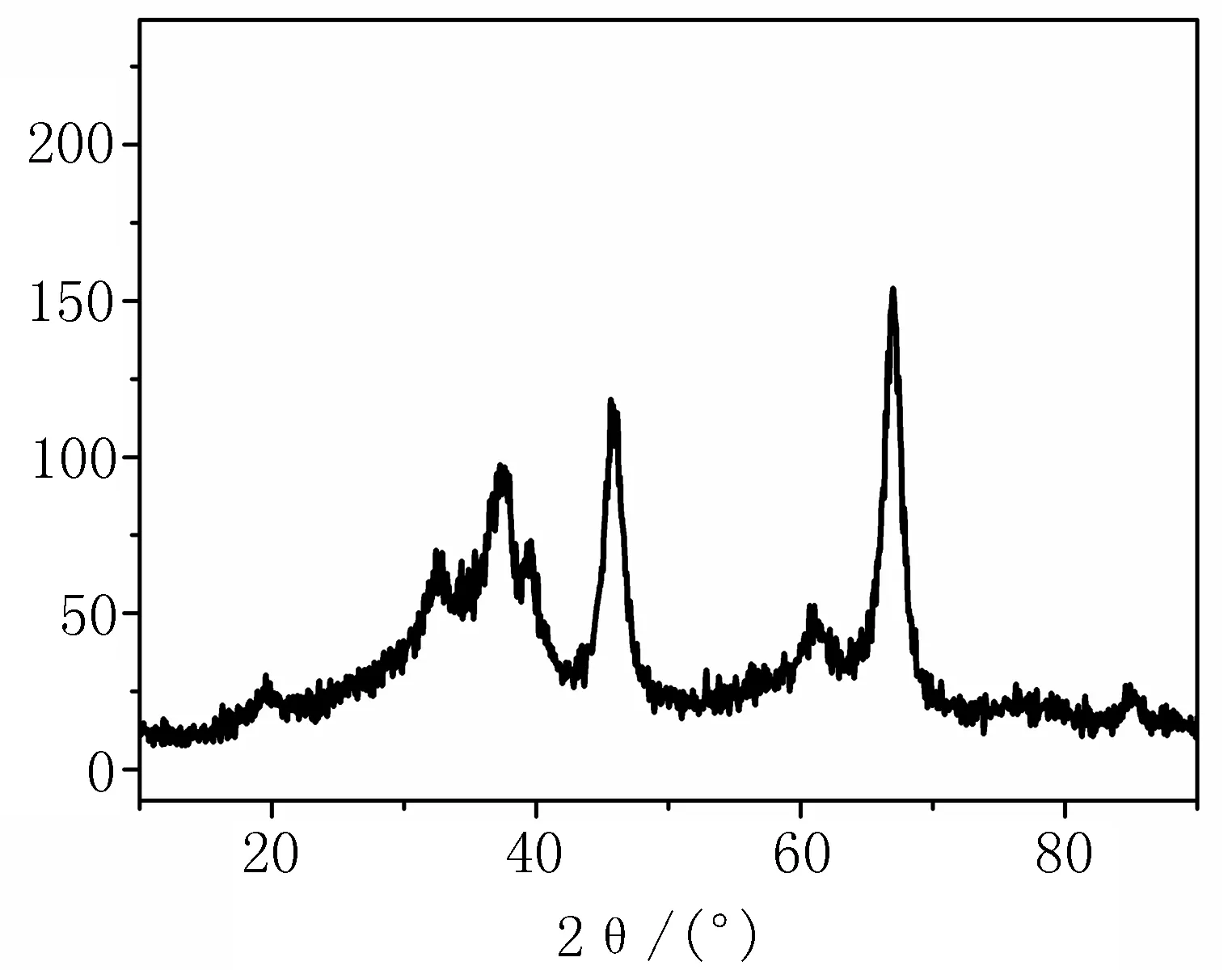
图2 纳米氧化铝X射线衍射图谱
1.2动物的饲养及染毒健康雄性SPF级Wistar大鼠,体质量180~220 g,购自北京维通利华实验动物技术有限公司。实验动物饲养于中国疾病预防控制中心动物实验室。动物房温度保持在22~24℃,相对湿度为40%~60%,明暗周期为12 h∶12 h。适应喂养1 w后,将48只大鼠按照随机分组原则分为对照组(生理盐水组)、纳米氧化铝低剂量组(14 mg/kg)、纳米氧化铝中剂量组(70 mg/kg组)、纳米氧化铝高剂量组(350 mg/kg组)4组,每组12只。采用单次气管滴注法进行染毒,并连续观察至28 d。
1.3剂量的确定(换算成标准状态)[3]
(公式1)
空气中纳米颗粒浓度(换算成标准状态):
(公式2)
个人一个工作班次的空气纳米颗粒暴露量:
(公式3)
式中, Cd为空气粉尘浓度(mg/m3);CN为空气纳米的浓度(μg/m3);M为空气纳米的暴露量(mg);W为滤膜上粉尘的质量(mg);m为采样滤膜上纳米的质量(μg);T为现场温度(℃);Pt为现场大气压(kPa);V为采样开始和采样结束时采样泵的平均流速(mL/min);t为采样时间(min) 。此处计算个人空气纳米暴露量时假设受试者平均每天吸入的空气量为15 m3,工作暴露时间为8 h。随后将个人暴露值扩大的40、200、1 000倍作为本次实验浓度剂量。
根据之前的纳米生产现场粉尘暴露值可知,纳米氧化铝现场暴露数量浓度为80 000个/cm2。由此可推算得知,染毒剂量分别为14、70、350 mg/kg。
1.4实验方法
1.4.1 染毒悬液的配制及稳定性分析 将100 μg/mL的纳米氧化铝悬液超声不同时间后,用激光粒度仪检测悬浊液中颗粒的粒径分布,确定纳米氧化铝悬液分散性。随后将超声后的纳米氧化铝悬液(平均粒径<100 nm)静置不同时间点后,通过激光粒度仪计算静置后每个时间点悬液的平均粒径。
1.4.2 气管滴注染毒 本实验采用非暴露式气管滴注法染毒,按0.2 mL/100 g体质量进行一次性滴注染毒。染毒前先将大鼠用适量乙醚麻醉后,迅速固定在自制倾斜台架上,将耳镜放入口中,其下端正好处于大鼠会厌部,使气管充分暴露,其身体自然下垂,然后将肺滴注针装上注射器,通过耳镜在会厌部轻轻插入气管,再将配制好的纳米氧化铝悬浮液注入大鼠气管内,灌注完毕后抽出针头,轻轻拍大鼠胸部完成整个染毒过程。
1.4.3 肺部灌洗液(BALF)的收集 染毒后3、28 d,腹主动脉放血处死大鼠,打开胸腔,暴露气管,剪一斜口,插入带有聚乙烯管的肺灌洗针头,用线绳结扎固定;止血钳夹闭左主支气管,缓慢注入生理盐水(37℃)5 mL,缓慢抽出灌洗液,边操作边轻轻按摩胸部以增加灌洗液的洗出率,反复灌洗3~5次;将提取的肺灌洗液经4℃、1 500 r/min离心10 min,沉淀细胞的一部分用生理盐水调整细胞浓度至1×106/mL,进行细胞涂片。瑞士-吉姆萨染色后进行白细胞分类计数,计数200个细胞,计算BALF中各类细胞的百分比;同时将上清液于8 000 r/min离心20 min,取上清,保存于4℃待测各项生化指标。
1.4.4 肺部灌洗液中的生化指标检测 采用标准比色法检测灌洗液中的生化指标,包括总蛋白(TP)含量及碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、乳酸脱氢酶(LDH)活性测定。试剂盒由南京建成生物制品研究所提供,按照说明书操作。
1.4.5 肺组织相关指标检测 染毒后3、28 d,腹主动脉放血处死大鼠,取右肺组织冻存(-80℃),待测。采用标准比色法检测MDA含量及SOD、CAT和GSH-Px的活力。试剂盒由南京建成生物制品研究所提供,按照说明书操作。
1.4.6 肺组织病理学特征观察 取大鼠未灌洗的左肺组织标本经10%甲醛固定,常规石蜡包埋、切片和H-E染色,观察病理变化。
1.5统计学分析用Excel2007建立数据库,采用SPSS13.0进行单因素方差分析,方差齐时任意两组间比较采用LSD检验。方差不齐时任意两组间比较采用Dunnett’f检验,检验水准α=0.05。
2 结果
2.1一般情况实验中未发现小鼠有呼吸困难、进食减少等异常等现象,无死亡。实验期间各剂量组小鼠体质量变化与对照组比较差异无统计学意义(P>0.05)。
2.2纳米氧化铝悬液分散性及稳定性分析将纳米氧化铝悬液溶于生理盐水配制成浓度为100 μg/mL的悬液后将其超声分散30 min,观察得知悬液的平均粒径<100 nm,并且继续超声对平均粒径的改变无明显影响(图3)。纳米悬液超声30 min后静置,随着静置时间的增加,粒子开始团聚,纳米氧化铝悬液的平均粒径也有所增加,并且在静置15 min后平均粒径>100 nm(图4)。
2.3肺部灌洗液(BALF)中生化指标测定结果染毒后3、28 d,低、中、高剂量组中的乳酸脱氢酶(LDH)明显升高(P<0.05)。染毒后3 d,低、中、高剂量组的碱性磷酸酶(AKP)活性均较生理盐水组明显增加(P<0.05),中、高剂量组总蛋白(TP)含量较生理盐水组明显增加(P<0.05);染毒后28 d,中、高剂量组的碱性磷酸酶(AKP)活性较生理盐水组明显增加(P<0.05),低、中、高剂量组总蛋白(TP)含量较生理盐水组明显增加(P<0.05);染毒后3、28 d,各剂量组中酸性磷酸酶(ACP)活性均较生理盐水组明显升高(P<0.05),见表1。
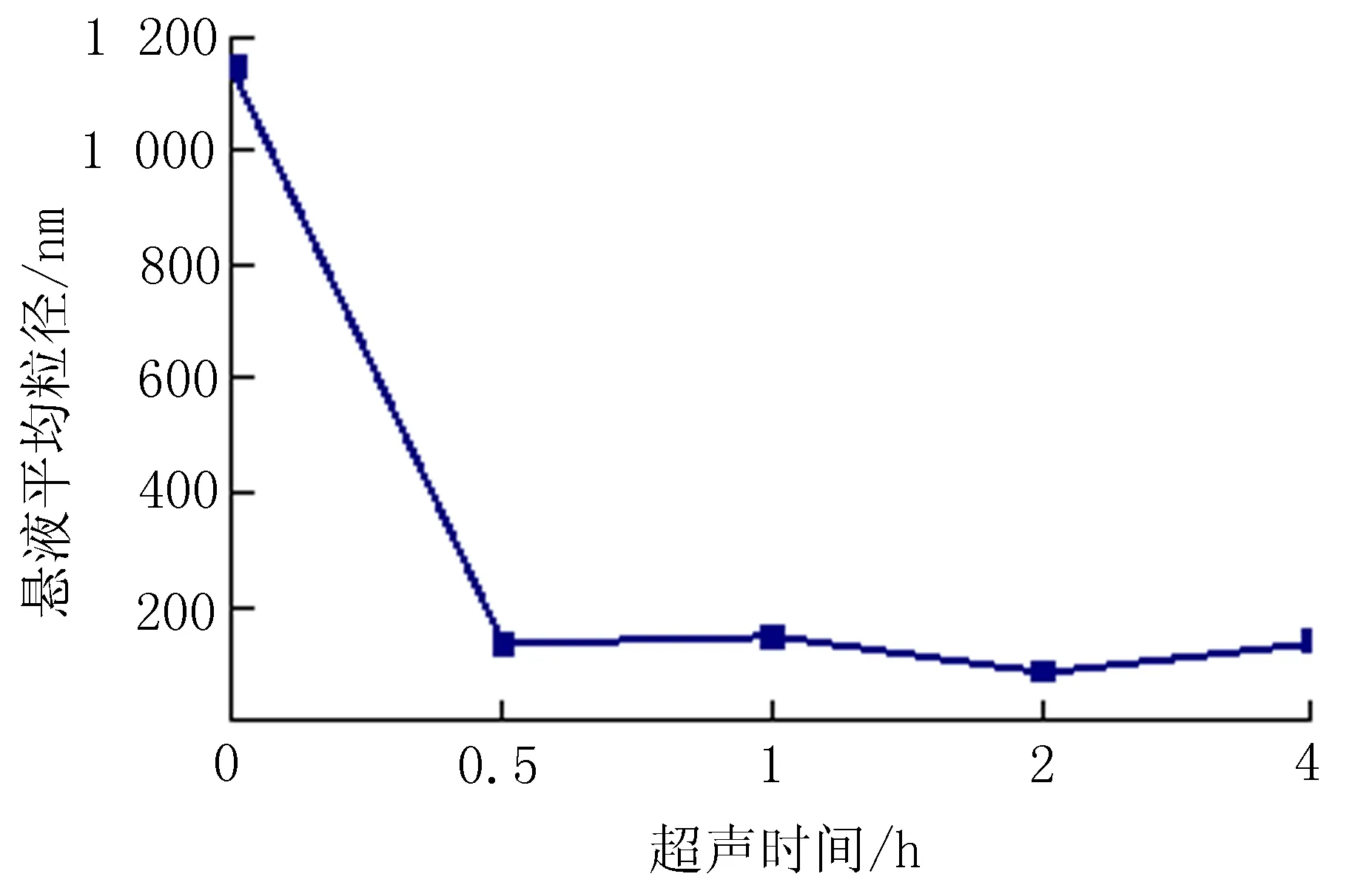
图3 纳米悬液超声时间与粒径变化
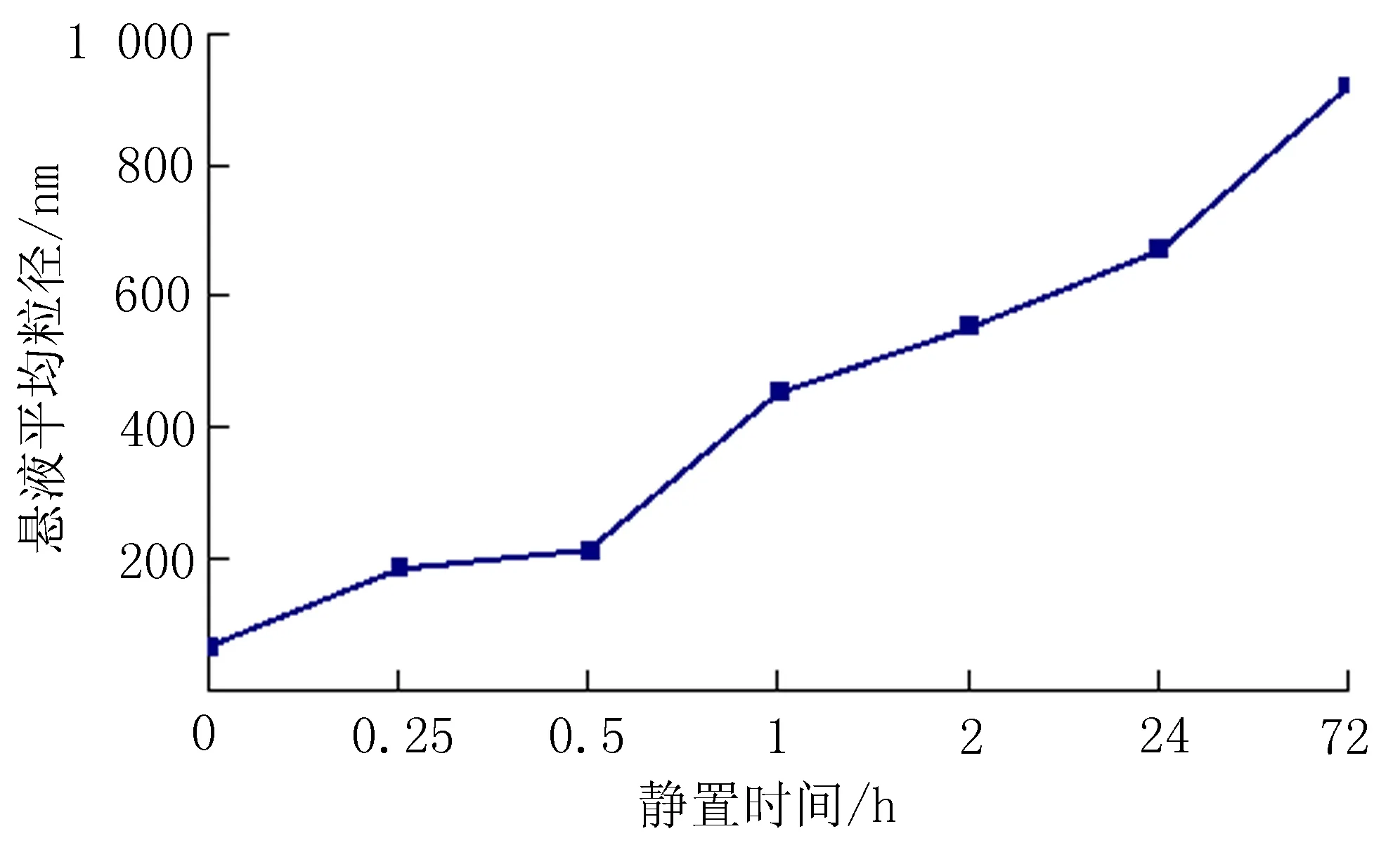
图4 纳米悬液静置时间与粒径变化

处理组TP/(g/L)3 d28 dLDH/(U/L)3 d28 dAKP/(U/100 mL)3 d28 dACP/(U/100 mL)3 d28 d生理盐水组0.16±0.030.20±0.05899.27±109.54947.84±213.431.34±0.082.52±0.911.18±0.631.18±0.71低剂量组0.18±0.080.26±0.12∗1 443.72±231.42∗1 521.44±145.64∗2.67±1.33∗2.31±0.421.92±1.27∗2.14±0.81∗中剂量组0.51±0.11∗0.48±0.18∗2 210.59±313.87∗1 978.63±215.96∗6.89±2.87∗5.52±1.27∗4.36±1.08∗3.71±2.07∗高剂量组0.58±0.06∗0.41±0.22∗2 824.05±296.58∗2 485.60±445.12∗7.71±2.19∗5.92±2.33∗5.15±1.48∗5.88±2.32∗
注:与生理盐水组比较,*P<0.05。
2.4灌洗液白细胞分类计数结果染毒后3 d,中、高剂量组白细胞总数和中性粒细胞的比例均较生理盐水组明显增加(P<0.05),巨噬细胞所占的比例明显降低(P<0.05)。染毒后28 d,中、高剂量组的白细胞总数和中性粒细胞所占的比例仍高于生理盐水组,并且差异具有统计学意义(P<0.05),高剂量组中的白细胞总数较3 d高剂量组有所下降,中性粒所占比例也有所下降,见表2、3。
表2 一次性肺部滴注3 d后大鼠肺部灌洗液白细胞计数及分类
注:与生理盐水组比较,*P<0.05。
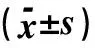
表3 一次性肺部滴注28 d后大鼠肺部灌洗液白细胞计数及分类类
注:与生理盐水组比较,*P<0.05。
2.5肺部组织氧化应激损伤结果一次性滴注3 d后,与生理盐水组相比,中、高剂量组丙二醛(MDA)含量明显增加(P<0.05),超氧化物歧化酶(SOD)活性显著降低(P<0.05);与生理盐水组相比,高剂量组谷胱甘肽过氧化物酶(GSH-Px)活性降低,差异具有统计学意义(P<0.05);一次性滴注28 d后,与生理盐水组相比,高剂量组丙二醛(MDA)含量显著增加(P<0.05),超氧化物歧化酶(SOD)活性降低,差异具有统计学意义(P<0.05),谷胱甘肽过氧化物酶(GSH-Px)活性显著降低(P<0.05);染毒后3、28 d,各组过氧化氢酶(CAT)活性差异均无统计学意义(P>0.05),见表4。
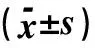
表4 染毒3、28 d后各组MDA、SOD、CAT及GSH-Px含量
注:与生理盐水组比较,*P<0.05。
2.6肺组织病理观察染毒后3、28 d,生理盐水组肺组织结构正常,无炎性浸润(图3a);染毒后3 d,低剂量组中出现了肺泡毛细血管扩张,有少量出血,支气管细胞周围有少量炎性细胞浸润,部分肺泡腔受压(图3b);中剂量组部分肺泡腔中有水肿液,同时有纤维素的渗出,间质有炎性细胞浸润。肺泡上皮细胞脱落,出现代偿性肺气肿,部分肺泡受压(图3c);高剂量组中间质细胞炎性浸润,部分肺泡腔有粉红色液状物,部分肺泡受压,出现肺不张(图3d)。染毒后28 d,生理盐水组结构正常(图3e)低剂量组炎性细胞渗出,肺泡壁增厚,部分断裂形成肺气肿(图3f);中、高剂量组与染毒后3 d时相比,均无特殊改变(图3g、图3h)。随剂量的增加,各种病理改变更加明显。
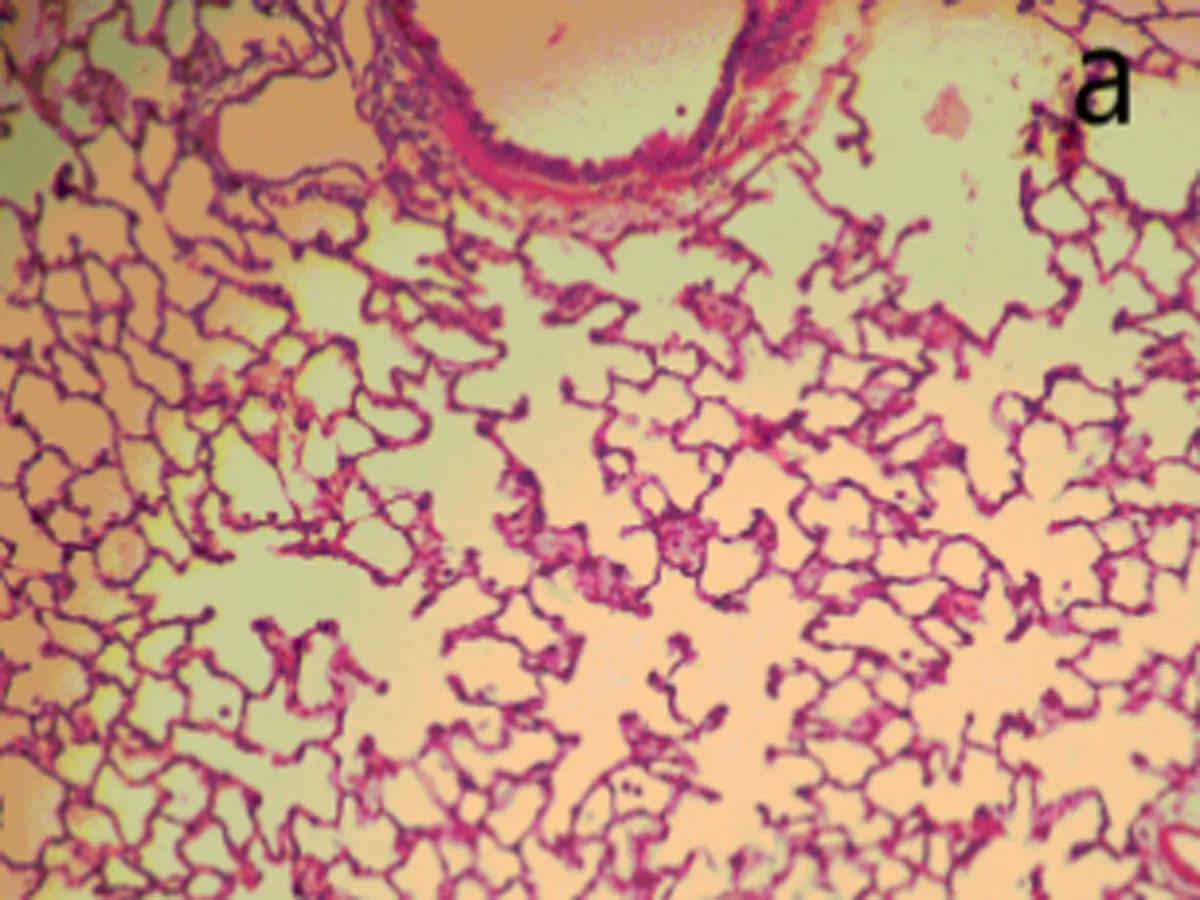
染毒后3 d, a: 生理盐水组
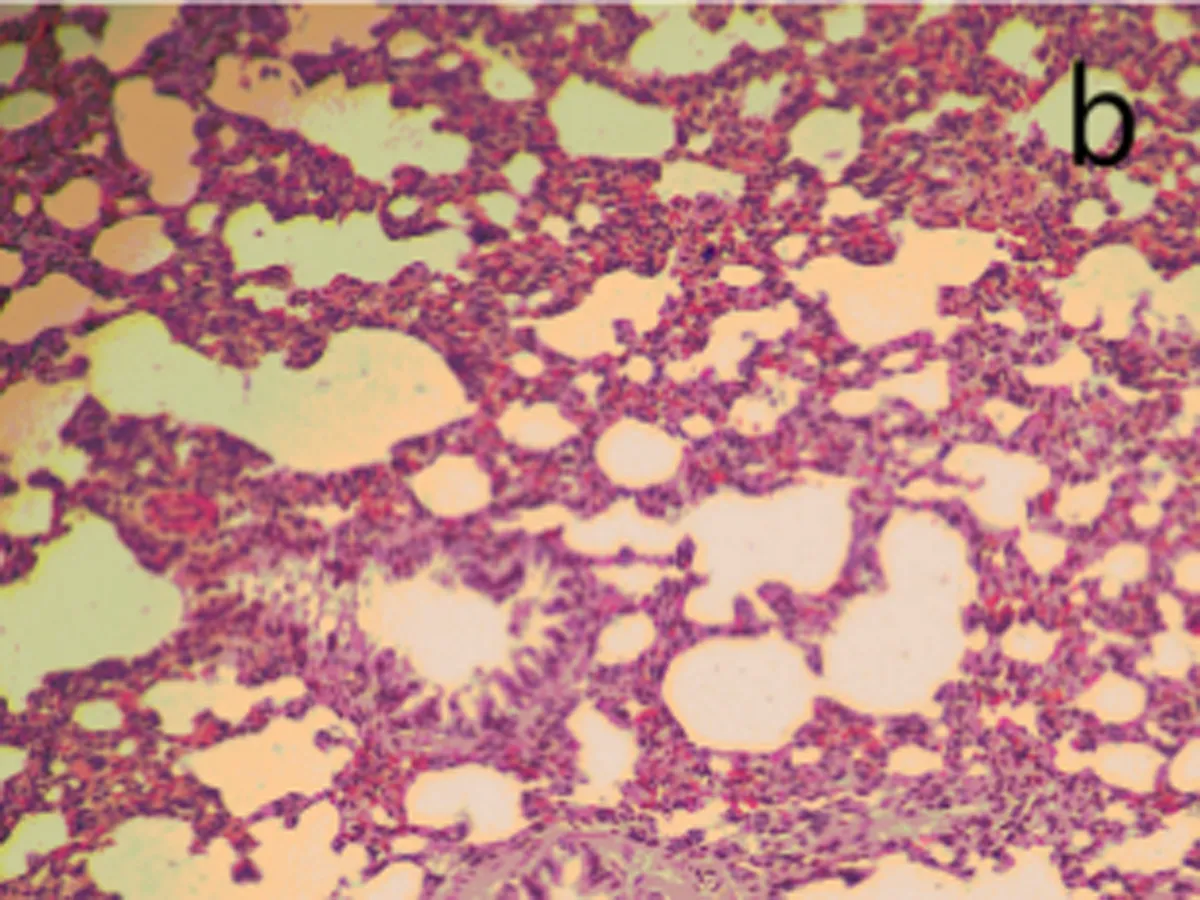
b: 低剂量组
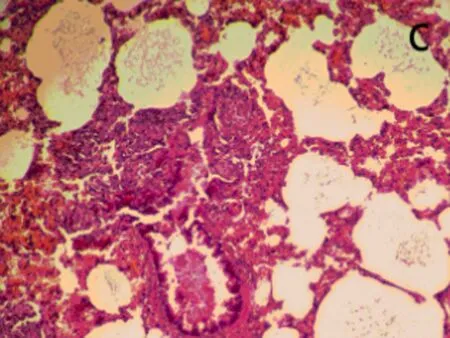
c: 中剂量组
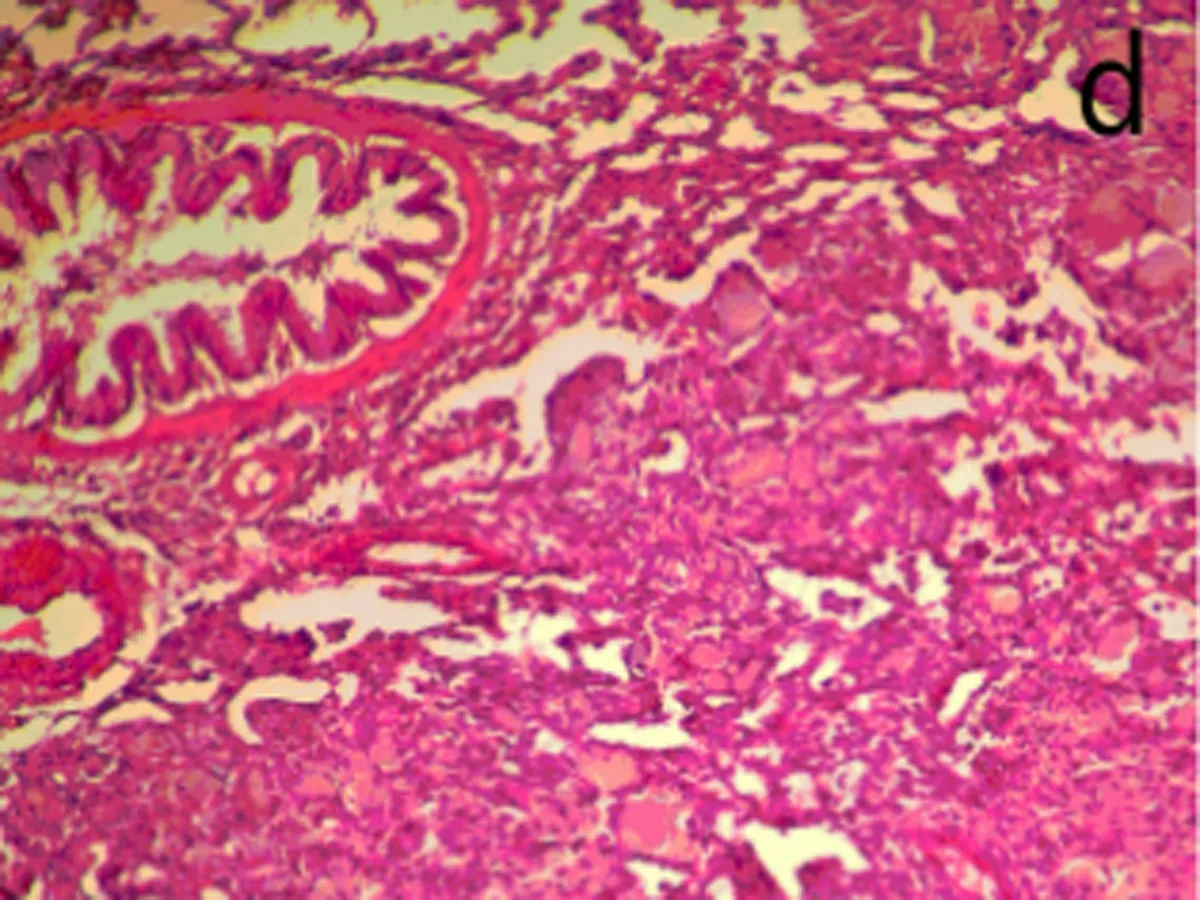
d:高剂量组
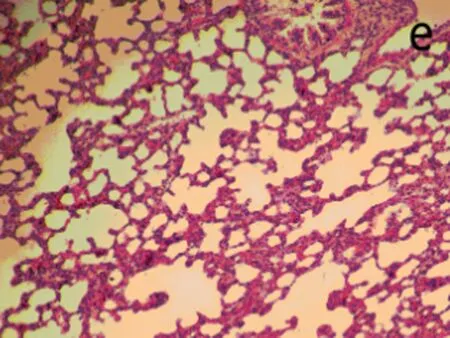
染毒后28 d, e: 生理盐水组
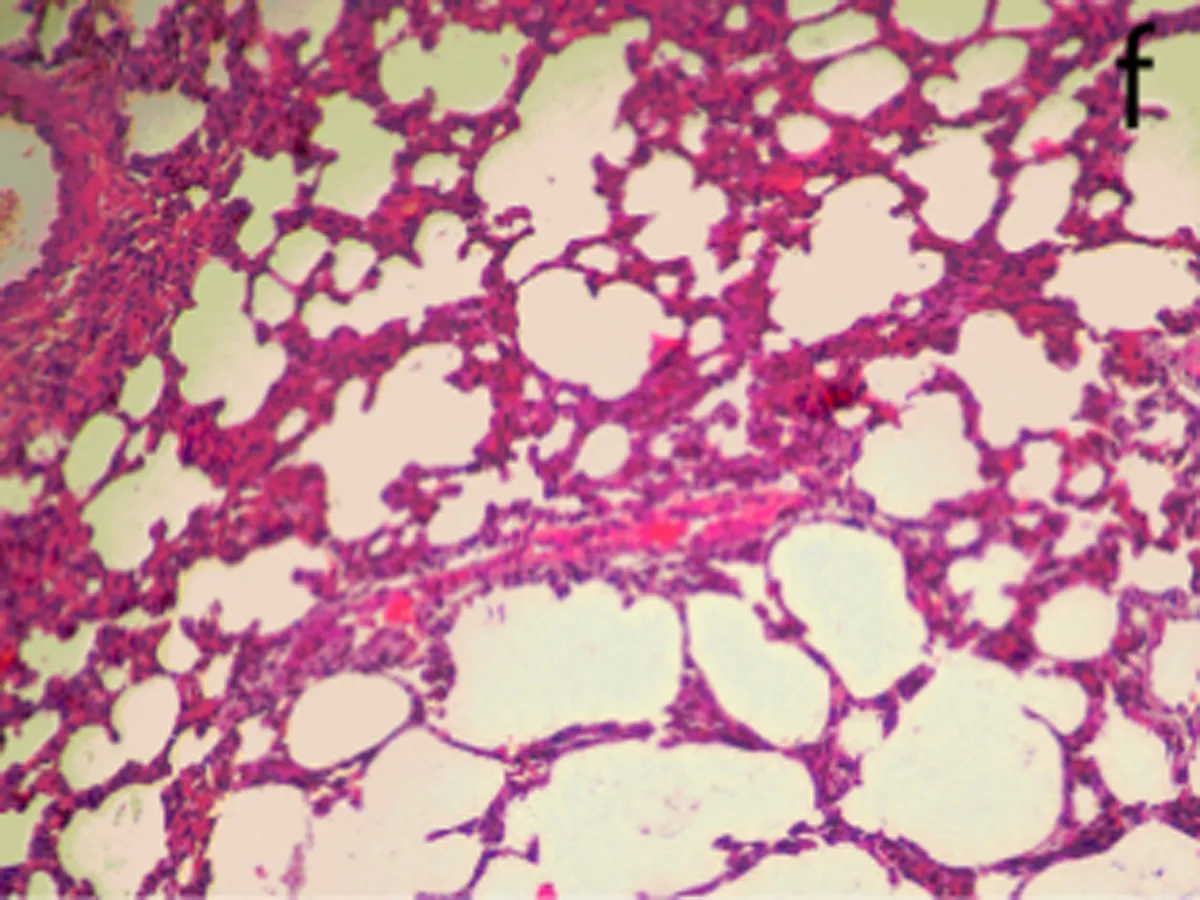
f: 低剂量组
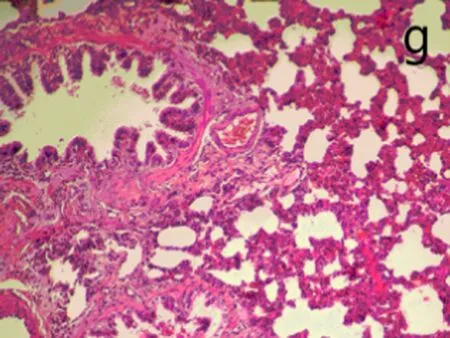
g: 中剂量组
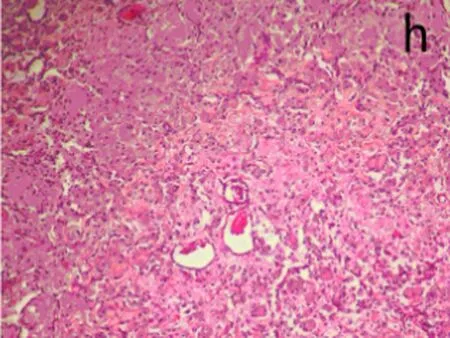
h: 高剂量组
图3肺部组织病理图片(HE×200)
3 讨论
大量研究表明,纳米颗粒物能引起急性肺部损伤,释放炎症因子[4-6]。本研究显示,在滴注染毒后3 d,各个剂量组病理结果相对于生理盐水组有明显改变,均出现了间质炎性细胞的浸润,中、高剂量组病理改变明显,部分肺泡腔受压,形成了代偿性肺气肿;在滴注染毒后28 d,各个剂量组与生理盐水组对比,同样还有炎性细胞的浸润。从病理结果可以看出,纳米氧化铝的确对肺部组织产生了急性损伤。
BALF中的白细胞分类计数的变化基本可以反映肺部组织的炎症反应,其中中性粒细胞浸润是导致肺部组织损伤发生发展的重要原因[7],中性粒细胞增多是肺泡炎症的标志[8]。本研究显示,染毒后3 d中性粒细胞比例增高,并且在染毒后28 d,比例仍然有显著增加。可能的原因是纳米氧化铝颗粒进入肺泡腔,造成肺泡上皮细胞和毛细血管上皮细胞的损伤,从而使巨噬细胞活化,导致中性粒细胞的大量渗出。而造成肺组织炎症反应持续到28 d,可能是一次性大剂量染毒后,纳米颗粒削弱了巨噬细胞的移动能力,从而导致纳米颗粒在肺组织中局部储留,继续造成肺部炎症损伤。从BALF的白细胞分类计数中可以观察到各个染毒剂量组巨噬细胞、中性粒细胞和淋巴细胞均较生理盐水组有明显改变。这与Gilmour等[9]和Nemmar等[10]研究的结果相符。
BALF中含有肺的游离细胞,从肺细胞分泌和渗出以及从血管渗出的各种生化成分,从而肺灌洗液成分的变化可定量、迅速地反映肺对各种吸入毒物的反应和肺受损的程度[11]。正常动物BALF中只含有少量的蛋白和低水平的酶活性。但当呼吸系统表皮或内皮细胞膜损伤时,导致血清流入呼吸道蛋白(TP)增加[11]。本研究结果显示,在滴注染毒后3 d和28 d,中、高剂量组较生理盐水组总蛋白含量(TP)均有显著升高。说明在滴入染毒后,纳米氧化铝对肺泡产生了直接的损伤,导致肺部的结构在短时间内遭到破坏,肺泡受损,细胞中的血浆大量渗出,导致BALF中的总蛋白(TP)含量升高;BALF中LDH在肺组织中的含量较丰富,主要源自于肺上皮细胞、中性粒细胞和肺巨噬细胞。LDH活力增加是肺细胞生物膜通透性或结构损伤的重要标志。当肺脏受损时,LDH会大量释放,导致细胞外液中活力增加[13]。AKP主要由肺泡Ⅱ型细胞产生,其活性水平提示了肺泡Ⅱ型细胞和上皮细胞膜损伤[14];ACP是溶酶体酶,巨噬细胞的溶酶体中富含ACP,当颗粒物进入肺部组织时,肺中巨噬细胞受到刺激,巨噬细胞吞噬纳米颗粒,使溶酶体数量增加、吞噬活跃。巨噬细胞死亡时,溶酶体破裂,ACP可大量释放至细胞外,使细胞外液中ACP活力增加,肺灌洗液中ACP活力的增加可以反映肺吞噬细胞活力加强或结构受损。因此,测定BALF中LDH及AKP、ACP的活力能反映纳米氧化铝的细胞毒性。本研究显示,染毒后3 d和28 d,各染毒组LDH、ACP、AKP的活性均较生理盐水组升高,说明一次性灌注后,纳米颗粒引起了肺部的急性炎症反应,造成了肺泡腔内渗出物增多,肺泡上皮细胞和血管内皮细胞受损,肺泡上皮-毛细血管屏障被破坏,表明纳米氧化铝对大鼠的肺实质和膜性组织具有毒性作用。
氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive oxygen species,ROS)和活性氮自由基(reactive nitrogen species,RNS)产生过多,氧化程度超出氧化物的清除,氧化系统和抗氧化系统失衡,从而导致组织损伤。对于纳米材料对大鼠体内产生毒性研究,一般主要认为纳米材料进入体内后引起体内氧化应激损伤[15]。其中MDA作为脂质过氧化的产物,其含量可直接最有效地反映出组织中氧化损伤的指标[16]。而在机体内,存在一类抗氧化酶类物质,如SOD、CAT、GSH-Px等,其主要功能是有效地抑制自由基的氧化损伤。SOD作为机体内主要清除氧自由基的抗氧化酶,其活性可直接反映机体内抗氧化反应的改变;谷胱甘肽过氧化物酶(GSH-Px),是机体内广泛存在的一种重要的催化过氧化物分解的酶,其可特异地催化还原型谷胱甘肽(GSH)对氢过氧化物的还原反应。一般认为它在细胞内能消除有害的过氧化代谢产物,阻断脂质过氧化链锁反应,从而起到保护细胞膜结构和功能完整的作用[17]。本研究结果表明,在染毒后3 d和28 d时,肺部组织中的MDA含量均较生理盐水组升高。染毒后3 d,中、高剂量组SOD的活性下降,染毒后3 d和28 d时,高剂量组肺部组织中的GSH-Px的活性与生理盐水组相比显著降低。说明当暴露于纳米氧化铝时,会导致过量ROS生成,体内的抗氧化防御系统无法清除完全,从而打破机体的氧化系统和抗氧化系统平衡,导致氧化应激的产生,引起大鼠肺部氧化损伤,一定剂量的纳米氧化铝可以引起肺部组织产生过多的自由基,导致肺部组织氧化损伤。从而引起肺部组织细胞损伤。
综上所述,本研究显示一次性纳米氧化铝的急性染毒可以引起大鼠肺部炎症反应和氧化应激反应。并且一次性滴注后,纳米颗粒在肺部中仍有储留,对肺部继续造成损伤。关于纳米氧化铝对于机体损伤机制仍需要进一步探讨。
参考文献:
[1] Campagnolo L, Massimiani M, Palmieri G, et al. Biodistribution and toxicity of pegylated single wall carbon nanotubes in pregnant mice[J]. Part Fibre Toxicol,2013,10(1):21.
[2] Donaldson K, Poland CA, Murphy FA, et al. Pulmonary toxicity of carbon nanotubes and asbestos similarities and differences[J]. Adv Drug Deliv Rev,2013,65(15):2078-2086.
[3] 邢小茹 ,吴国平,王春利,等. 硼作业工人的空气粉尘暴露与硼暴露测量与评价[J]. 中国环境监测,2005,21(3):50-53.
[4] Costa DL, Lehmann JR, Winsett D, et al. Comparative pulmonary toxicological assessment of oil combustion particles following inhalation or instillation exposure[J]. Toxicol Sci,2006,91(1):237-246.
[5] 赵晓红,刘红,金昱,等. 大气可吸入颗粒物对大鼠气道的致炎症作用研究[J]. 中国公共卫生,2011,19(1):17-19.
[6] 贾玉巧,赵晓红,郭新彪. 大气颗粒物PM10和PM2.5对人肺成纤维细胞及其炎性因子分泌的影响[J]. 环境与健康杂志,2011,28(3):206-208.
[7] Weinacker AB, Vaszar LT. Acute respiratory distress syndrome: physiology and new management strategies[J]. Annu Rev Med,2013,52:221-237.
[8] Federici G, Shaw BJ, Handy RD. Toxicity of titanium dioxide nanoparticles to rainbow trout (Oncorhynchus mykiss): gill injury, oxidative stress, and other physiological effects[J]. Aquat Toxicol,2012,84(4):415-430.
[9] Gilmour PS, Ziesenis A, Morrison ER, et al. Pulmonary and systemic effects of short-term inhalation exposure to ultrafine carbon black particles[J]. Toxicol Appl Pharmacol,2004,195(1):35-44.
[10] Nemmar A, Hoylaerts MF, Hoet PH, et al. Size effect of intratracheally instilled particles on pulmonary inflammation and vascular thrombosis[J]. Toxicol Appl Pharmacol,2003,186(1):38-45.
[11] 阚海东,陈秉衡. 我国大气颗粒物暴露与人群健康效应的关系[J]. 环境与健康杂志,2002,19(6):422-424.
[12] Lee YC, Hogg R, Rannels DE. Extracellular matrix synthesis by coal dust-exposed type II epithelial cells[J]. Am J Physiol,2008,267(4 Pt 1):L365-L374.
[13] Bajpai R, Waseem M, Gupta GS, et al. Ranking toxicity of industrial dusts by bronchoalveolar lavage fluid analysis[J]. Toxicology,2012,73(2):161-167.
[14] Punithavathi D, Venkatesan N, Babu M. Curcumin inhibition of bleomycin-induced pulmonary fibrosis in rats[J]. Br J Pharmacol,2011,131(2):169-172.
[15] De Angelis I, Barone F, Zijno A, et al. Comparative study of ZnO and TiO(2) nanoparticles: physicochemical characterisation and toxicological effects on human colon carcinoma cells[J]. Nanotoxicology,2013,7(8):1361-1372.
[16] Kowalczuk K, Stryjecka-Zimmer M. The influence of oxidative stress on the level of malondialdehyde (MDA) in different areas of the rabbit brain[J]. Ann Univ Mariae Curie Sklodowska Med,2002,57(2):160-164.
[17] Vicente E, Boer M, Netto C, et al. Hippocampal antioxidant system in neonates from methylmercury-intoxicated rats[J]. Neurotoxicol Teratol,2010,26(6):817-823.

