混合益生菌对仔猪生长及肠道菌群的影响
王娜,商志伟,赵敏
(1.东北林业大学生命科学学院,黑龙江 哈尔滨 150040;2.黑龙江民族职业学院 a.学生工作处;b.食品工程系,黑龙江 哈尔滨 150066)
混合益生菌对仔猪生长及肠道菌群的影响
王娜1,2a,商志伟2b,赵敏1*
(1.东北林业大学生命科学学院,黑龙江 哈尔滨 150040;2.黑龙江民族职业学院 a.学生工作处;b.食品工程系,黑龙江 哈尔滨 150066)
选用50头体重相近的三元杂交断奶健康仔猪,随机分为5组:对照组全程饲喂玉米−豆粕型基础日粮;试验1、2、3、4组在试验第1天到第28天分别饲喂基础日粮+蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌(质量比为1∶1∶1、1∶2∶1、2∶1∶2、1∶1∶2)的混合益生菌制剂,在第29天到第42天饲喂基础日粮。饲喂28 d后计算各组仔猪日增重、料重比、腹泻率。结果表明:4个试验组仔猪的日增重均高于对照组,料重比均低于对照组,腹泻率均显著低于对照组;试验1、3组仔猪的日增重显著高于对照组,且试验1组仔猪的日增重又稍高于试验3组;试验1、3组仔猪的料重比显著低于对照组,而试验1组仔猪的料重比又稍低于试验3组;试验1组和3组仔猪的腹泻率相同,且低于试验2组和4组,表明4种比例混合的益生菌制剂均能促进仔猪生长,且以质量比1∶1∶1、2∶1∶2混合的益生菌制剂促进仔猪生长的效果较好;对试验1组和对照组仔猪在试验0、7、14、21、28、42 d肠道内菌群的定量PCR结果表明,试验1组仔猪肠道内蜡样芽孢杆菌、鼠李糖乳杆菌数量在饲喂益生菌制剂期间呈现一致的变化趋势,即先上升后下降,再上升,而对照组3种菌的变化趋势不一致;在停喂益生菌制剂2周后,3种益生菌仍呈规律变化,表明饲喂益生菌制剂能够调节仔猪肠道相应菌群的生长;对仔猪肠道粪样菌群的 16SrDNA的特异序列的进行变性梯度凝胶电泳及抠胶测序的结果表明,仔猪在饲喂益生菌制剂7 d后,肠道蜡样芽孢杆菌、肠球菌、链球菌、双歧杆菌、戊糖乳杆菌、大肠杆菌、鼠李糖乳杆菌菌群数量均下降,到第 28天时,各种菌群数量均上升,表明饲喂益生菌制剂不仅能调节仔猪肠道相应益生菌的生长,还能调节肠道肠球菌、链球菌、大肠杆菌与双歧杆菌的生长。
仔猪;微生态制剂;变性梯度凝胶电泳(DGGE);肠道菌群
微生态制剂是一种绿色、无公害的添加剂[1]。合理利用微生态制剂,可以有效减少仔猪断奶应激的发生,预防和治疗仔猪腹泻[2]。
仔猪饲喂微生态制剂后,制剂中的益生菌可有效定植在仔猪肠道内[3],调节肠道菌群,增加有益细菌的数量[4]。含多种益生菌的混合菌制剂有益于微生物的互补[5–6]。本研究将蜡样芽孢杆菌、戊糖乳杆菌和鼠李糖乳杆菌以不同比例配伍,制成益生菌制剂添加到饲料中,饲喂断奶仔猪,以探讨不同比例混合的3种益生菌对仔猪生长性能和肠道菌群的影响,旨在为菌种的合理搭配和复合微生物制剂的生产应用提供参考依据。
1 材料与方法
1.1 材 料
1.1.1 供试猪
选用 28日龄,未接受疫苗免疫接种,初始体重为(9.60±0.42) kg的“杜×长×大”三元杂交健康断奶仔猪50头。
1.1.2 菌 种
蜡样芽孢杆菌由东北林业大学微生物实验室从健康断奶仔猪粪便中分离并鉴定;鼠李糖乳杆菌(CICC 6159)、戊糖乳杆菌(CICC 21809)购置于中国工业微生物菌种保藏管理中心。
1.1.3 培养基
戊糖乳杆菌培养基配方为1%乳糖+1%废糖蜜+ 0.5%棉粕粉+0.3%磷酸二氢钠+0.3%磷酸氢二钠;蜡样芽孢杆菌培养基配方为 0.5%蔗糖+0.5%废糖蜜+ 1%棉粕粉+0.3%氯化钠;鼠李糖乳杆菌培养基配方为1%乳糖+1%废糖蜜+0.5%棉粕粉+0.3%磷酸二氢钠+0.3%磷酸氢二钠。
1.1.4 饲 料
基础日粮为玉米–豆粕型粉料,营养需要参照英瑞斯企业标准[7]设计。
1.2 方 法
1.2.1 益生菌制剂的制备
分别发酵戊糖乳杆菌[8]、蜡样芽孢杆菌[9]、鼠李糖乳杆菌[10],8 000 g离心10 min,得菌泥。向菌泥中加入5%葡萄糖溶液作为保护剂,再拌入约3倍菌泥体积的灭菌干燥稻壳粉,10 ℃干燥,得活菌制剂。检测3种活菌制剂活菌数(戊糖乳杆菌、蜡样芽胞杆菌、鼠李糖乳杆菌的活菌数分别为2.6×108、1.4×109、3.5×108CFU/g)后备用。将制备好的蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌制剂分别以质量比为1∶1∶1、1∶2∶1、2∶1∶2、1∶1∶2的比例混合,即得4种混合益生菌制剂。
1.2.2 试验设计及饲养管理
试验于大庆市泰康县康泰公司种猪场进行。50头仔猪随机分为5组,每组10头。对照组喂基础日粮,试验1、2、3、4组分别喂基础日粮+1∶1∶1、1∶2∶1、2∶1∶2、1∶1∶2比例混合的益生菌制剂。试验组喂食益生菌制剂 28 d后改喂基础日粮14 d。饲喂时间为每天08:00、13:00、19:00。自由饮水。每次饲喂直至料槽无剩余饲料为止。所有供
试猪均于相同条件的畜舍饲养。室内通风良好,光线充足,并定期对畜舍消毒灭菌。
1.2.3 试验记录及样品采集
试验期间,每日对仔猪逐只进行空腹称重,详细记录各组采食量。每日08:00定时观察记录各组仔猪腹泻情况。计算各组仔猪的日增重、日采食量、料重比和腹泻率[7]。分别于第0(饲喂益生菌制剂当日空腹取样)、7、14、21、28、42(停喂益生菌制剂14 d)天取各组仔猪的粪便样品(约10 g),置于–80 ℃冰箱保存,备用。
1.2.4 粪便DNA样品的制备
第0天粪便样品DNA的制备:从试验组(生长性能最佳的试验组)和对照组每只仔猪粪便样品中各取2 g,按组将粪便样品充分混合后,各组取2 g混合粪样,分别放入组织粉碎机中磨碎,分别加入8 mL无菌磷酸缓冲液稀释,充分混匀后取200 μL匀浆,用QIAamp DNA试剂盒(Qiagen)逐一提取样品基因组DNA。第7、14、21、28、42天粪便样品DNA的制备方法同上。
1.2.5 定量PCR检测
1) 引物。根据GenBank中蜡样芽孢杆菌、鼠李糖乳杆菌、戊糖乳杆菌菌株的16SrDNA 序列,利用NDAman软件比对出种内保守区域,用Primer 5设计特异性引物(表1)。

表1 蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌特异性引物Table 1 Primers for detecting B acillus cereus, Lactobacillus rhamnosus and Lactobacillus pentosus
2) 蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌的定量 PCR检测。利用 PCR检测系统(Bio–Rad, CFX96 Touch)进行定量分析。分别取200 μL蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌培养液,进行l0倍系列稀释(浓度范围107~102CFU/μL),以稀释的菌为模板,根据定量试剂盒(SYBR Premix Ex Taq™ II,TAKARA)说明书进行定量PCR,反应体系为50 μL:SYBR Premix Ex Taq II 25 μL,0.2 mmol/L上、下游引物(F1和R1、F2和R2或F3和R3) 各1 μL,模板1 μL,ROX Reference Dye(50×) 1 μL。反应条件:95 ℃预变性10 min;95 ℃变性40 s,61 ℃退火25 s,72 ℃延伸30 s,35个循环。制定3种菌定量PCR的标准曲线,获得循环阈值(Ct)对菌液浓度的对数方程。
对粪便DNA样品进行PCR检测,反应体系与反应条件同上。将检测结果与标准曲线在同一系统中进行分析,通过与标准曲线的Ct值进行比较,得到粪便样品中3种益生菌的数量。
1.2.6 变性梯度凝胶电泳(DGGE)分析
1) PCR反应。用细菌16S rDNA的V6–V8 区特异引物F933–954(5′–CGCCCGCCGCGCGCGGC GGGCGGGGCGGGGGCACGGGGGGGCACAAG CGGTGGAGCATGTGG–3′)和 R1369–1388(5′–GC CCGGGAACGTATTCACCG–3′)[11]对粪便DNA样品进行PCR检测,扩增细菌的特异性片段。
2) DGGE。以上PCR产物用DGGE 进行分析。DGGE用8%聚丙烯酰胺凝胶,尿素浓度梯度30%~50%,电泳缓冲液为0.5×TAE,先200 V恒压预电泳10 min,随后在85 V电压电泳10~12 h。电泳结束后,用银染法进行染色。显色定影后干燥过夜,观察染色效果并照相。
3) 特殊条带的序列测定和分析。将DGGE凝胶图谱上的特殊条带进行回收,用引物8f 和 1510r[12]扩增回收产物中细菌16S rDNA的全序列,然后将PCR产物进行胶回收,与pMD–18T载体(TAKARA)连接,转化至大肠杆菌感受态中。将转化成功的质粒进行测序,用GenBank数据库对获得的序列进行同源性比较。
1.2.7 数据统计与处理
所有数据应用 SPSS13.0统计软件进行方差显著性分析。
2 结果与分析
2.1 4种混合益生菌制剂对仔猪日增重、料重比及腹泻率的影响
由表2可知,4个试验组仔猪的日增重均高于对照组,且试验1组和3组的日增重显著高于对照组;4个试验组仔猪的料重比均低于对照组,且试验1组和3组的料重比显著低于对照组;4个试验组仔猪的腹泻率均显著低于对照组,且试验1组和3组仔猪的腹泻率低于试验2组和4组。与对照组仔猪相比,试验1组仔猪的日增重提高了18.42%,料重比降低了15%,腹泻率降低了50%(P <0.05);试验2组仔猪日增重提高了7.89%,料重比降低了8.5%,腹泻率降低了42.86%(P<0.05);试验3组仔猪日增重提高了15.79%,料重比降低了17%,腹泻率降低了50%( P <0.05);试验4组仔猪日增重提高了 7.89%,料重比降低了 8.5%,腹泻率降低了35.71%。可见,在饲料中添加以1∶1∶1、1∶2∶1、2∶1∶2、1∶1∶2混合的蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌的混合益生菌制剂均可以促进断奶仔猪的生长发育,提高抗病力,其中以1∶1∶1、2∶1∶2比例混合的3种有益菌的制剂(试验1、3组)的效果较好。
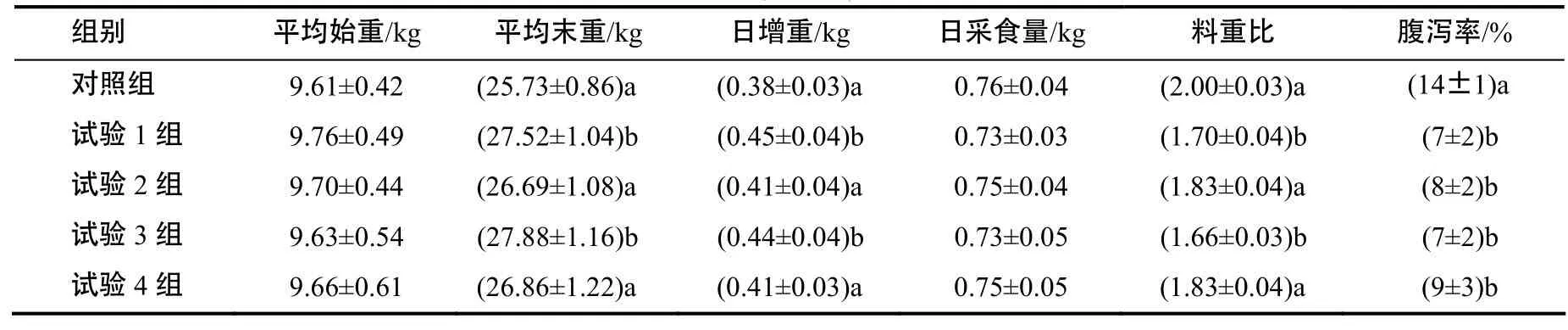
表2 益生菌制剂对仔猪生长性能的影响Table 2 Effects of probiotics on growth performance of weaned piglets
2.2 益生菌的定量检测结果
2.2.1 3种益生菌定量PCR的标准曲线
对蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌培养液l0倍系列稀释样品进行定量PCR,获得的标准曲线方程分别为y = –3.131 4x+36.525,r2=0.987 5;y= –3.12 x + 35.24,r2=0.994 7;y= –3.034 3x +34.988,r2=0.990 5,其中y为 Ct值;x为菌落数的对数;r为相关系数。
2.2.2 粪样中3种益生菌的定量PCR检测
用建立的定量PCR对试验1组和对照组仔猪粪样中的蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌进行检测,结果见表3。在第0天,从试验1组和对照组中均检测到蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌,且试验1组中3种杆菌的量均高于对照组,说明在饲喂益生菌制剂前仔猪肠道内存在3种杆菌,且对照1组与试验组存在差异。在第7天,试验1组的蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌均高于对照组,且试验1组的蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌在试验第7天的增幅(相对于第0天)(53.07%、28.57%、25.69%)均高于对照组的增幅(5.70%、25.32%、–5.95%),说明饲喂蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌混合益生菌制剂后,3种菌在猪肠道的数量明显上升。从0~28 d,试验1组仔猪肠道的蜡样芽孢杆菌、鼠李糖乳杆菌和戊糖乳杆菌均出现上升(0~7 d)、下降(7~21 d)、再上升(21~28 d)的趋势,而对照组仔猪肠道3种菌的变化趋势不一致。说明饲喂的益生菌制剂使仔猪肠道相应的益生菌在短时间内快速上调,继而进入自然下调与上升的模式。在第42天,即停喂益生菌制剂后,试验1组仔猪肠道的蜡样芽孢杆菌、鼠李糖乳杆菌均呈下降趋势,这应该是在第28天时,其数量已经达到峰值,而趋向于自然下降。戊糖乳杆菌在第42天的数量高于第28天的,应该是在第28天时还没有达到峰值,而呈现出的自然上升,这提示益生菌制剂连续饲喂7 d即可达到调节肠道菌群的效果。2.3 制剂对断奶仔猪肠道菌群的影响
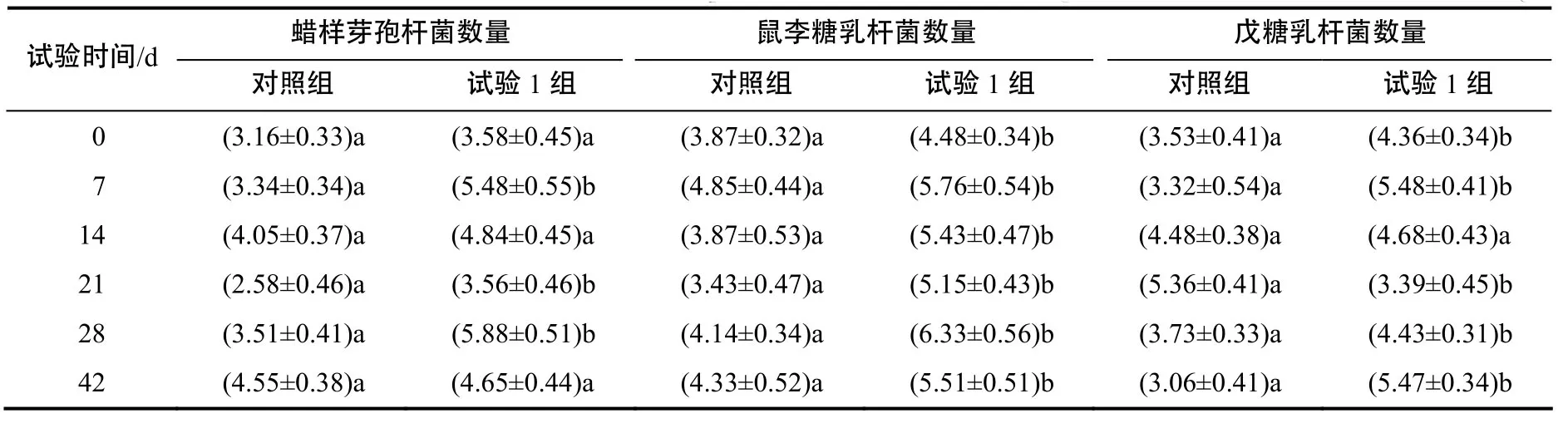
表3 微生态制剂对仔猪体内菌群的影响Table 3 Effects of probiotics on flora in weaned piglets CFU/g
仔猪肠道细菌16S rDNA PCR检测产物的DGGE电泳结果见图4。抠胶测序结果表明,箭头1~3所指的条带的序列与蜡样芽胞杆菌、肠球菌、链球菌16S rDNA的序列的同源性分别为98%、97%、98%,箭头4、5所指条带的序列与双歧杆菌16S rDNA的序列的同源性为98%;箭头6~8所指的条带的序列与戊糖乳杆菌、大肠杆菌、鼠李糖乳杆菌16S rDNA的序列的同源性为99%、98%、100%,因此,在试验第0天,从试验1组仔猪肠道除检测到蜡样芽胞杆菌(箭头1所示)、链球菌(箭头3所示)、戊糖乳杆菌(箭头6所示)、大肠杆菌(箭头7所示)、鼠李糖乳杆菌(箭头8所示),还检测到对照组仔猪肠道未检出的肠球菌(箭头2所示)和双歧杆菌(箭头5、6所示)。试验14、21 d,对照组检测到蜡样芽胞杆菌、肠球菌、链球菌及、双歧杆菌、戊糖乳杆菌、大肠杆菌、鼠李糖乳杆菌,其中肠球菌和双歧杆菌均为新检测到的细菌,且其他细菌的检测条带均比第0天明显,说明对照组仔猪肠道中,除了有益生菌的增长,还有非益生菌的大量增长。试验1组在试验14、21 d,未检测到肠球菌和双歧杆菌,且其他各种菌的检测条带的信号均较弱,说明在这段时间,整个肠道细菌的生长都下调,且有害菌(肠球菌)的生长下调最大。试验第28、42天,对照组能检测出蜡样芽胞杆菌、链球菌、戊糖乳杆菌、大肠杆菌、鼠李糖乳杆菌,且各种菌的检测条带的信号均较弱,说明在这段时间整个肠道细菌的数量下降,且肠球菌与双歧杆菌的下降最明显;试验组则相反,各种菌的检测条带的信号增强,且重新出现肠球菌和双歧杆菌。
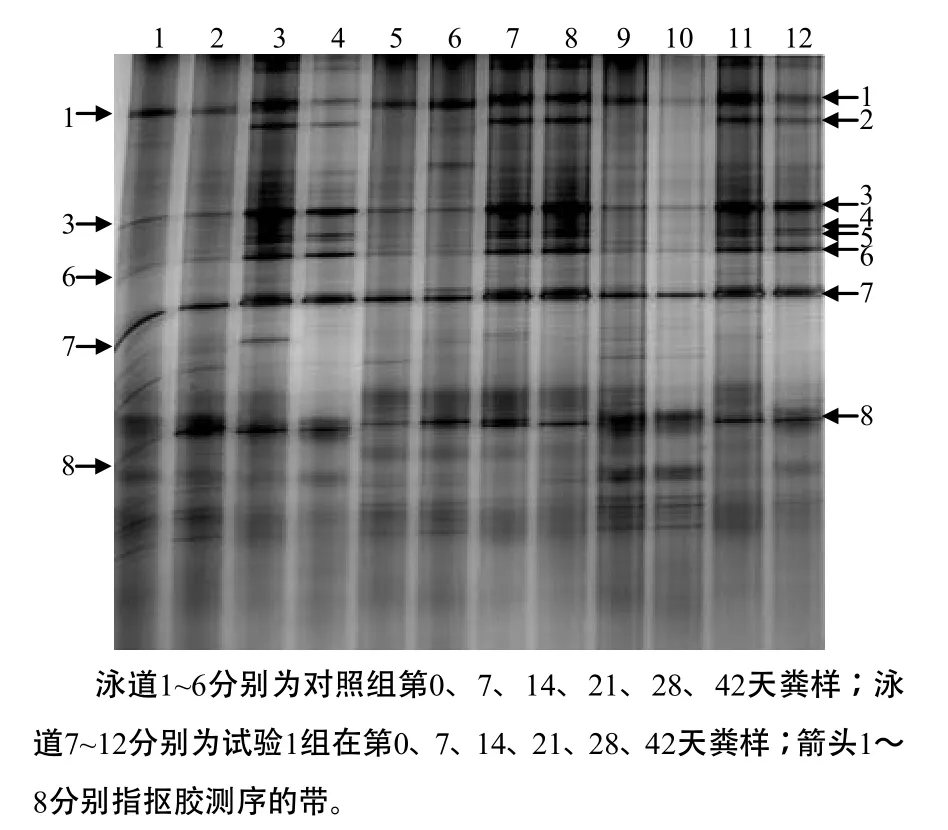
图4 仔猪粪样细菌16S rDNA的V6至V8区扩增产物的DGGE图谱Fig.4 Bacterial DGGE p rofiles generated from V6–V8 16S rDNA fragments of piglet fecal samples
3 讨 论
本研究通过给断奶仔猪饲喂益生菌制剂,发现以1∶1∶1、1∶2∶1、2∶1∶2、1∶1∶2比例配制的蜡样芽孢杆菌、鼠李糖乳杆菌、戊糖乳杆菌混合益生菌制剂均能促进仔猪的生长,降低仔猪的腹泻率。这可能是由于制剂中的菌体本身含有大量的营养物质,如B族维生素、泛酸、叶酸、类胡萝卜素、钙、磷和多种微量元素等[13–14],可为动物补充营养;益生菌在发酵或代谢过程中可以产生各种酶类,有助于食物的消化吸收,促进生长发育[15–16];益生菌可以维持消化道中有益菌的优势,并与有害菌竞争营养物质来维持微生物区系的平衡,提高机体的抗应激能力[17]。4种混合比例中,以1∶1∶1、2∶1∶2比例配制的3种菌的混合制剂的效果较好。
断奶仔猪日粮中添加益生菌可改善仔猪肠道微生物菌群[17],对断奶仔猪肠道粪样中蜡样芽孢杆菌,鼠李糖乳杆菌、戊糖乳杆菌的定量PCR检测结果表明,饲喂益生菌制剂能在短时间内调节断奶仔猪肠道3种菌的数量。对断奶仔猪肠道粪样所有细菌的16SrDNA序列的DGGE电泳及测序分析表明,蜡样芽孢杆菌、鼠李糖乳杆菌、戊糖乳杆菌3种菌的益生菌制剂不仅能调节断奶仔猪肠道内相应菌群的生长,还能调节其他菌群如肠球菌、链球菌、大肠杆菌与双歧杆菌的生长。
参考文献:
[1] 胡顺珍,张建梅,谢全喜,等.复合微生态制剂对肉鸡生产性能、肠道菌群、抗氧化指标和免疫功能的影响[J].动物营养学报,2012,24(2):334–341.
[2] Bocourt R,Lourdes S,Juana D.Effect of the probiotic activity of Lactobacillus rhamnosus on physiological indicators of suckling pigs[J].Cuban Journal of Agricultural Science,2004,38(4):403–408.
[3] 张锦华.猪源乳酸杆菌的筛选及其对仔猪肠道黏膜免疫影响的研究[D].南京:南京农业大学动物医学院,2011.
[4] 苏勇,姚文,朱伟云.益生菌Lactobacillus amylovorus S1 对仔猪后肠菌群的影响[J].微生物学报,2006,46(6):961–966.
[5] Collado M C,Jalonen L,Meriluoto J,et al.Protection mechanism of probiotic combination against human pathogens:In vitro adhesion to human intestinal mucus[J]. Asia Pac J Clin Nutr,2006,15(4):570–575.
[6] Sanders M E,In’t Veld J H.Bringing a probioticcontaining functional foodnto the market:Microbiological,product,regulatory and labeling issues[J].Antonie van Leeuwenhoek,1999,76(1):293–315.
[7] 陆晓菲.饲用复合芽孢杆菌活菌制剂的研究[D].哈尔滨:东北林业大学生命科学学院,2012.
[8] 吕燕妮,李平兰,周伟.戊糖乳杆菌31–1菌株产细菌素发酵条件优化[J].微生物学通报,2005,32(3):13–15.[9] 秦艳,李卫芬,余东游.蜡样芽孢杆菌发酵条件的优化[J].饲料工业,2008,29(2):34–36.
[10] 钟日聪,徐春厚,包丽华.鼠李糖乳杆菌和啤酒酵母共生发酵条件的优化[J].饲料工业,2007,28(18):28–30.
[11] Muyzer G,de Waal E C,Uitterlinden A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polyinerase chain reaction–amplified genes encoding for 16S rDNA[J].Applied and Environmental Microbiology,1993,59(3):695–700.
[12] Shannon C,Weaver W.The mathematical theory of communication[M].Urbana:University of Minois Press,1963.
[13] 王士长,徐菊芬,张梅芳.益生素生产菌的生物学特性研究[J].广西科学院学报,1999,15(l):54–56.
[14] Coates M.Intestinal synthesis of the B complex in chickens[J].British Journal of Nutrition,1968,22(3):493–500.
[15] 张勇,朱宇旌.动物微生态营养及其调控[J].畜禽业,1999(9):26–28.
[16] 陈惠,吕道俊.芽孢杆菌对生长肥育猪肠道菌群及酶活性的影响[J].四川农业大学学报,1994,12(S1):550–553.
[17] 徐海燕,武香玉,辛国芹,等.复合微生态制剂在断奶仔猪生产中的应用研究[J].畜牧与饲料科学,2012,33(4):74–76.
责任编辑:罗 维
英文编辑:罗 维
Effect of probiotics on growth and intestinal flora of piglet
WANG Na1,2a,SHANG Zhi-wei2b,ZHAO Min1*
(1.College of Life Science, Northeast Forestry University, Harbin, Heilongjiang 150040, China; 2.a.Heilongjiang Vocational College for Nationalities, Department of Student Affairs; b.Heilongjiang Department of Food Engineering, Vocational College for Nationalities, Harbin, Heilongjiang 150066, China)
Fifty weaned healthy piglets with similar weight were randomly assigned to five groups: control group fed with corn-soybean meal diets during all the process; test group 1, 2, 4 and 4 first fed with basal diet added with probiotics containing Bacillus cereus, Lactobacillus rhamnosus, and Lactobacillus pentosus mixed in ratio of 1∶1∶1, 1∶2∶1, 2∶1∶2 and 1∶1∶2, respectively from the 1stto the 28thday of the experiment, then with basal diet from the 29thday to the 42ndday. Daily gain, feed/weight ratio, diarrhea rate were calculated after 28 days of feeding. The results showed that daily gain was higher, feed/weight ratio was lower and diarrhea rate was significantly lower in piglets of test groups compared to the control. Daily gain of piglets in test group 1 and 3 was significantly higher than that in the control and in test group 1 was slightly higher than in group 3. Feed/weight ratio of piglets in test group 1 and 3 was significantly lowerthan that in the control and in test group 1 was slightly lower than in group 3. Piglets in test group 1 and 3 showed the same diarrhea rate which was lower compared to test group 2 and 4. These results indicate probiotics with mixing ratio of 1∶1∶1 and 2∶1∶2 have better growth promoting effect for piglets. Quantitative PCR was applied on samples of test group 1 and control group collected after 0, 7, 14, 21, 28, 42 d from the beginning of the experiment, the results showed Bacillus cereus, Lactobacillus rhamnosus, and Lactobacillus pentosus in intestine of piglets in test group 1 exhibited the same growth tendency during feeding the probiotics, which increased and then decreased and increased again, while the 3 strains in intestine of piglets of control group didn’t show such same tendency. The 3 strains still showed regular changes 2 weeks after ceased feeding the probiotics, indicating probiotics could regulate the growth of the correspond bacteria in intestine of the piglets. Denaturing gradient gel electrophoresis (DGGE) and sequencing of 16SrDNA showed that Bacillus cereus, Enterococcus, Streptococcus, Bifidobacterium, Lactobacillus pentosus, Escherichia coli and Lactobacillus rhamnosus decreased 7 days after feeding probiotics, and increased 28 days after feeding probiotics, showing probiotics could not only regulate the growth of the correspond strain, but also the growth of Enterococcus, Streptococcus, Escherichia coli and Bifidobacterium in the intestine.
piglets; probiotics; denatured gradient gel electrophoresis (DGGE); intestinal flora
S816.3;S828
A
1007−1032(2014)03−0305−06
10.13331/j.cnki.jhau.2014.03.016
投稿网址:http://www.hunau.net/qks
2013–09–15
国家自然科学基金项目(31170553;30671702)
王娜(1979—),女,蒙古族,博士研究生,副教授,主要从事微生态制剂的研究,wangna7830@sohu.com;*通信作者,13104510480@163.com

