魔芋内生拮抗细菌生防机理研究
周丽洪,姬广海*,王永吉,李淼,杨俊,魏兰芳
(云南农业大学 a.植物保护学院;b.农科基础实验教学中心,云南 昆明 650201)
魔芋内生拮抗细菌生防机理研究
周丽洪a,姬广海a*,王永吉a,李淼a,杨俊a,魏兰芳b*
(云南农业大学 a.植物保护学院;b.农科基础实验教学中心,云南 昆明 650201)
对自选魔芋内生拮抗细菌M3、1–7、M2的生防机理进行研究,结果表明,魔芋内生菌M3、1–7、M2具有广谱抗性,3株菌及其代谢粗提物对不同致病力的魔芋软腐病菌均有拮抗作用;3株拮抗菌分别含有不同的抗菌素基因,1–7与魔芋软腐病菌MY9的相似营养系数最高,达90.63%;M3在魔芋根际及体内定殖能力均为最强,可达8.2×107CFU/g;接种时间、接种量及接种方式对生防效果影响较大,生防效果与拮抗菌接种量呈正相关,接种病原菌前1 d接种拮抗菌生防效果最优,球包衣的防治效果优于灌根,M3包衣防效可达79.15%;施入拮抗菌后,魔芋体内和根际土壤微生物群落对底物代谢碳源利用的丰富度和代谢活性明显提高。
魔芋;胡萝卜软腐果胶杆菌;内生细菌; 生防机理
魔芋为天南星科魔芋属(Amorphophallus)多年生草本块茎植物[1],是自然界仅有的几种含有天然葡甘露聚糖的植物之一[2],目前种植总面积已达 1.0×105hm2,年产量6.0×105~ 8.0×105t。由胡萝卜软腐果胶杆菌(Pectobacterium carotovora subsp. carotovora,P.c.c.)引起的魔芋软腐病是魔芋生产上最严重的病害之一[3],在药剂及无菌苗都不能有效控制该病的情况下,生物防治成为研究热点。有研究[4]表明,众多芽孢杆菌(Bacillus)对魔芋软腐病菌均有良好的抑菌效果,但都难以在魔芋根际及体内定殖。鉴于植物内生细菌不仅能诱导和增强宿主植物对有害生物和环境胁迫的抗性[5–6],而且能在寄主植物体内大量定殖的优势,笔者针对前期筛选所获得的3株魔芋内生拮抗细菌,开展了内生拮抗细菌生防机理及生防应用等研究。现将结果报道如下。
1 材料与方法
1.1 材 料
供试魔芋内生细菌:M3 (Bacilus subtilis)、1–7 (Pantoea agglomerans)、M2 (Bacillus amyloliquefaciens)[7]。供试病原菌:水稻白叶枯病菌53、烟草青枯病菌QK、烟草野火病菌CX10、大白菜软腐病菌EW、马蹄莲软腐病菌WM2、水稻条斑病菌Ynb、红掌叶疫病菌XCD–S、三七根腐病菌SQGF–1、烟草黑胫病菌Phy–1、辣椒疫霉病菌LJYM–1、魔芋软腐病菌强致病力菌株 MY9及弱致病力菌株MY4、MY6。所有供试菌株均由云南农业大学国家工程中心细菌实验室提供。供试培养基参照文献[8]方法配制。
1.2 方 法
1.2.1 魔芋内生拮抗细菌抑菌效果测定及抗菌素基因检测
发酵液的获得及3株魔芋内生拮抗细菌对病原微生物的抗菌谱测定参照张丽辉[9]、熊国如等[10]的方法;内生拮抗细菌对3株不同致病力的魔芋软腐病菌(MY9、MY4、MY6)的拮抗测定参照张丽辉等[9]方法;内生细菌代谢产物粗体物的分离参照文献[11]方法;代谢产物粗提物对病原菌MY9拮抗效果测定参照文献[9]方法。阴性对照为乙酸乙酯。
3株魔芋内生细菌和魔芋软腐病菌 MY9营养利用情况参照文献[12]方法,记录各菌株对营养物质的利用情况,并计算营养相似系数(NOI)值[13]。
内生拮抗细菌抗菌素基因的检测:参照文献[13] 和[14]方法,合成4对引物,SF/SR(表面活性素合成必需基因srfA引物)、IF/IR(Iturin家族合成必需基因 ituB引物)、FF/FR(芬枯草菌素合成必需基因fenA引物)及SF/SR(抗菌蛋白基因tasA引物)。扩增体系及程序及克隆连接参照连玲丽[13]、许曼琳等[14]研究方法。将阳性克隆子送上海生工(Sangon)生物技术公司测定序列。序列比对分析主要由Blastn程序和DNAman软件完成。
1.2.2 内生拮抗细菌生防效果的测定
参照文献[9]和[12]方法,对3株拮抗细菌进行定殖能力测定。
1) 接种时间对防效的影响。处理1,将内生拮抗菌发酵液接种到表面消毒(75%乙醇)并打孔(直径6 mm)的魔芋薯块孔中,次日接种MY9;处理2,将拮抗菌发酵液和MY9同时接种到魔芋薯块孔中;处理3,将MY9接种到魔芋薯块孔中,次日再接种拮抗菌发酵液。对照组只接种MY9。拮抗菌与病原菌的接种浓度和接种量一致(3×108CFU/mL,60 μL),28 ℃培养24~72 h,观察软腐情况。
2) 接种量对防效的影响。选取成熟期、长势基本一致的健康植株,采用灌根法接种内生拮抗菌发酵液,接种量分别为3×108、1.5×106、0.6×106CFU,次日采用灌根法接种3×108CFU的MY9;对照组只接种MY9。接种2周后调查发病情况。
3) 施药方式对防效的影响。用100 mL 3×108CFU/mL的拮抗菌发酵液进行种球包衣;魔芋完全展叶后1周进行灌根处理,每株魔芋灌3×108CFU的拮抗菌发酵液;次日接种病原菌的方式及接种量同拮抗菌一致;对照组只接种MY9。接种2周后调查发病情况。
4) 内生拮抗菌对魔芋体内及根际微生物群落的影响。参照文献[16–17]方法,采用 DPS统计软件进行主成分分析。
2 结 果
2.1 魔芋内生拮抗菌及其代谢物的抑菌效果
魔芋内生细菌M3、M2、1–7对多种病原细菌及真菌都有拮抗作用,对欧文氏菌属病原细菌的拮抗作用尤为明显;对不同致病力的魔芋软腐病菌均可产生拮抗作用,3株拮抗菌对MY9的拮抗效果比对MY4和MY6更强, M3对3株魔芋软腐病菌拮抗效果均为最优(表1)。
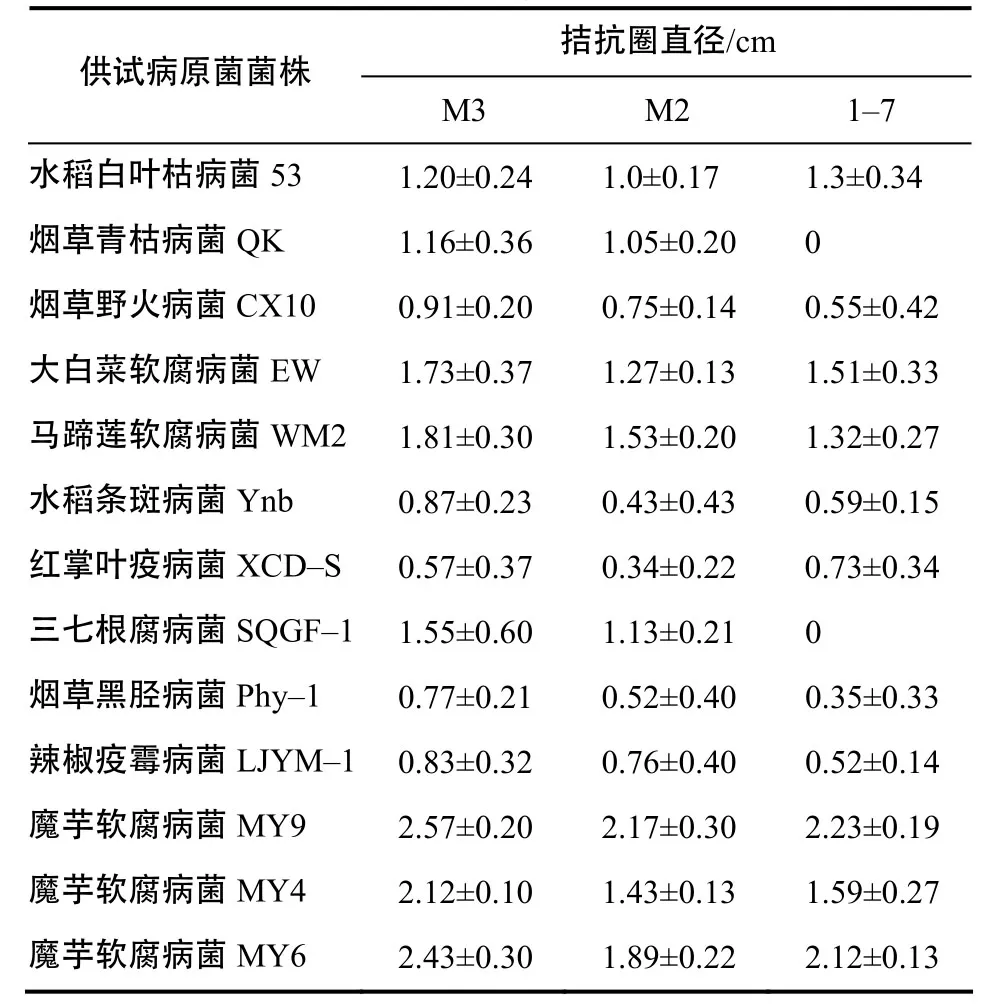
表1 魔芋内生拮抗细菌的抑菌效果Table 1 The antibiogram of endogenous bacteria of A. konjac
拮抗菌代谢产物粗提物抑菌试验结果显示,M3、M2、1–7发酵液对MY9的抑菌圈直径分别达2.97、1.97和1.43 cm;M3、M2的代谢产物粗提物对MY9有较强的抑制作用,抑菌圈直径分别达3.03 和1.67 cm;1–7的代谢产物粗提物对MY9无抑菌效果。
2.2 拮抗菌与软腐病菌的营养竞争
32种碳源测定结果显示,M3、M2、1–7与MY9营养相似系数 NOI值分别为 65.63%、53.13%和90.63%,存在营养物资竞争关系,其中4株菌都能利用的营养物质有糊精、N–乙酰–D–葡糖胺、L–阿拉伯糖、蔗糖、甲基丙酮酸、乙酸、甲酸、龙胆二糖、meso–肌醇、D–葡糖酸、D–甘露醇、D–阿洛酮糖、D–棉子糖、L–鼠李糖、葡糖–6–磷酸、甘油、L–天冬氨酸。
2.3 拮抗菌抗菌素基因的检测结果
拮抗菌抗菌素基因检测结果表明,1–7菌株含有表面活性素、伊枯草菌素和抗菌蛋白酶的编码基因;M3含有伊枯草菌素和表面活性素的编码基因;M2含有伊枯草菌素的编码基因;3株菌均无芬枯草菌素编码基因。
2.4 内生拮抗细菌的生防效果
2.4.1 拮抗细菌的定殖能力
3株魔芋内生拮抗菌在魔芋根际土及体内的定殖密度随时间变化呈现先增后减趋势,其中M3定殖能力最强。灌根11 d后,M3在1 g根际土的定殖量达最大值(8.2×107CFU);灌根15 d后,M3在1 g魔芋叶片内定殖量达到最大值(7.2×107CFU);灌根5 d后,可在魔芋体内检测到生防菌,表明分离的内生细菌成功进入魔芋体内(表2)。
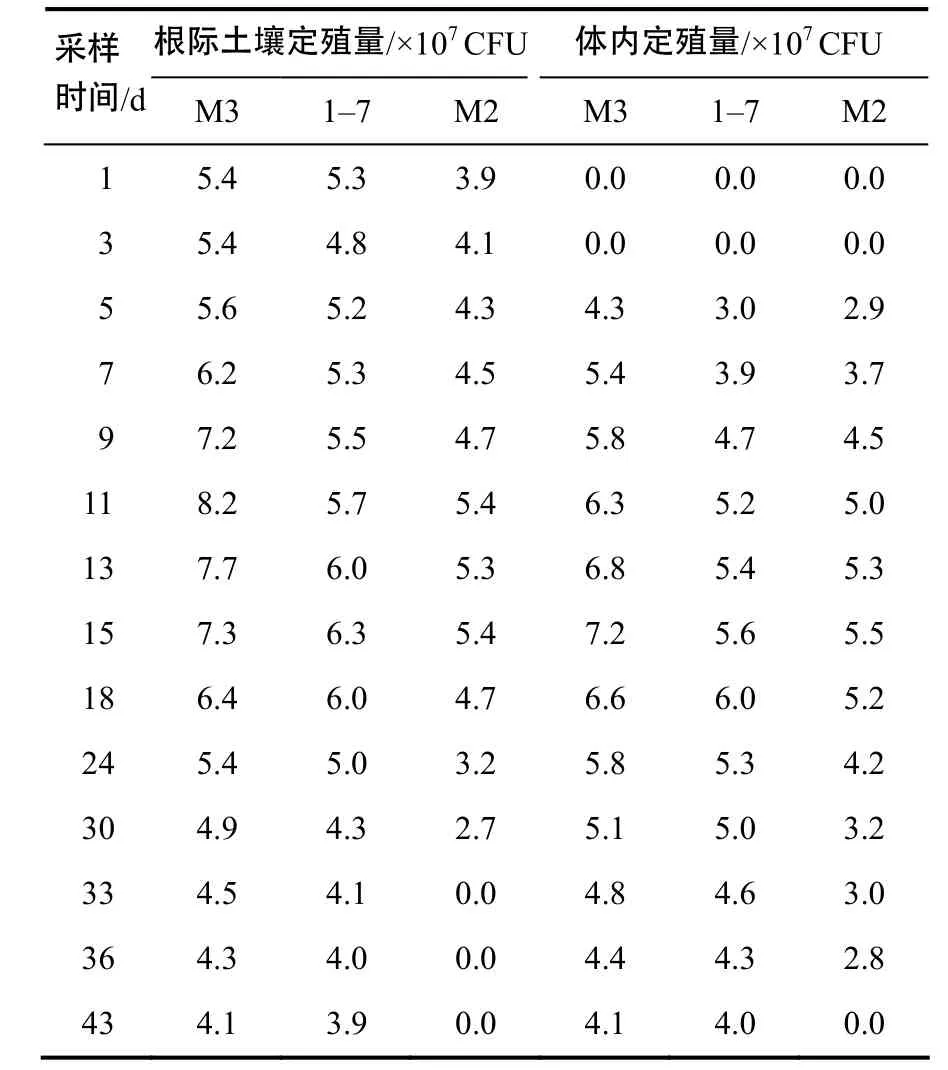
表2 不同采样时间3株拮抗菌在魔芋根际土壤和体内的定殖量Table 2 The colonized ability of three antagonistic bacteria in A. konjac an d its r hizosphere soil at d ifferent sam pling times
2.4.2 接种量和接种时间及施药方式对内生拮抗菌防效的影响
不同接种量对防效的影响差异显著,防效随接种量降低而降低(表3)。生防菌提前或者同时与MY9接种的处理,腐烂面积较对照明显减轻,生防效果更优(表4)。种球包衣的防治效果整体优于灌根处理(表5)。
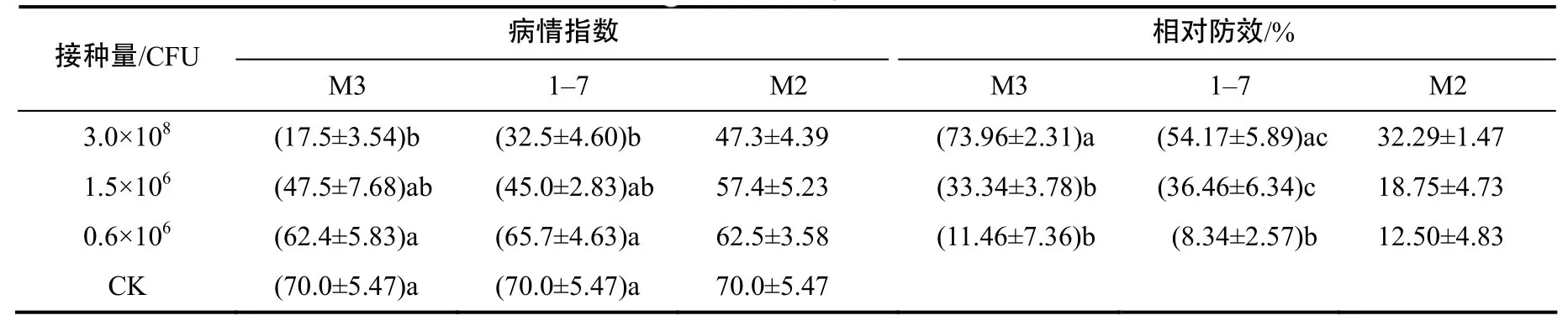
表3 不同接种量下3株拮抗细菌的病情指数及相对防效Table 3 The disease index and biocontrol efficacy of three antagonistic bacteria with different inoculated concentration
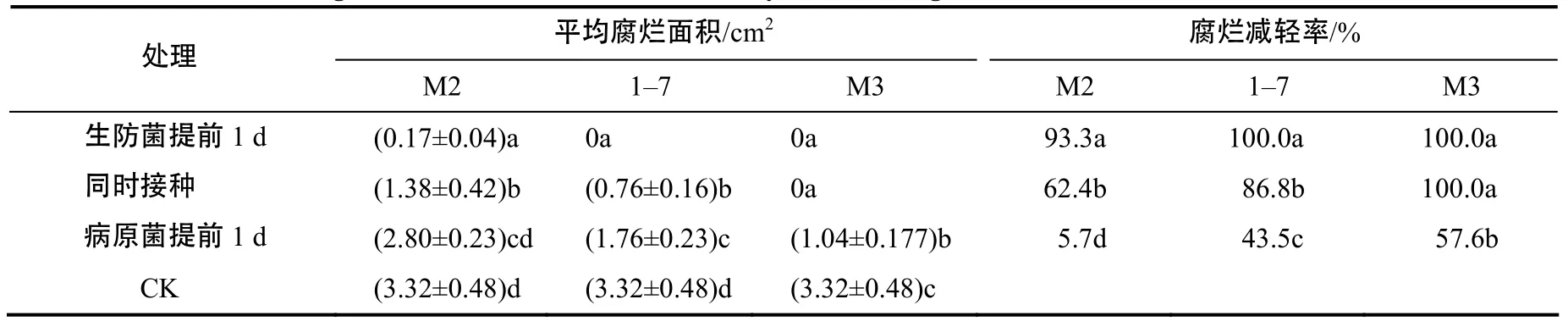
表4 3株拮抗细菌不同接种时间的平均腐烂面积及腐烂减轻率Table 4 The average rot area and reduce the rate of decay of three antagonistic bacteria with different inoculated time
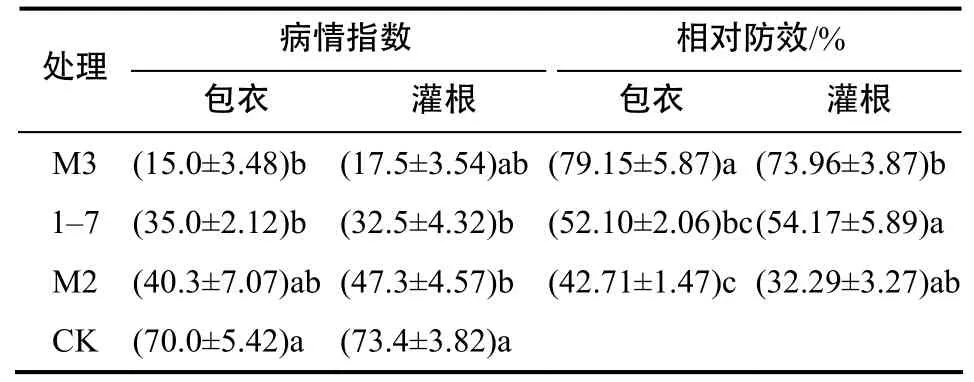
表5 3株拮抗细菌不同施药方式的病情指数和相对防效Table 5 The disease index and biocontrol of three antagonistic bacteria with different inoculated methods
2.4.3 拮抗菌对魔芋体内和根际微生物群落的影响
3株拮抗菌均可显著提高魔芋体内及根际微生物群落的碳源有效利用数量,其中拮抗菌M3、1–7提升碳源利用数量较M2更明显;拮抗菌处理对魔芋根际土壤微生物群落影响更为明显,M3、1–7、M2及对照组在魔芋体内利用碳源数量分别为25、24、19、17,在根际利用碳源数量分别为28、27、23、21。
以培养 96 h时的光密度为依据计算微生物利用碳源的功能多样性指数:3株菌处理后魔芋根际及体内微生物的Shannon多样性指数和 McLntosh指数均显著高于对照处理;Shannon均匀度显著低于对照(表6)。
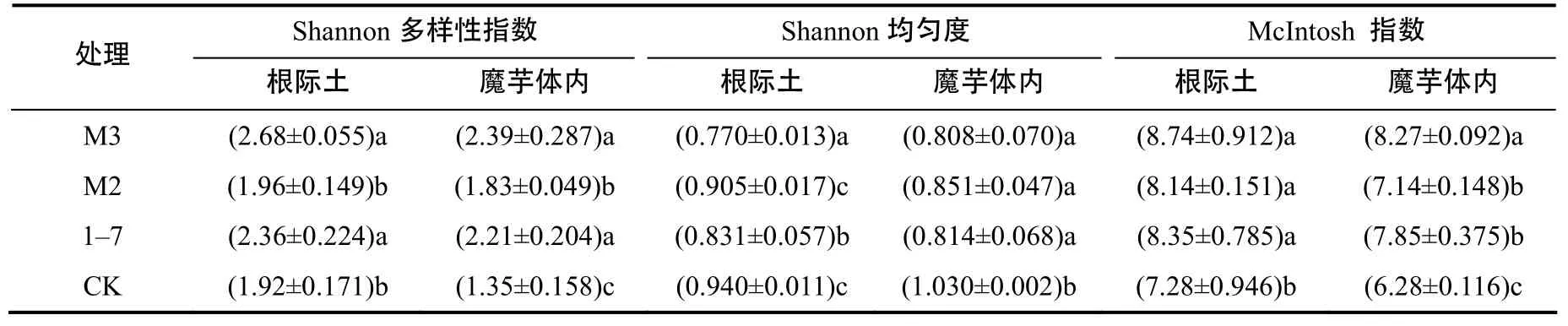
表6 魔芋体内和根际微生物群落多样性指数Table 6 Microorganism communities diversity in A. konjac and its rhizosphere soil
平均颜色变化率(AWCD)是反映土壤微生物活性的一个重要指标[17–19]。生防菌处理的魔芋体内及根际微生物群落AWCD值分别在48、72 h后急剧升高;M3处理的AWCD始终最大(表7)。以Biolog ECO生态板中培养96 h的数据进行主成分分析,提取2个主成分进行分析。魔芋根际土壤微生物群落累计贡献率高达77.88%,主成分PC1及PC2的方差贡献率分别为47.73%和30.15%。不同处理在PC轴上有明显分化,PC1轴上M3与M2处理分布于正方向上,1–7与对照处理则分布在负方向上;PC2轴上除M2处理外,其余处理均分布在正方向上,仅M2处理分布在负方向上。魔芋体内微生物群落累计贡献率达66.18%,主成分PC1及PC2个贡献率分别为43.16%,23.02%。不同处理在PC轴上有明显分化,PC1轴上除对照处理外,其余处理均分布在正方向上;PC2轴上除M3处理外,其余处理均分布在负方向上。综上所述,生防菌处理和对照处理分异大,且生防菌对魔芋体内和根际土壤微生物的影响不同,表现出微生物群落的不稳定性。对PC1和PC2具有较高利用率的碳源分析,各处理对 PC1贡献率较高的是糖类和代谢产物类物质,代谢产物类物质在PC1的权重较大,对PC2贡献率较大的碳源主要是糖类。
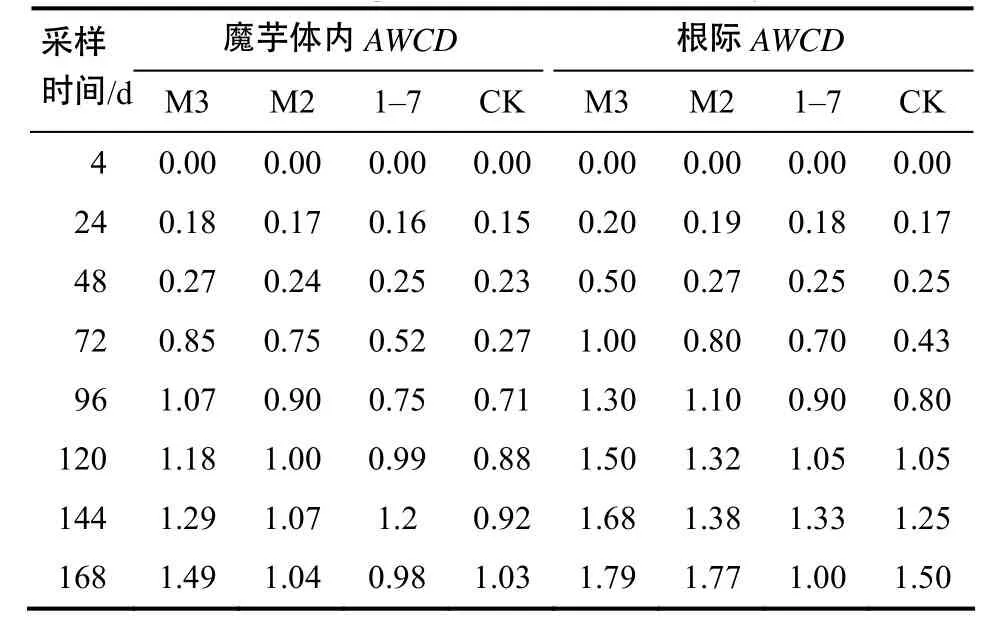
表7 不同采样时间魔芋体内及根际微生物群落AWCD值Ta ble 7 AWCD of the microorganism communities in A. konjac and its rhizosphere soil with different sampling time
[1] 刘佩英.魔芋学[M].北京:中国农业出版社,2004.
[2] Stephen A M,Cummings J H.Water-holding by dietary fibre in vitro and its relationship to faecal output in man[J].Gut,1979,20:722–729.
[3] 马琼.魔芋软腐病拮抗菌BJ–1的鉴定[J].安徽农业科学,2008,36(5):1936–1943.
[4] 刘琳,孙磊,张瑞英,等.春兰根中可分泌吲哚乙酸的内生细菌多样性[J].生物多样性,2010,18(2):182–187.
[5] Elbeltagy A,Nishioka K,Sato T,et al.Endophytic colonization and in planta nitrogen fixation by a Herbaspirillum sp.isolated from wild rice species[J]. Applied and Environmental Microbiology,2001,67(11):5285–5293.
[6] 韩冬梅,班慧芳,余子全,等.新型抑菌蛋白APr6抑制胡萝卜软腐欧文氏菌[J].微生物学报,2008,48(9): 1192–1197.
[7] 王永吉.魔芋软腐病菌血清学检测及其内生拮抗细菌研究[D].昆明:云南农业大学植物保护学院,2012.[8] 方中达.植病研究方法[M].北京:中国农业出版社,1998:179–180.
[9] 张丽辉,王永吉,廖林,等.生防菌06−4 对魔芋软腐病的防治及机理的初步研究[J].湖南农业大学学报:自然科学版,2011,37(3):286–289.
[10] 熊国如,赵更峰,范成明,等.生防菌株XF–1的鉴定和抑菌谱的测定[J].云南农业大学学报,2009,24(2):190–194.
[11] 魏兰芳,周丽洪,姬广海,等.Lysobacter antibioticus 13–1菌株抗菌物质鉴定及对水稻白叶枯病的防治效果[J].微生物学通报,2014,41(2):274−280.
[12] 周丽洪,王永吉,韩阳,等.丽格海棠细菌性叶斑病病原菌鉴定[J].西南师范大学学报:自然科学版,2012,37(12):56–61.
[13] 连玲丽.芽孢杆菌的生防菌株筛选及其抑病机理[D].福州:福建农林大学植物保护学院,2007.
[14] 许曼琳.芽孢杆菌(Bacillus sp.)的抑菌作用和抗菌蛋白基因TasA的克隆和表达[D].福州:福建农林大学植物保护学院,2005.
[15] 吴亚鹏,姬广海,陈云兰,等.生防细菌13−1对魔芋软腐病的控制及机理研究[J].中国生物防治,2010,26(2):193−196.
[16] 杨永华,姚建,华晓梅,等.农药污染对土壤微生物群落功能多样性的影响[J].微生物学杂志,2000,20(2):23–25.
[17] 谭兆赞,刘可星,廖宗文.土壤微生物BIOLOG分析中特征碳源的判别[J].华南农业大学学报,2006,27 (4):10–13.
[18] 米亮,隋跃宇,张兴义,等.施肥对模拟侵蚀黑土土壤微生物群落代谢活性的影响[J].农业系统科学与综合研究,2010,26(1):97–101.
[19] 姬广海,吴亚鹏,白学慧,等.抗生素溶杆菌对魔芋软腐病和根际微生物多样性的影响[J].江西农业大学学报,2009,31(3):499–503.
责任编辑:罗慧敏
英文编辑:罗 维
Mechanism of biocontrol of Amorphophallus konjac endophytic bacteria
ZHOU Li-honga, JI Guang-haia*, WANG Yong-jia, LI Miaoa, YANG Juna, WEI Lan-fangb*
(a.College of Plant Protection; b.Agricultural-Based Experimental Center, Yunnan Agricultural University, Kunming 650201, China)
The mechanism of biocontrol of plant pathogens by antagonistic bacteria (M3, 1–7 and M2) endogenous in Amorphophallus konjac(A. konjac) was investigated. The results showed that the three strains inhibited a wide range of plant pathogens. The strains and their crude metabolites showed antagonistic effects to Pectobacterium carotovora sub sp.carotovora (Pcc) with different virulence. Three antagonistic bacteria contain different antibiotic genes and have high similarity in nutritional factors with Pcc. Three strains have a long-term colonization in the rhizosphere and in vivo A. konjac with a large number, among which M3 showed the strongest colonizing ability. Inoculation time, inoculum size and method showed a great influence on biocontrol effect which was positively correlated with inoculum size. Inoculation of the antagonistic bacteria 1 day before pathogen inoculation showed the best biocontrol effect. The control efficacy of coating was better than the effect of root watering and the control efficacy of M3 inoculated through coating reached 79.15%. After applying the antagonistic bacteria, utilization of substrate metabolism carbon source and metabolic activity of microbial communities in A. konjac and its rhizosphere soil improved significantly.
Amorphophallus konjac; Pectobacterium carotovora subsp.carotovora; endophytic bacteria; mechanism of biocontrol
Q 949.71+7.2;Q939.1
A
1007−1032(2014)03−0262−05
10.13331/j.cnki.jhau.2014.03.008
投稿网址:http://www.hunau.net/qks
2013–11–10
农业部公益性行业专项(201303015);国家自然科学基金项目(31360002); 云南省博士研究生学术新人奖基金项目
周丽洪(1987—),女,四川自贡人,博士研究生,主要从事植物细菌病害研究,zhuzhu.15983446361@aliyun.com;*通信作者,1121942876@qq.com;jghai001@aliyun.com

