水分胁迫对温州蜜柑果实品质及柠檬酸代谢相关基因表达的影响
肖玉明,卢晓鹏,黄成能,熊江,李静,谢深喜*
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.国家柑橘改良中心长沙分中心,湖南 长沙 410128)
水分胁迫对温州蜜柑果实品质及柠檬酸代谢相关基因表达的影响
肖玉明1,2,卢晓鹏1,2,黄成能1,2,熊江1,2,李静1,2,谢深喜1,2*
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.国家柑橘改良中心长沙分中心,湖南 长沙 410128)
以5年生盆栽枳砧‘山下红’温州蜜柑为试材,于2012年7月5日至11月15日进行控水试验,以正常浇水为对照,研究40%土壤水分胁迫处理对温州蜜柑果实品质及柠檬酸代谢过程中3个相关酶基因表达的影响。结果表明:处理组成熟果实单果重、果皮重、横径与纵径分别比对照组减小了59.0%、61.7%、25.2%和21.7%,与对照组间的差异均达极显著水平;处理组果实中果汁与维生素C含量减少,而可溶性固形物含量增加;处理组果肉中的蔗糖、葡萄糖、果糖与总糖含量较对照分别增加了33.3%、72.3%、65.0%和48.9%,而单果蔗糖、葡萄糖、果糖与总糖含量分别减少了42.1%、25.1%、28.3%和37.8%;处理组果肉中的柠檬酸和总有机酸含量分别比对照组高66.3%和60.4%,单果柠檬酸和有机酸含量比对照组高11.3%和50.6%,与对照间的差异均达极显著水平;基因表达结果显示,在水分胁迫下,CitCS的表达量增加,而CitIDH的表达量减少,CitACO表达量在果实发育后期有一定的增加。总体而言,水分胁迫明显抑制了温州蜜柑果实生长,单果柠檬酸含量增加,而糖分含量减少,糖酸比下降,果实品质下降。CitCS表达量增加及CitACO表达量下降可能是柠檬酸积累的原因之一。
柑橘;水分胁迫;果实;品质;柠檬酸;基因表达量
柑橘果实在生长发育过程中需水量大,而中国南方的柑橘多种植在丘岗山地,其立地与灌溉条件较差,加之果实膨大的关键时期经常遭遇夏秋季节性干旱,所以,柑橘旱害问题十分突出。干旱极易对柑橘产量和品质产生不可逆的不良影响[1–4]。目前,关于柑橘水分胁迫的研究多停留在柑橘的形态特征、生理生化及粗略品质变化方面[5–8],关于其果实中糖和有机酸变化的研究尚少。有机酸作为植物体内广泛存在的一类生物小分子,可以为植物细胞提供质子,从而启动很多代谢反应,与植物逆境生理密切相关[9]。柠檬酸和苹果酸是植物体内关键的代谢物,参与C4循环等众多代谢途径,可以显著提高植物体的耐酸性和对铝毒的抗性[10]。多数柑橘果实为柠檬酸积累型[11–12]。笔者对果实发育成熟阶段的温州蜜柑进行水分胁迫,研究其果实品质及柠檬酸代谢相关基因表达的变化,以期为应对干旱措施的制定提供参考。
1 材料与方法
1.1 材 料
5年生枳砧‘山下红’温州蜜柑盆栽于湖南农业大学国家柑橘改良中心长沙分中心温室大棚内。盆栽土壤为中心实验室统一配用的基质,由草碳、锯木屑及细河沙按照一定比例混匀而成。
1.2 试验设计
试验于2012年3—12月在国家柑橘改良中心长沙分中心实验室完成。由于长期处于土壤最大持水量20%的温州蜜柑果实无法生长发育,而60%水分胁迫的效果不明显,因此,以土壤最大持水量40%含水量为水分胁迫处理,以正常浇水(含水量大于土壤最大持水量60%)处理为对照。所有材料从3月开始统一进行管理,待生理落果完成后,选取生长势基本一致的橘树, 于7月5日开始水分胁迫处理。处理当天浇透水,之后每天测定土壤水分含量,当土壤水分含量下降至40%后的2周内继续保持每天测定水分含量并适当补水,之后改为每1周测1次水分含量,得出土壤水分含量维持在40%左右的操作规律:高温夏秋季每2 d每盆补水约250 mL,低温秋冬季每5 d每盆补水约250 mL;对照组根据大棚气候条件每隔3~5 d浇透水1次。每个处理10株材料,3次重复。分别于处理后10、40、70、100、130 d采样。每次采集果实10个,其中6个置于–40 ℃保存,用于测定果实品质;4个经液氮速冻后置于–80 ℃保存,用于柠檬酸代谢相关基因表达量分析。
1.3 主要仪器设备与试剂
主要仪器设备有TDR 300 Soil Moisture Meter水分测定仪、ATAGO袖珍数字式白利度折光仪、pH测定仪、岛津LC–20AT高效液相色谱仪、CFX96 Real–Time PCR Detection System定量PCR仪等。
TransZol Plant试剂盒购自TransGen Biotech公司;DNaseⅠ和逆转录试剂盒分别购自TAKARA和Bio–Rad公司。
主要试剂有果糖、葡萄糖、蔗糖、柠檬酸、苹果酸、奎宁酸与抗坏血酸标样、色谱纯甲醇与乙腈、异丙醇、DEPC水、氯仿、乙醇等。
1.4 测定指标与方法
1.4.1 果实品质指标测定
1) 果实质量、大小、可食率及果汁含量的测定指标包括单果重、果皮重、果实横径、纵径、果皮厚度以及果汁体积,并计算出果实纵横径比和可食率。
2) 用ATAGO袖珍数字式白利度折光仪测定可溶性固形物含量;参照文献[13],采用碘量法测定维生素C含量。
3) 果肉主要糖酸含量HPLC分析。采用超纯水浸提法提取样品,设3次重复。每个处理选取5个新鲜果实,剥去果皮后用搅碎机捣匀粉碎,然后称取3 g,用15 mL超纯水洗涤数次后转至50 mL有盖试管中,70 ℃水浴30 min,充分摇匀后再水浴15 min,待冷却后过滤至25 mL容量瓶中,残渣用超纯水洗涤数次,滤液一并滤入容量瓶,定容后4 ℃短时间保存,用于测定果糖、葡萄糖、蔗糖和柠檬酸、苹果酸、奎宁酸的含量。①糖分含量测定条件:用示差检测器测定,氨基柱(4.6 mm×250 mm,5 μm,岛津公司产)、柱温35 ℃、流动相(乙腈、超纯水体积比为 0.75∶0.25)、总流速 1 mL/min,测定时间20 min,进样量20 μL。②有机酸含量测定条件:用紫外检测器测定,检测波长 210 nm、C18柱(4.6 mm×250 mm,5 μm,岛津公司产)、柱温17 ℃、流动相(甲醇、0.06 mol/L磷酸二氢钾缓冲液体积比为0.024∶0.576,缓冲液用磷酸调pH至2.5左右),总流速0.6 mL/min,测定时间20 min,进样量8 μL。
1.4.2 基因表达分析
1) RNA的提取与逆转录。果肉总RNA的提取采用TransZol Plant试剂盒法。逆转录采用两步法:先将RNA用DNaseⅠ进行纯化,再用iScript cDNA Synthesis Kit试剂盒进行逆转录。
2) 荧光定量PCR。基因表达采用相对荧光定量PCR进行分析。选取与柠檬酸代谢密切相关的CitIDH (isocitrate dehydrogenase 1)、CitCS(citrate synthase 2) 和CitACO(3–isopropylmalate dehydratase protein) 3个酶基因[14](括号内名称代表该基因相应的酶),以Actin基因为内参,基因序列通过已公布的克里曼丁橘单倍体基因组查得。引物设计采用Primer Express 3.0软件,由上海生工生物工程技术服务有限公司合成,相对定量PCR引物序列见表1。

表1 相对定量PCR引物序列Table 1 Primer sequences and length of real-time quantitative PCR
反应体系10 μL,包括ddH2O 3.6 μL,上游引物0.4 μL,下游引物0.4 μL,25 ng/μL模板0.6 μL,2×SuperMix酶5 μL(购自Bio–Rad公司)。
反应程序:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火10 s;72 ℃延伸15 s;40个循环;50 ℃保温1 min;95 ℃保温1 min。绘制引物溶解曲线。
1.5 数据统计与分析
分别采用Excel 2003和SPSS 19.0对数据进行统计分析。采用SPSS 19.0软件的Pearson,分别对温州蜜柑果实中CitCS, CitACO及CitIDH的相对表达量与果肉柠檬酸含量和单果柠檬酸含量进行相关性分析。
2 结果与分析
2.1 水分胁迫对果实品质的影响
2.1.1 对果实大小、果皮厚度、可食率与纵横径比的影响
由表2可见,水分胁迫条件下,柑橘单果重在处理100 d时显著低于对照,处理70、130 d时极显著低于对照;皮重在处理100 d时显著低于对照,在130 d时极显著低于对照;果实横径在处理40、70、100 d时显著低于对照,130 d时极显著低于对照;纵径在处理70 d时显著低于对照,100、130 d时极显著低于对照;可食率在处理后10 d和130 d与对照间的差异均无统计学意义;纵横径比在处理70 d时显著低于对照;果皮厚度在处理10 d时显著低于对照。总体而言,处理130 d时(果实成熟时),处理组果实单果重、皮重、横径以及纵径分别比对照减少了59.0%、61.7%、25.2%和21.7%,而果皮厚度、可食率以及纵横径比与对照间的差异无统计学意义,说明温州蜜柑果实在40%土壤水分胁迫条件下能够生长发育,但生长发育受到了明显抑制,成熟果实单果重、皮重均显著低于对照,横径及纵径均小于对照,果实较对照小且轻。
2.1.2 对果实果汁、可溶性固形物与维生素 C含量的影响
由表2可见,水分胁迫条件下,柑橘果实维生素C含量在处理100 d时极显著高于对照,在处理130 d时极显著低于对照,70 d时与对照间的差异无统计学意义;果肉中的果汁含量在处理70、100、130 d时均较对照低,130 d时仅为对照组的83.0%;果实可溶性固形物含量在处理70、100、130 d时都比对照高,130 d时比对照高4.5%。综合分析可知,40%水分胁迫条件下,温州蜜柑果实中的果汁与维生素C能够正常积累,但含量较对照有一定程度减少;可溶性固形物含量随果实的成熟而升高,且含量比对照的高。

表2 不同处理时间柑橘果实的大小、鲜重、果皮厚度、可食率、纵横径比、果汁体积、可溶性固形物及维生素C含量Table 2 Fruit weight, size, peel thickness, flesh recovery, ratio of longitudinal diameter to transverse diameter (LD/TD), juice recovery, soluble solids and ascorbic acid content of citrus fruit in different treatment times
2.1.3 对果实糖含量的影响
2.1.3.1 对果肉中糖含量的影响
由表3可见,水分胁迫处理下,柑橘果实果肉中的果糖、葡萄糖与总糖含量在处理10、40、100、130 d时极显著高于对照;果肉中的蔗糖含量在处理 40、100、130 d时极显著高于对照,而在处理70 d时果肉中的3种糖及总糖含量与对照的差异均无统计学意义。总体而言,130 d时处理组果实果肉中的蔗糖、葡萄糖、果糖与总糖含量分别比对照增加了33.3%、72.3%、65.0%和48.9%,表明40%水分胁迫条件下温州蜜柑果实中蔗糖、葡萄糖和果糖能够正常积累,总糖含量升高,且果肉中的各糖分和总糖含量均明显高于对照果实。
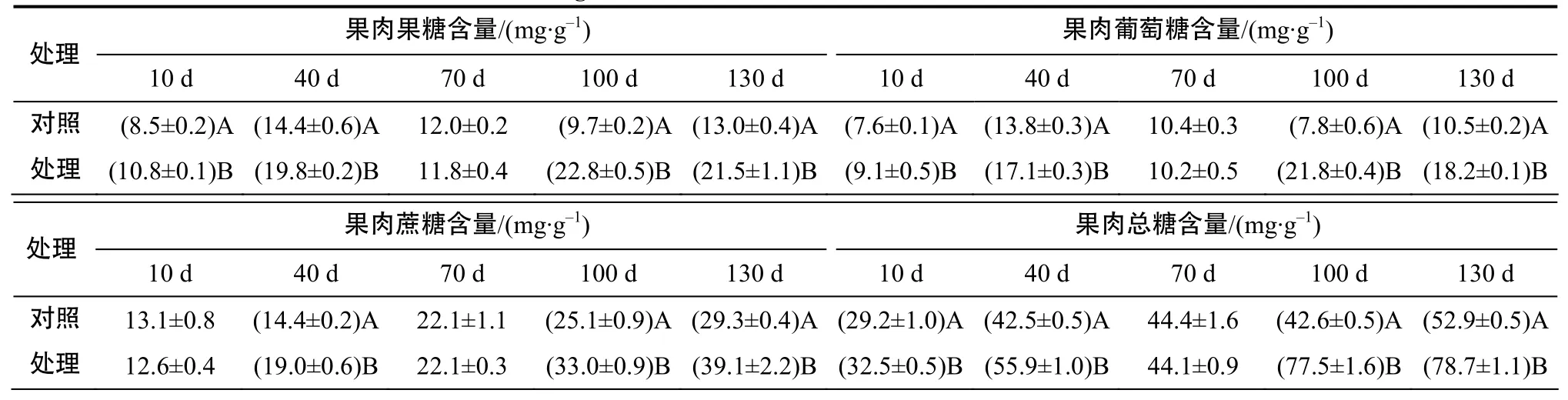
表3 不同处理时间柑橘果实的糖含量Table 3 Sugar content of citrus fruit in different treatment times
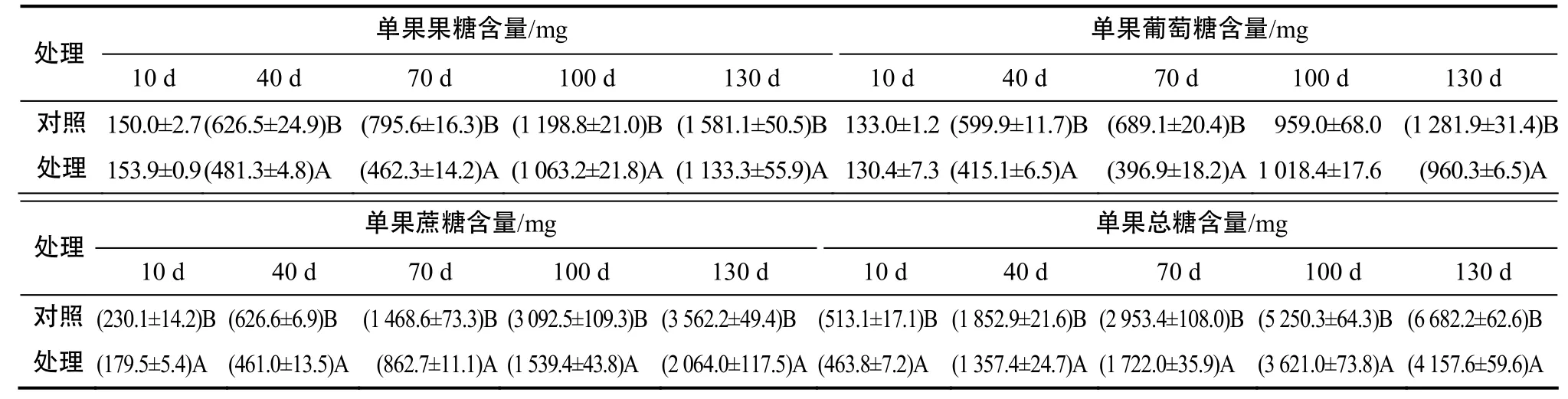
续 表
2.1.3.2 对单果糖含量的影响
由表3可见,水分胁迫条件下,柑橘果实中的单果果糖含量在处理40、70、100、130 d时极显著低于对照;单果葡萄糖含量在处理 40、70、130 d时极显著低于对照;单果蔗糖含量与单果总糖含量在处理后10 、40、70、100、130 d时均极显著低于对照;130 d时处理组果实的单果蔗糖、葡萄糖、果糖与总糖含量分别较对照减少了42.1%、25.1%、28.3%和37.8%。综合分析可知,40%水分胁迫条件下,温州蜜柑果实果肉中的蔗糖、葡萄糖、果糖和总糖含量的变化趋势与对照的变化趋势一致,且含量随果实的发育成熟而逐渐升高,但由于水分胁迫导致果实较对照小且轻,其果实的单果糖分含量显著低于对照,表明水分胁迫下温州蜜柑果实的果肉糖含量增加是由果实较对照小引起的。
(3)对向美国或其他外国市场出口的产品实行补贴(或有补贴效果的措施),从而实质性影响了美国有竞争力的产品在美国市场或其他外国市场的销售。
2.1.4 对柑橘果实有机酸含量的影响
2.1.4.1 对果肉有机酸含量的影响
表4结果表明,水分胁迫条件下,柑橘果实果肉中的总有机酸与柠檬酸含量在处理后 10 、40、70、100、130 d时均极显著高于对照;果肉苹果酸含量在处理40、70 d时极显著高于对照;果肉奎宁酸含量在处理40、70 d时极显著高于对照,而在处理10、100 d时极显著低于对照;130 d时,处理组果实的果肉总有机酸和柠檬酸含量分别比对照高66.3%和60.4%。综合分析可知,40%水分胁迫条件下,温州蜜柑果实的果肉柠檬酸与总有机酸含量随果实发育成熟有一定程度的下降,但下降幅度明显小于对照果实,说明 40%水分胁迫导致了果实柠檬酸积累,总有机酸含量增加,而苹果酸与奎宁酸仅在果实发育前期,即处理40、70 d时比对照高。
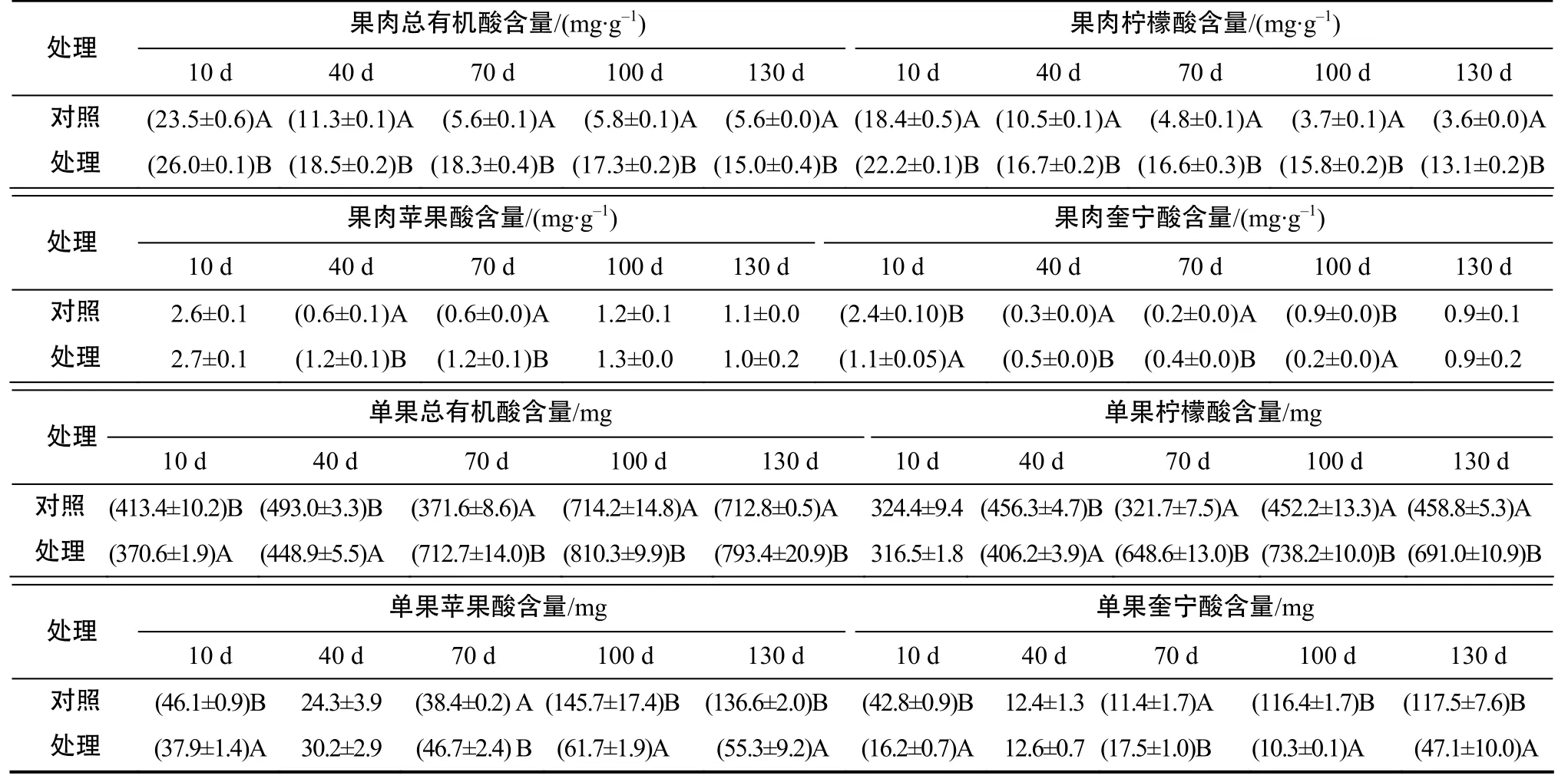
表4 不同处理时间柑橘果实的有机酸含量Table 4 Organic acids content of citrus fruit in different treatment times
2.1.4.2 对单果有机酸含量的影响
表4结果表明,水分胁迫条件下,柑橘果实的单果总有机酸含量在处理70、100、130 d时极显著高于对照,而在处理10、40 d时极显著低于对照;单果柠檬酸含量在处理70、100、130 d时极显著高于对照,在40 d时极显著低于对照;单果苹果酸与奎宁酸总含量在处理10、100、130 d时极显著低于对照,在处理70 d时极显著高于对照;在处理130 d时,处理组果实的单果有机酸与柠檬酸含量分别较对照提高了11.3%和50.6%。综合分析可知,40%水分胁迫虽然导致温州蜜柑果实较对照小且轻,但其成熟果实整个果肉中的总有机酸与柠檬酸含量极显著高于对照。从单果含量来看,40%水分胁迫同样导致了果实柠檬酸积累,总有机酸含量增加,但单果苹果酸与奎宁酸含量较对照低,表明40%水分胁迫下温州蜜柑果实果肉中的柠檬酸与总有机酸含量较对照高不是由果实较对照小导致的。
2.2.1 对果实CitCS表达量的影响
图1结果表明,处理组柑橘果实CitCS相对表达量在处理10、70、100 d时比对照高,分别为对照组的3.49、2.01和1.94倍;处理130 d时,对照组检测不到CitCS相对表达量,处理组表达量达到最大值11.27;在处理40 d时,CitCS相对表达量较对照低,为对照组的0.62倍,表明40%水分胁迫条件下温州蜜柑果实CitCS的相对表达量在处理40 d内能够恢复,超过40 d时表达量将持续升高。

图1 不同处理时间CitCS的相对表达量Fig.1 Gene expressions of CitCS in citrus fruit at dif ferent treatment times
2.2.2 对果实CitACO表达量的影响
由图2可知,处理组果实CitACO相对表达量在处理10、100、130 d时比对照高,分别为对照组的2.18、2.28、1.84倍,而在处理70 d时较对照低,为对照组的0.67倍;在处理40 d时,处理组与对照组的 CitACO表达量比较接近,分别为 0.90和0.87,表明 40%水分胁迫条件下温州蜜柑果实CitACO的相对表达量在处理70 d内能够恢复,超过70 d时表达量将处于高水平。
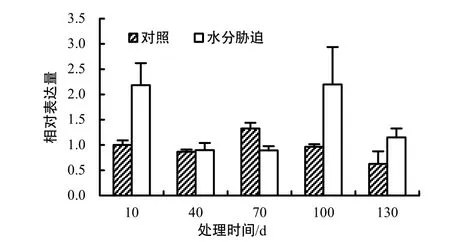
图2 不同处理时间CitACO的相对表达量Fig.2 Gene expressions of CitACO in citrus fruit at different treatment times
2.2.3 对果实CitIDH表达量的影响
图3结果显示,处理组柑橘果实的CitIDH相对表达量在处理40、70、130 d时比对照低,分别为对照组的0.86、0.49和0.58倍;在处理10 d时较对照高,为对照组的2.21倍;处理100 d时,处理组与对照组的 CitIDH表达量比较接近,分别为2.57和2.64,表明持续水分胁迫导致温州蜜柑果实CitIDH表达量在果实发育40 d后低于或接近对照。总体而言,CitIDH的表达量较对照的低。
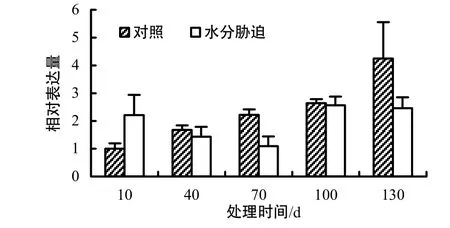
图3 不同处理时间CitIDH的相对表达量Fig.3 Gene expressions of CitIDH in citrus fruit at different treatment times
2.2.4 CitCS, CitACO及CitIDH相对表达量与果实柠檬酸含量的相关性
由表5可见,在对照组果实中,CitIDH相对表达量与果肉柠檬酸含量存在显著负相关,二者的相关系数为–0.8;CitACO相对表达量与单果柠檬酸含量的相关系数为–0.77,二者存在负相关。
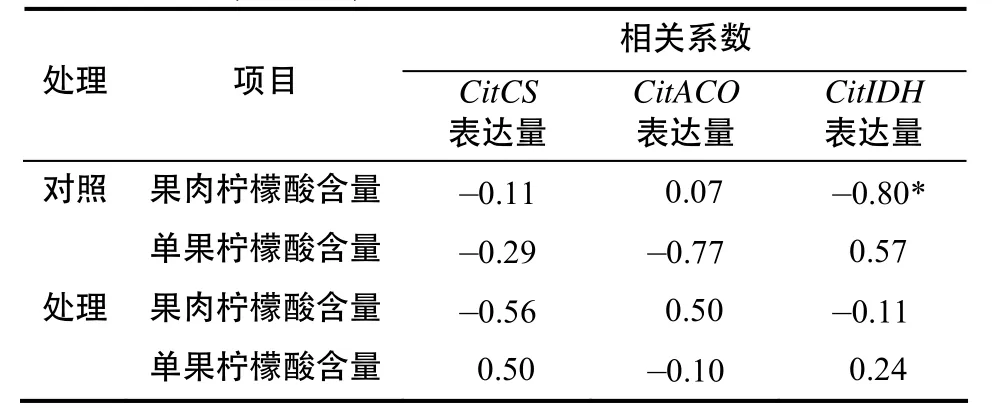
表5 CitCS, CitACO及CitIDH的相对表达量与果实柠檬酸含量的相关系数Table 5 Correlation co efficient between relative g ene ex pressions of CitCS, CitACO, CitIDH and citric acid content in citrus fruit
3 结论与讨论
水分胁迫影响柑橘果实品质,主要表现为可溶性固型物和有机酸含量上升[15]。本研究中,与对照相比,水分胁迫处理下柑橘果实生长受到明显的抑制,果实的单果重、皮重、横径以及纵径减小,果汁体积减小,维生素C含量减少,果实有机酸含量明显增加,可溶性固型物含量增加。这与邓胜兴等[14]的研究结果类似。
水分胁迫导致柠檬酸积累而糖减少,是果实品质下降的一个主要原因。水分胁迫下,果肉柠檬酸含量与单果柠檬酸含量均明显升高,而果肉中的蔗糖、葡萄糖以及果糖含量虽有所增加,但其单果含量显著减少,表明果肉糖含量增加是由水分胁迫抑制果实膨大引起的,水分胁迫导致单果糖含量的显著减少和柠檬酸的明显积累。柠檬酸含量在果实成熟后期会明显下降。本研究中柠檬酸含量的降低实际上只体现在果肉含量上,单果含量并未减少。这表明后期柠檬酸含量下降是由果实体积和重量增大后水分大量进入导致的。
本研究中CitCS的相对表达量随胁迫时间的延长而升高,且与单果柠檬酸含量的变化趋势一致;CitIDH的相对表达量变化恰好相反,随胁迫时间的延长而降低。CitCS表达量较对照高和CitIDH表达量较对照低可能是水分胁迫条件下果实柠檬酸积累的原因之一。
[1] 周亚洲,徐兆林,周利,等.湖南柑橘灌溉现状及节水栽培技术研究[J].湖南农业科学,2010(19):46–48.
[2] Anyia A O,Herzog H. Water-use efficiency, leaf area and leaf gas exchange of cowpeas under mid-season drought [J]. European Journal of Agronomy, 2004, 20:327–339.
[3] 谢深喜,张秋明,熊兴耀,等.水分胁迫对柑橘叶片和根系细胞超微结构的影响[J].湖南农业大学学报:自然科学版,2008,34(2):168–172.
[4] 谢深喜,刘强,熊兴耀,等.水分胁迫对柑橘光合特性的影响[J].湖南农业大学学报:自然科学版,2010,36(6):653 –657.
[5] 谢深喜,刘强,熊兴耀,等.水分胁迫对枳壳和枳橙光合作用及细胞超微结构的影响[J].江西农业大学学报,2011,33(2):234–238.
[6] 郑豪.水分胁迫下柑橘SOD,CAT及抗旱相关基因的研究[D].长沙:湖南农业大学园艺园林学院,2007.
[7] 聂 琼,卢晓鹏,赵晓莉,等.水分胁迫下纽荷尔脐橙和山下红温州蜜柑脱落酸合成及关键酶基因表达研究[J].果树学报,2013,30(3):348–353.
[8] 赵晓莉,卢晓鹏,聂琼,等.水分胁迫对柑橘生理指标及JA合成相关酶基因表达的影响[J].江西农业大学学报,2013,35(3):530–535.
[9] 陈暄,周家乐,唐晓清,等.水分胁迫条件下不同栽培居群菘蓝中4种有机酸的变化[J].中国中药杂志,2009,34(24):3195–3198.
[10] 王晓云,毕玉芬.植物苹果酸脱氢酶研究进展[J].生物技术通报,2006(4):44–47,50.
[11] Yamaki Y T. Organic acid in the juice of citrus fruits[J]. Journal of Japan Horticultural Science Society, 1989, 58(3):587–594.
[12] 库尔班江,赛丽曼.碘量法测水果蔬菜中维生素 C 的含量[J].伊犁师范学院学报,2007,9(3):28–32.
[13] Worawaran Roongruangsri, Nithiya Rattanapanone, Noppol Leksawasdi, et al. Changes in organic acid contents and related metabolic enzyme activities at different stages of growth of two tangerine cultivars[J]. Journal of Agricultural Science, 2012, 4(1):276–284.
[14] 邓胜兴.非充分灌溉条件下柑橘的抗性生理研究[D].重庆:西南大学,2009.
[15] 罗安才,杨晓红,邓英毅,等.柑橘果实发育过程中有机酸含量及相关代谢酶活性的变化[J].中国农业科学,2003,36(8):941–944.
责任编辑:王赛群
英文编辑:王 库
Effects of water stress on the fruit quality of citrate and the expression of genes related to metabolism of citric acid
XIAO Yu-ming1,2, LU Xiao-peng1,2, HUANG Cheng-neng1,2, XIONG Jiang1,2, LI Jing1,2, XIE Shen-xi1,2*
(1.College of Horticulture and Landscape, Hunan Agricultural University, Changsha 410128, China; 2.National Center of Citrus Improvement, Hunan Changsha Subcenter, Changsha 410128, China)
The influence of water stress on fruit quality and gene expression related to citrate metabolism of citrus were conducted from July 5 to November 15 in 2012 using five-year-old satsuma mandarin trees with 40% soil water conditions by taken regular watering as control. The results showed that water stress significantly decreased single fruit weight, peel weight, fruit transverse and longitudinal diameter of citrus by 59.0%, 61.7%, 25.2% and 21.7% compared to the control, respectively. Water stress brought about the decrease of ascorbic acid and juice content in fruit, however, soluble solids was promoted. Furthermore, it was found that the content of sucrose, glucose, fructose and total sugar per gram sarcocarp in water stress were raised obviously by 33.3%, 72.3%, 65.0% and 48.9% respectively, the content of them in single fruit, while, were obviously declined by 42.1%, 25.1%, 28.3% and 37.8% respectively. The content of total organic acids and citric acid per gram sarcocarp were extremely increased by 66.3% and 60.4% respectively compared to those in the control. So did the content of citric acid and total organic acids per gram sarcocarp which were very significantly increased by 11.3% and 50.6% respectively. Related gene expression results indicated that the expression level of CitCS was increased while CitIDH degreased in water stress. CitACO was increased at the late stage of fruit growth. In general, water stress could obviously suppress the growth of satsuma mandarin and significantly caused theaccumulation of citric acid as well as lead to the decrease of sugar content in fruit, which resulted in the decline of the ratio of sugar to acid and fruit quality. The up-regulation of CitCS and down-regulation of CitIDH might be one of the reasons that promoted to the accumulation of citric acid.
citrus; water stress; fruit; quality; citric acid; gene expression
S666.01
A
1007−1032(2014)03−0281−07
10.13331/j.cnki.jhau.2014.03.012
投稿网址:http://www.hunau.net/qks
2014–03–07
国家现代农业(柑橘)产业体系项目(CARS);国家自然科学基金(31071763);湖南省科技计划项目(2014NK3003)
肖玉明(1989—),男,湖南衡阳县人,硕士,主要从事果树栽培生理生态与品质调控研究;*通信作者,shenxixie@163.com

