胰腺早期发育及终末分化细胞重编程为胰岛β细胞的研究进展
曹明君, 董焕生, 潘庆杰, 王红军, 董晓
1. 青岛农业大学动物科技学院, 青岛 266109;
2. 美国南卡莱罗那医学院, 美国查尔斯顿 29425;
3. 青岛农业大学生命科学学院, 青岛 266109
胰腺早期发育及终末分化细胞重编程为胰岛β细胞的研究进展
曹明君1, 董焕生2, 潘庆杰1, 王红军1, 董晓3
1. 青岛农业大学动物科技学院, 青岛 266109;
2. 美国南卡莱罗那医学院, 美国查尔斯顿 29425;
3. 青岛农业大学生命科学学院, 青岛 266109
1型糖尿病是一种由于自体免疫细胞破坏分泌胰岛素的β细胞而引起胰岛素绝对缺乏的自体免疫病。疾病患者需要依靠外源性途径来补给胰岛素, 但胰岛素注射治疗不能根治病症, 也不能有效地预防糖尿病并发症。多能性干细胞以及体细胞重编程产生胰岛素分泌细胞为根治1型糖尿病提供了可能。编程性的细胞能被用来进行移植治疗和药物筛选, 为1型糖尿病的治疗带来了新的希望。当前, 通过相关转录调节因子重编程终末分化细胞为胰岛β细胞已经取得了很大进展。文章对胰腺早期发育、胰腺相关转录调控因子及目前利用终末分化细胞重编程产生胰岛β细胞的研究内容进行了综述。
糖尿病; 胰岛β细胞; 胰腺相关转录因子; 重编程
1型糖尿病患者由于自身免疫反应, 造成体内胰岛β细胞严重破坏和功能衰竭, 导致胰岛素分泌绝对缺乏, 需长期使用胰岛素治疗, 但易出现低血糖等不良反应。目前认为胰岛细胞移植是治疗 1型糖尿病最有效的方法之一, 然而, 由于存在免疫排斥及供体不足等问题, 移植胰岛细胞方法一直未能广泛应用于临床。为了能获得功能性胰岛β细胞, 研究人员进行了大量研究, 提出了多种研究途径, 主要包括:(1)通过诱导体内存有的胰岛β细胞进行增殖; (2)通过诱导多能干细胞(ESC/iPSC)分化为胰岛β细胞; (3)通过终末分化细胞重编程为胰岛 β细胞来提供功能性细胞(图1)。其中细胞重编程在诱导终末分化细胞产生胰岛β样细胞(胰岛β细胞)方面呈现了新的生机活力, 为治疗 1型糖尿病带来了新希望。另外, 通过自身终末分化细胞重编程得到的胰岛素分泌细胞再移植来治疗疾病能有效避免免疫排斥反应, 使得这一研究更具有重要意义。为此, 本文就胰腺早期发育、胰腺发育相关的转录调控因子及近年来终末分化细胞重编程为胰岛β细胞的相关研究进行了综述, 以期使终末分化细胞重编程性的研究内容更加系统化, 对具体的分化实验进行理论指导。
1 胰腺早期发育
1.1 胰腺来源及早期发育的相关研究
小鼠(Mus musculus)胰腺产生源于前肠内胚层的背腹侧区域。小鼠在胚胎13~14 d形成胰腺, 最早在胚胎期 8.5~9.5dpc内胚层突出发育为早期胰腺的芽体(胰腺前体细胞)[1,2]。科研人员对小鼠胰腺前体细胞的分化来源进行了相关研究。2005年Tremblay等[3]基于活体染料染色的谱系追踪图谱, 对内脏前体细胞的分布及其随后分化进程的变化情况进行了一系列实验, 发现了两种不同的内胚层前体细胞类型, 其中中肠内胚层前体细胞作为内脏组织的前体细胞继续发育, 最早胰腺前体细胞也来源于此。2008年 Franklin等[4]应用同样的方法揭示了内胚层前体细胞的区域分布性, 并发现在前肠内胚层区域的细胞出现不对称分布, 随着胚胎的发育在原肠上皮的背腹侧区域细胞会逐渐形成胰腺原基。针对小鼠胚胎发育内胚层前体细胞区域分布性, Lewis等[5]综述了在原肠胚阶段表胚层细胞形成终末内胚层后其细胞的命运情况, 强调内胚层前体细胞的区域化与内胚层形成同步性。在胚胎发生原肠作用时很可能就伴随着胰腺前体细胞的形成, 该假说在非洲爪蛙(Xenopus laevis)中得以证实, 在原肠作用期间每个胚胎通过背侧注射25 pg mRNA含量的造血表达同源异形盒(hhex)检测对腹侧胰腺前体细胞的形成及影响, 结果发现存在 vpp1阳性细胞[6], 找到这一类基因将更有助于对胰腺早期发育进行相关研究。而小鼠胰腺发育则起始于胚胎 6~10体节期(胚胎8.0~8.5 d), Wessells等[2]取6体节期的内胚层与胚胎11 d胰腺间质进行共培养使得胰腺形成发育, 指出早在胰腺间质积聚之前胰腺已经开始发育。胰腺发育起始阶段, 脊索与背内胚层直接相连并在一定程度上调控胰腺器官发育[7]。在 14体节期, 开始有内分泌细胞分化形成, 到28体节期大约为胚胎发育第10 d胰腺各部分组成已基本形成(图2)。

图1 终末分化细胞重编程为胰岛β细胞简图
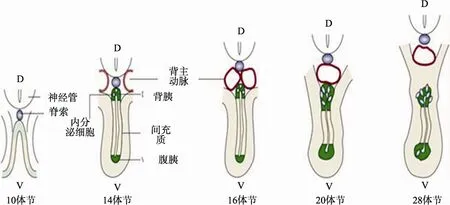
图2 胰腺器官形成早期阶段截面图(胚胎8~10 d)(根据参考文献[8]修改)
1.2 胰腺发育中相关信号调控
早期的细胞基因标记以及嵌合体小鼠实验都对胰腺的发生及其来源进行了相关研究, 研究表明胰腺内、外分泌细胞类型来源相同, 都起源于共同的细胞群体——祖内胚层细胞[9~11]。在胰腺早期发育阶段, 相关信号的逐步调控起着非常重要的诱导作用, 最先接受邻近胚层信号调控的内胚层细胞发育为胰腺前体细胞。在原肠胚作用阶段, Stafford 等[12]在斑马鱼(Danio rerio)中用突变体阻断视黄酸(RA)信号通路来研究胰腺发育情况, 首次证明在原肠作用结束之前视黄酸信号通路的活性对胰腺发育具有极其重要的作用。Chen等[13]在非洲爪蛙中同样证实了视黄酸信号通路活性对胰腺发育是必不可少的,并提出RA在背胰腺发育过程中对Notch信号通路有阻断作用, 这与 Hald等[14]研究 Notch1信号通路对早期胰腺发育有抑制作用的结论相统一。对于RA信号通路的研究已在小鼠实验中得到证实, 2005年Martin等[15]在敲除视黄醛脱氢酶 2基因(Raldh2)的小鼠中发现背胰腺前体细胞不能形成, 表明 RA对背胰腺发育是非常重要的。同年, Molotkov等[16]对RA的来源及对背胰腺内胚层形成的必要性也做了相关的研究并得到证实。在小鼠胚胎7.5 d以后, 内胚层细胞受临近中胚层和外胚层信号调控表达胰腺特异性基因, 对于此阶段内胚层细胞信号的调控, Wells等[17]通过体外胚叶移植体实验, 证实了小鼠早期内胚层分化模式是受相邻胚层信号调控的。随后在胚胎8.5 d左右, 来自于脊索的信号也调控着早期胰腺发育过程。成纤维细胞生长因-2(FGF2)和激活素 β(activinβ)作为脊索信号调节因子对胰腺早期发育具有重要作用[11,18]。随着胰腺的发育, 随后的信号调控是围绕胚胎胰腺上皮细胞的间充质, 它调控着早期胰腺上胚层细胞增殖分化产生胰腺内外分泌组织这一发育过程[19]。Lammert等[20]通过胚胎鼠内胚层体外分离、非洲爪蟾胚胎背部动脉移除和转基因小鼠 3个不同的实验系统, 证明来自血管内皮细胞的调控信号能诱导胰腺分化, 这也证实了在早期胚胎发育中胰岛与血管之间存在生理性上的联系。在胰腺内分泌前体细胞形成胰岛 β细胞的研究中, Sussel等[21]提出同源异型结构域转录因子Nkx2.2对分泌胰岛素的胰岛 β细胞正常分化是非常重要的,他们利用免疫组织化学分析Nkx2.2突变胚胎鼠不但没有胰岛β细胞的产生而且对于产生胰高血糖素的α细胞和PP细胞也几乎不存在。2004年Prado等[22]报道Nkx2.2突变的胰腺内分泌细胞被另一种能分泌胃饥饿素的“ε”细胞群所取代, 此种“ε”细胞则主要存在于胃中。他们还证实Pax4突变鼠同样有此种表型, 并提出胰岛素分泌细胞和胃饥饿素分泌细胞可能来源于共同的祖细胞。此种能分泌胃饥饿素的胰岛“ε”细胞作为第 5种胰岛内分泌细胞已被广泛接受。胰岛最终的分化产生是胰腺前体细胞在转化生长因子-β(TGFβ)、活化基质金属蛋白酶-2(MMP-2)的作用下完成的。
2 胰腺相关转录调控因子
哺乳动物胰腺发育过程中存在很多转录因子,包括胰腺-十二指肠同源盒基因-1(Pdx1)、基因神经元素 3(Ngn3)、肌腱膜纤维肉瘤癌基因同系物A(MafA)、髓鞘转录因子3(Myt3)、胰岛因子1(Isl1)、胰岛特异性转录因子配对盒-4(Pax4)、人类配对盒基因6( Pax6)、神经源性分化蛋白(NeuroD)、NK2相关的同源转录因子 Nkx2.2(Nkx2.2)、运动神经元和胰腺同源框(MNX1)等, 它们对胰腺发育的各个阶段具有重要地调控作用。胰腺相关转录因子的研究报道增强了人们对胰腺来源及发育进程的认知, 在理论上明确了细胞重编程产生胰腺细胞的可能性,对治疗糖尿病、再生胰岛β细胞具有重要的意义。
Pdx1又称胰岛素启动子, 在胰腺的形成和β细胞的分化、形成、成熟等方面起着至关重要的作用。PDX1在早期胰腺芽体所有上皮细胞中表达, 标记分化为胰腺潜在多能性细胞群, 但在胰岛 β细胞形成后限制其高水平表达。PDX1缺陷的小鼠内胚层仍能突出形成早期芽体但胰腺的形态发生以及分化都被阻滞[15], 这也影响了腺泡细胞的成熟发育。然而维持 Pdx1低表达量则能有效的促使腺泡细胞的形成与分化[23], 并对肠上皮细胞很多方面的分化也有促进作用, 比如肠胃内内分泌细胞的特化及胃十二指肠交界处结构的形成[24]。
Ngn3是螺旋-环-螺旋家族转录因子中的一员, Ngn3蛋白在神经系统的离散区域和胚胎胰腺前体细胞中表达, 它能启动胰腺前体细胞分化为胰腺内分泌细胞。缺失Ngn3的小鼠不能产生任何胰腺内分泌细胞, 并且出生后死于糖尿病[25], 细胞系谱追踪试验证实了 Ngn3阳性细胞即为胰岛前体细胞[26]。2009年Wang等[27]证实高表达Ngn3对胰腺祖细胞分化为胰腺内分泌部是非常重要的。Ngn3因子的表达标志着早期胰腺内分泌细胞前体的形成, 对胰岛内分泌细胞分化起着决定作用。
MafA是胰岛素基因转录的有效活化剂, 作为Maf转录因子家族中的一员, 特异表达于胰岛 β细胞中, 参与调节胰岛素合成、分泌和糖代谢等相关基因的表达, 还参与调节 β细胞其他转录因子PDX-1和β细胞E盒反式作用因子2 (BETA2)的表达[28], 对于胰岛 β细胞增殖和激活是必不可少的。选择性过表达MafA能够诱导内生性胰岛素mRNA的产生。Maf 家族的另一成员MafB则可以特异性地促进胰高血糖素的表达[29]。新近的研究结果[30]表明, 胰腺内源性前体细胞的正常分化在特定阶段需要MafA短暂性地诱导表达, 若过早诱导MafA表达则会阻滞这一分化进行, 虽然该阻滞是可逆的, 但MafA这一效应性表达在胰岛内分泌细胞分化形成中是非常重要的。
Fgf10是成纤维生长因子(FGFs)家族成员, 表达在胰腺胚芽背腹区域的间充质内, 对Pdx1阳性细胞的产生有信号调控作用, 另外 Fgf10对早期胰腺发育信号调控具有重要作用。Fgf10缺陷鼠胰腺上皮分化和形态发生都被抑制[31]。Miralles等[32]证实Fgf10和 Notch信号通路间的相互作用对胰腺前体细胞的自我更新是非常重要的。Notch信号通路在对胰腺前体细胞作用的同时, Fgf10信号作为其下游介质在这一过程中起重要作用。
Myt3是成人胰岛MYT家庭成员之一, 在胚胎(E18.5d)之后它表达在胰腺重要的内分泌细胞类型中。Myt3的表达直接调控 Foxa2、Neurod1和Pdx1的表达, 对 β细胞的正常发育及其功能至关重要。Ngn3通过改变 Myt3最初核染色质的状态来诱导Myt3表达。抑制Myt3的小鼠, 胰岛素含量减少, β细胞的凋亡增加[33]。
3 终末分化细胞重编程为胰岛β细胞相关研究
2008年美国科学杂志评选出的十大科学进展中细胞重编程被评为第一位。通过细胞重编程, 已分化的细胞在特定的条件下通过高表达几个相关基因后能被逆转并恢复到全能性状态而产生诱导性多功能干细胞(iPSCs)[34~36], 或者进一步发育成一个新的个体。细胞重编程的研究开启了生物学的新领域,对其他相关基础细胞的研究提供了新工具。细胞重编程对胰岛 β细胞的再生、重构功能性胰岛素分泌样细胞具有重要的研究意义, 这种方法有望应用于糖尿病的临床治疗。
3.1 腺泡细胞重编程为胰岛β细胞
腺泡细胞属于胰腺外分泌部的组成成分, 呈锥形, 尖端朝向腺泡腔。腺泡细胞中酶原颗粒的内容构成胰液中的主要蛋白成分, 参与合成消化液。腺泡细胞的特定结构与其功能相适应, 经过重编程后转化成胰岛β细胞。2008年, Zhou等[37]选取Ngn3、Pdx1 和MafA这3个转录因子, 通过病毒一次性转导入腺泡细胞, 成功地将腺泡细胞转化为胰岛素分泌细胞。他们通过细胞系谱追踪实验进一步确认了癌胚抗原肽(Cpa1)阳性成熟的腺泡细胞编程为胰岛素分泌样细胞, 更重要的是这些细胞表达胰岛 β细胞关键标志因子Nkx6.1、Glut2 (葡萄糖转运蛋白2)和葡萄糖激酶, 而不再表达调控腺泡细胞功能性的关键基因胰腺特异性转录因子 1a(Ptf1a)和淀粉酶,也不表达除胰岛素以外的其他任何胰岛激素。此外,小鼠体内实验证实了腺泡细胞的重编程性。Zhou等[38]通过注射冷冻普通腺病毒, 将 Ngn3、Pdx1、MafA 3种因子注入体内缺乏胰岛β细胞的病鼠胰腺内, 结果胰腺内大约 20%的外分泌细胞转化成胰岛β细胞。这一研究利用基因重组技术, 实现不同种类成体细胞间的直接转化, 为再生医疗开辟了新途径。由腺泡细胞重编程为胰岛β细胞的工作在斑马鱼的研究中也得以实现, 2011年Hesselson等[39]通过抑制斑马鱼单一转录因子Ptf1a/p48的活性, 采用遗传系谱追踪的方法证实了腺泡细胞能重编程为胰岛素分泌样细胞。2013年Furuya等[40]证实了甲状腺激素受体 α(TRα)与其配体 p85α作用后能激活磷脂酰肌醇-3-激酶(PI3K)信号通路, 并诱导胰腺腺泡细胞重编程为胰岛分泌样细胞。
尽管通过Ngn3、Pdx1和MafA这3个转录因子的转染使腺泡细胞在小鼠体内转化成了胰岛β样细胞, 甚至可以在斑马鱼中通过抑制单一转录因子实现此转分化, 但他们并不足以使一些成体细胞(如肌细胞、成纤维细胞)重编程为胰岛β细胞。目前, 关于小鼠或人成体细胞在体外重编程为胰岛 β细胞的研究还未见报道, 一方面是由于相关转录因子选取不足及不够准确, 另一方面可能涉及到体外培养条件不成熟, 在一定程度上对体外诱导胰岛β细胞的生物学特性产生了很大的影响。另外, 更值得关注的是腺细胞重编程为胰岛 β细胞潜在的临床应用性。要达到临床应用的目标, 需有效解决病毒转染细胞所带来的安全问题。
3.2 胰岛α细胞重编程为胰岛β细胞
另一个更深入研究重编程转化为胰岛β细胞的例子是 Collombat等[41]成功地将成年小鼠的 α细胞重编程为胰岛素分泌细胞。他们发现在小鼠体内通过异位表达Pax4就足以使小鼠的α细胞重编程为胰岛β细胞。在生理结构上α细胞与胰岛β细胞都属于胰腺内分泌部, 且都来源于前体祖细胞。它们一定程度上有着相似的功能, 或许能在特定条件下相互转变。2010年Thorel等[42]首先利用白喉毒素筛除β细胞成功构建转基因小鼠, 然后采用系谱标记追踪α细胞转分化为了胰岛β细胞。2011年Yang等[43]报道在 Ngn3表达的内分泌前体细胞中增加单一外源性Pdx1的表达能使得胚胎发育阶段的α细胞转分化为 β细胞。这些研究显示, 在内分泌前体细胞与激素分泌细胞间通过特定转录因子的诱导能呈现出很有效的可塑性, 使得 1型糖尿病的治疗前景更为可观。2013年Bramswig等[44]利用人和鼠的胰岛作为实验材料, 通过在添加有组蛋白甲基转移酶抑制剂的培养基里培养胰岛, 证明了表观基因组的可塑性能使得胰腺α细胞重编程为胰岛β细胞。最近的研究揭示, 在基因层面上 α细胞的二价染色质因子如Pdx1和MafA都处在非激活状态, 然而在β细胞中则是激活状态。科研人员需要进一步探索, 以寻找内在的条件使α细胞稳定的重编程为胰岛β细胞。
3.3 其他终末分化细胞重编程为胰岛β细胞
肝与胰岛在胚胎发育早期来源相同, 都来源于由上胚层细胞分化来的内胚层部分, 由此可见肝细胞也可被转分化为胰岛素分泌细胞。Ferber等[45]最先利用重组腺病毒介导基因, 将Pdx1转导入肝细胞中激活内源性胰岛素的表达, 明显地改善链脲霉素诱导产生的高血糖症。随后相关报道证实了胰腺发展过程中一些调控转录因子, 如MafA、NeuroD1、Ngn3等在肝细胞中高表达并具有诱导胰岛细胞分化的潜能, 但这些转录因子在诱导胰岛细胞重编程过程中, 单个基因的编程性作用目前还不清楚[46~48]。2009年Motoyama等[48]报道了把原代培养的肝细胞高表达Pdx1 和Ngn3两个转录因子后, 能使肝细胞重编程为胰岛分泌样细胞, 该项工作采用了非病毒转染的方式提高细胞重编程的安全性, 具有潜在的临床应用价值。除此之外Talchai等[49]则选取小鼠肠道上皮细胞选择性的敲除 Foxo1(FoxO亚家族中的转录因子)使其重编程产生胰岛素分泌样细胞, 并表达胰岛 β细胞相关标记基因, 这项工作表明肠内分泌前体细胞存在活性的Foxo1时能有效的阻滞其向胰岛素分泌细胞的分化, 并为获得功能性的胰岛 β细胞来治疗1型糖尿病提供了新的重编程途径。Lee等[50]则通过流式细胞术分选出人胰腺导管细胞体外培养, 然后利用腺病毒介导的转染系统高表达Neurog3、MafA、Pdx1 和 Pax6四种转录因子成功地将胰腺导管细胞重编程为具有分泌胰岛素功能的胰岛 β细胞, 该研究使得人胰腺导管细胞重编程为分泌胰岛素的胰岛β细胞成为可能。Wang等[51]的研究表明, 通过向鼠肝细胞中转导4个Yamanaka转录因子OCT4(POU5f1转录因子4)、SOX2(性别决定基因相关转录因子 2)、kLF4(腹黑果蝇样因子 4)和C-MYC(原癌基因)重编程为胰腺祖细胞, 这种重编程机制能更容易诱导胰岛β细胞的分化。
3.4 细胞重编程为人胰岛β细胞
科研人员利用细胞重编程探究人的胰岛细胞分化做了大量的研究。2012年有研究报道从成人胰腺分离出的管细胞, 经过腺病毒转导高表达转录因子Ngn3后能激发导管细胞表达胰岛内分泌细胞特定标记基因, 并重编程为胰岛 β样细胞, 但阳性率不到10%, 而添加髓鞘转录因子(Myt1)或抑制δ-Notch信号通路都能有效的加强 Ngn3对导管细胞的重编程[52]。尽管有报道称用腺病毒转导MafA、Pdx1 和Ngn3这3个转录因子能有效的重编程未成年免疫缺陷鼠腺泡细胞为胰岛分泌样细胞[38], 但在此项研究中这些转录因子的联合并不能有效地使人的胰腺导管细胞重编程为胰岛 β样细胞, 反而与单独转导Ngn3相比效率会更低。这一研究虽然能得到胰岛β细胞, 但重编程效率低, 还亟需更好的优化实验方案。2013年, Dave等[53]分离56位志愿者腹部脂肪,在不添加其他异种因子的特殊培养基上培养10 d后进行分化实验, 以未分化的间充质干细胞在未分化培养基中培养作为对照。通过上调Pax-6、胰岛素启动因子1(Ipf-1)、Isl-1这3种胰腺发育相关因子使人的脂肪组织分化产生胰岛分泌样细胞。Katz等[54]报道人的皮肤成纤维细胞经过表观遗传修饰耦合转录因子调控为胰岛样细胞, 该研究为转分化胰岛样细胞提供了一种新的途径。另外, Lima等[55]成功地报道了人胰腺外分泌部分重编程为胰岛β样细胞。他们首先将其进行培养, 去分化后的细胞再经过腺病毒转染Pdx1、Ngn3、MafA和Pax4四个转录因子后重编程为分泌胰高血糖素的 α样细胞, 然而在未进行转染前先抑制原代细胞的去分化状态后, 胰腺外分泌部细胞就将重编程为分泌胰岛素的胰岛β样细胞, 这些细胞通过移植到免疫缺陷糖尿病鼠体内确实能有效的调控其正常血糖含量, 有效地证实了重编程得到的胰岛β样细胞的功能性。
4 结语与展望
通过重编程得到高质量的胰岛 β细胞还需要很多探索, 不仅需要分化细胞有分泌激素功能, 更需要对编程性的胰岛 β细胞在功能上进行各个方面的检测验证。对于当前重编程为胰岛β的研究还有很大探索空间, 一方面重编程试验研究要从体内转化到体外, 使重编程更加稳定; 另一方面重编程因子的转导需要更加安全和高效。
尽管细胞重编程在功能性β细胞的产生和增殖上已取得了巨大的进步, 但仍存在着很多问题, 例如重编程细胞的安全性及胰岛β细胞能否用于细胞疗法等, 这就要求必须找到一种高效、可靠的方法来引发细胞再编程, 这将是以后研究的重点。细胞重编程为再生医学又开辟了一条新道路, 为最终治愈糖尿病带来了希望。
[1] Golosow N, Grobstein C. Epitheliomesenchymal interaction in pancreatic morphogenesis. Dev Biol, 1962, 4(2): 242–255.
[2] Wessells NK, Cohen JH. Early pancreas organogenesis: morphogenesis, tissue interactions, and mass effects. Dev Biol, 1967, 15(3): 237–270.
[3] Tremblay KD, Zaret KS. Distinct populations of endoderm cells converge to generate the embryonic liver bud and ventral foregut tissues. Dev Biol, 2005, 280(1): 87–99.
[4] Franklin V, Khoo PL, Bildsoe H, Wong N, Lewis S, Tam PP. Regionalisation of the endoderm progenitors and morphogenesis of the gut portals of the mouse embryo. Mech Dev, 2008, 125(7): 587–600.
[5] Lewis SL, Tam PPL. Definitive endoderm of the mouse embryo: formation, cell fates, and morphogenetic function. Dev Dyn, 2006, 235(9): 2315–2329.
[6] Zhao H, Han D, Dawid IB, Pieler T, Chen Y. Homeoprotein hhex-induced conversion of intestinal to ventral pancreatic precursors results in the formation of giant pancreata in Xenopus embryos. Proc Nat Acad Sci USA, 2012, 109(22): 8594–8599.
[7] Kim SK, Hebrok M, Melton DA. Notochord to endoderm signaling is required for pancreas development. Development, 1997, 124(21): 4243–4252.
[8] Edlund H. Pancreatic organogenesis-developmental mechanisms and implications for therapy. Nature Rev Genet, 2002, 3(7): 524–532.
[9] Deltour L, Leduque P, Paldi A, Ripoche MA, Dubois P, Jami J. Polyclonal origin of pancreatic islets in aggregation mouse chimaeras. Development, 1991, 112(4): 1115–1121.
[10] Herrera PL. Adult insulin-and glucagon-producing cells differentiate from two independent cell lineages. Development, 2000, 127(11): 2317–2322.
[11] Jensen J, Heller RS, Funder-Nielsen T, Pedersen EE, Lindsell C, Weinmaster G, Madsen OD, Serup P. Independent development of pancreatic alpha-and beta-cells from neurogenin3-expressing precursors: a role for the notch pathway in repression of premature differentiation. Diabetes, 2000, 49(2): 163–176.
[12] Stafford D, Prince VE. Retinoic acid signaling is required for a critical early step in zebrafish pancreatic development. Curr Biol, 2002, 12(14): 1215–1220.
[13] Chen YL, Pan FC, Brandes N, Afelik S, Solter M, Pieler T. Retinoic acid signaling is essential for pancreas development and promotes endocrine at the expense of exocrine cell differentiation in Xenopus. Dev Biol, 2004, 271(1): 144–160.
[14] Hald J, Hjorth JP, German MS, Madsen OD, Serup P, Jensen J. Activated Notch1 prevents differentiation of pancreatic acinar cells and attenuate endocrine development. Dev Biol, 2003, 260(2): 426–437.
[15] Martin M, Gallego-Llamas J, Ribes V, Kedinger M, Niederreither K, Chambon P, Dolle P, Gradwohl G. Dorsal pancreas agenesis in retinoic acid-deficient Raldh2 mutant mice. Dev Biol, 2005, 284(2): 399–411.
[16] Molotkov A, Molotkova N, Duester G. Retinoic acid generated by Raldh2 in mesoderm is required for mouse dorsal endodermal pancreas development. Dev Dyn, 2005, 232(4): 950–957.
[17] Wells JM, Melton DA. Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development, 2000, 127(8): 1563–1572.
[18] Hebrok M, Kim SK, Melton DA. Notochord repression of endodermal Sonic hedgehog permits pancreas development. Genes Dev, 1998, 12(11): 1705–1713.
[19] Pictet R, Rutter W. Development of the embryonic pancreas. In: Steiner DF, Frenkel N, eds. Handbook in Physiology. Vol 1. Baltimore MD: Williams & Wilkins, 1972: 25–66.
[20] Lammert E, Cleaver O, Melton D. Induction of pancreatic differentiation by signals from blood vessels. Science, 2001, 294(5542): 564–567.
[21] Sussel L, Kalamaras J, Hartigan-O'Connor DJ, Meneses JJ, Pedersen RA, Rubenstein JL, German MS. Mice lacking the homeodomain transcription factor Nkx 2.2 have diabetes due to arrested differentiation of pancreatic beta cells. Development, 1998, 125(12): 2213–2221.
[22] Prado CL, Pugh-Bernard AE, Elghazi L, Sosa-Pineda B, Sussel L. Ghrelin cells replace insulin-producing β cells in two mouse models of pancreas development. Proc Natl Acad Sci USA, 2004, 101(9): 2924–2929.
[23] Holland AM, Hale MA, Kagami H, Hammer RE, Mac-Donald RJ. Experimental control of pancreatic development and maintenance. Proc Natl Acad Sci USA, 2002, 99(19): 12236–12241.
[24] Fujitani Y, Fujitani S, Boyer DF, Gannon M, Kawaguchi Y, Ray M, Shiota M, Stein RW, Magnuson MA, Wright CV. Targeted deletion of a cis-regulatory region reveals differential gene dosage requirements for Pdx1 in foregut organ differentiation and pancreas formation. Genes Dev, 2006, 20(2): 253–266.
[25] Gradwohl G, Dierich A, LeMeur M, Guillemot F. neurogenin3 is required for the development of the four endocrine cell lineages of the pancreas. Proc Natl Acad Sci USA, 2000, 97(4): 1607–1611.
[26] Gu G, Dubauskaite J, Melton DA. Direct evidence for the pancreatic lineage: NGN3 positive cells are islet progenitors and are distinct from duct progenitors. Development, 2002, 129(10): 2447–2457.
[27] Wang S, Jensen JN, Seymour PA, Hsu W, Dor Y, Sander M, Magnuson MA, Serup P, Gu G. Sustained Neurog3expression in hormone-expressing islet cells is required for endocrine maturation and function. Proc Natl Acad Sci USA, 2009, 106(24): 9715–9720.
[28] Aramata S, Han SI, Kataoka K. Roles and regulation of transcription factor MafA in islet beta-cells. Endocr J, 2007, 54(5): 659–666.
[29] Artner I, Hang Y, Mazur M, Yamamoto T, Guo M, Lindner J, Magnuson MA, Stein R. MafA and MafB regulate genes critical to β-cells in a unique temporal manner. Diabetes, 2010, 59(10): 2530–2539.
[30] He KH, Juhl K, Karadimos M, El Khattabi I, Fitzpatrick C, Bonner-Weir S, Sharma A. Differentiation of pancreatic endocrine progenitors reversibly blocked by premature induction of MafA. Dev Biol, 2014, 385(1): 2–12.
[31] Bhushan A, Itoh N, Kato S, Thiery JP, Czernichow P, Bellusci S, Scharfmann R. Fgf10 is essential for maintaining the proliferative capacity of epithelial progenitor cells during early pancreatic organogenesis. Development, 2001, 128(24): 5109–5117.
[32] Miralles F, Lamotte L, Couton D, Joshi RL. Interplay between FGF10 and Notch signalling is required for the self-renewal of pancreatic progenitors. Int J Dev Biol,2006, 50(1): 17.
[33] Tennant BR, Islam R, Kramer MM, Merkulova Y, Kiang RL, Whiting CJ, Hoffman BG. The Transcription Factor Myt3 Acts as a Pro-Survival Factor in β-cells. PloS ONE, 2012, 7(12): e51501.
[34] Huang PY, He ZY, Ji SY, Sun HW, Xiang D, Liu CC, Hu YP, Wang X, Hui LJ. Induction of functional hepatocyte-like cells from mouse fibroblasts by defined factors. Nature, 2011, 475(7356): 386–389.
[35] Ieda M, Fu JD, Delgado-Olguin P, Vedantham V, Hayashi Y, Bruneau BG, Srivastava D. Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors. Cell, 2010, 142(3): 375–386.
[36] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 2006, 126(4): 663–676.
[37] Zhou Q, Melton DA. Extreme makeover: converting one cell into another. Cell Stem Cell, 2008, 3(4): 382–388.
[38] Zhou Q, Brown J, Kanarek A, Rajagopal J, Melton DA. In vivo reprogramming of adult pancreatic exocrine cells to β-cells. Nature, 2008, 455(7213): 627–632.
[39] Hesselson D, Anderson RM, Stainier DYR. Suppression of Ptf1a activity induces acinar-to-endocrine conversion. Curr Biol, 2011, 21(8): 712–717.
[40] Furuya F, Shimura H, Asami K, Ichijo S, Takahashi K., Kaneshige M, Oikawa Y, Aida K, Endo T, Kobayashi T. Ligand-bound thyroid hormone receptor contributes to reprogramming of pancreatic Acinar cells into insulinproducing cells. J Biol Chem, 2013, 288(22): 16155–16166.
[41] Collombat P, Xu X, Ravassard P, Sosa-Pineda B, Dussaud S, Billestrup N, Madsen OD, Serup P, Heimberg H, Mansouri A. The ectopic expression of Pax4 in the mouse pancreas converts progenitor cells into α and subsequently β Cells. Cell, 2009, 138(3): 449–462.
[42] Thorel F, Népote V, Avril I, Kohno K, Desgraz R, Chera S, Herrera PL. Conversion of adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss. Nature, 2010, 464(7292): 1149–1154.
[43] Yang YP, Thorel F, Boyer DF, Herrera PL, Wright CV. Context-specific α-to-β-cell reprogramming by forced Pdx1 expression. Genes Dev, 2011, 25(16): 1680–1685.
[44] Bramswig NC, Everett LJ, Schug J, Dorrell C, Liu C, Luo Y, Streeter PR, Naji A, Grompe K, Kaestner KH. Epigenomic plasticity enables human pancreatic α to β cell reprogramming. J Clin Invest, 2013, 123(3): 1275–1284.
[45] Ferber S, Halkin A, Cohen H, Ber I, Einav Y, Goldberg I, Barshack I, Seijffers R, Kopolovic J, Kaiser N, Karasik A. Pancreatic and duodenal homeobox gene 1 induces expression of insulin genes in liver and ameliorates streptozotocininduced hyperglycemia. Nature Med, 2000, 6(5): 568–572.
[46] Kaneto H, Nakatani Y, Miyatsuka T, Matsuoka TA, Matsuhisa M, Hori M, Yamasaki Y. PDX-1/VP16 fusion protein, together with NeuroD or Ngn3, markedly induces insulin gene transcription and ameliorates glucose tolerance. Diabetes, 2005, 54(4): 1009–1022.
[47] Song YD, Lee EJ, Yashar P, Pfaff LE, Kim SY, Jameson JL. Islet cell differentiation in liver by combinatorial expression of transcription factors neurogenin-3, BETA2, and RIPE3b1. Biochem Biophys Res Commun, 2007, 354(2): 334–339.
[48] Motoyama H, Ogawa S, Kubo A, Miwa S, Nakayama J, Tagawa Y, Miyagawa S. In vitro reprogramming of adult hepatocytes into insulin-producing cells without viral vectors. Biochem Biophys Res Commun, 2009, 385(1): 123–128.
[49] Talchai C, Xuan SH, Kitamura T, DePinho RA, Accili D. Generation of functional insulin-producing cells in the gut by Foxo1 ablation. Nat Genet, 2012, 44(4): 406–412.
[50] Lee J, Sugiyama T, Liu Y, Wang J, Gu X, Lei J, Markmann JF, Miyazaki S, Miyazaki J, Szot GL, Bottino R, Kim SK. Expansion and conversion of human pancreatic ductal cells into insulin-secreting endocrine cells. Elife, 2013, 19(2): e00940.
[51] Wang Q, Wang H, Sun Y, Li SW, Donelan W, Chang LJ Jin S, Terada N, Cheng H, Reeves W, Yang LJ. Reprogrammed pancreatic progenitor-like intermediate state of hepatic cells is more susceptible to pancreatic beta cell differentiation. J Cell Sci, 2013, 126(Pt 16): 3638–3648.
[52] Swales N, Martens GA, Bonné S, Heremans Y, Borup R, Van de Casteele M, Ling Z, Pipeleers D, Ravassard P, Nielsen F, Ferrer J, Heimberg H. Plasticity of adult human pancreatic duct cells by neurogenin3-mediated reprogramming. PloS ONE, 2012, 7(5): e37055.
[53] Dave SD, Vanikar AV, Trivedi HL. In-vitro generation of human adipose tissue derived insulin secreting cells: up-regulation of Pax-6, Ipf-1 and Isl-1. Cytotechnology, 2014, 66(2): 299–307.
[54] Katz LS, Geras-Raaka E, Gershengorn MC. Reprogramming adult human dermal fibroblasts to islet-like cells by epigenetic modification coupled to transcription factor modulation. Stem Cells Dve, 2013, 22(18): 2551–2560.
[55] Lima MJ, Muir KR, Docherty HM, Drummond R, McGowan NW, Forbes S, Heremans Y, Houbracken I, Ross JA, Forbes SJ, Ravassard P, Heimberg H, Casey J, Docherty K. Suppression of epithelial-to-mesenchymal transitioning enhances ex vivo reprogramming of human exocrine pancreatic tissue toward functional insulinproducing β-like cells. Diabetes, 2013, 62(8): 2821–2833.
(责任编委: 杨泽)
Progress in early pancreas development and reprogramming of terminally differentiated cells into β cells
Mingjun Cao1, Huansheng Dong2, Qingjie Pan1, Hongjun Wang1, Xiao Dong3
1. College of Animal Science, Qingdao Agricultural University, Qingdao 266109, China;
2. Department of Surgery, Medical University of South Carolina, Charleston, SC 29425, USA;
3. College of Life Science, Qingdao Agricultural University, Qingdao 266109, China
Type 1 diabetes mellitus (T1DM) is an autoimmune disease in which the immune system attacks insulin-secreting β cells, thus leading to an absolute deficiency of insulin. Patients must rely on exogenous insulin, which cannot effectively prevent diabetes complications. Generation of insulin-secreting cells by reprogramming of pluripotent stem cells or somatic cells is a potential approach for the treatment of T1DM. These cells can be used for cell therapy and drug screening, and may eventually provide a cure for the disease. Significant progress has been made in generating insulin-secreting cells through the expression of β cell specific transcription factors in stem cells or somatic cells. In this review,we summarize recent research progress in early pancreas development, β cell specific transcription factors and reprogramming of terminally differentiated cells into β cells.
type 1 diabetes; β cell generation; pancreatic transcription factor; cell reprogramming
2013-11-05;
2014-01-06
青岛农业大学高层次人才科研基金(编号:631114)资助
曹明君, 硕士研究生, 专业方向:动物生殖发育与基因工程。E-mail: caomingjun19881112@163.com
董晓, 博士, 副教授, 研究方向:生殖生理。E-mail: 1163553518@qq.com
王红军, 博士, 副教授, 研究方向:糖尿病的细胞和药物治疗。E-mail: hjwang11@hotmail.com
10.3724/SP.J.1005.2014.0511
时间: 2014-5-4 15:26:29
URL: http://www.cnki.net/kcms/detail/11.1913.R.20140504.1526.002.html

